Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 496, № 1, стр. 37-43
Химия экстракции Nd(NO3)3 и Pr(NO3)3 из нитратных растворов смесями ТОМАН–ТБФ в толуоле
С. И. Степанов 1, 2, *, Нгуен Тхи Иен Хоа 1, член-корреспондент РАН А. М. Чекмарев 1, 2, академик РАН А. Ю. Цивадзе 2
1 Российский химико-технологический университет имени Д.И. Менделеева
125047 Москва, Россия
2 Институт физической химии и электрохимии
имени А.Н. Фрумкина Российской академии наук
119071 Москва, Россия
* E-mail: chao_step@mail.ru
Поступила в редакцию 02.11.2020
После доработки 07.12.2020
Принята к публикации 12.01.2021
Аннотация
Методом изомолярных серий установлены границы областей синергетной экстракции празеодима и неодима из нитратных низкокислотных растворов с высаливателем нитратом аммония изомолярными смесями нитрата метилтри-н-октиламмония и три-н-бутилфосфата в толуоле. Показано, что синергетный эффект при экстракции празеодима проявляется в ограниченной области составов смесей, а при экстракции неодима – во всей области изученных составов. Установлено, что химия синергетной экстракции определяется непрерывной последовательностью образования смешанных комплексов празеодима и неодима с антибатным изменением числа молекул экстрагентов в их составе в зависимости от мольного соотношения. С ростом концентрации нитрата четвертичного аммония в смеси фосфорильные лиганды три-н-бутилфосфата замещаются нитратными лигандами четвертичной соли, вплоть до их полного вытеснения из координационной сферы лантаноида.
ВВЕДЕНИЕ
Смеси нитратов четвертичных аммониевых оснований (ЧАО) с нейтральными фосфорорганическими соединениями (НФОС), в том числе нитраты метилтриалкиламмония (ТАМАН) и метилтри-н-октиламмония (ТОМАН) с три-н-бутилфосфатом (ТБФ), и их растворы в органическом растворителе проявляют синергетные свойства при экстракции редкоземельных элементов (РЗЭ) из нитратных растворов с низкой 0.01–0.2 М концентрацией азотной кислоты (низкокислотные нитратные растворы). Синергетные свойства смесей ТАМАН–ТБФ позволяют использовать их для разделения РЗЭ из нитратных растворов, в частности РЗЭ средней группы – Sm, Eu и Gd, – в промышленном масштабе [1]. Коэффициенты разделения элементов средней группы по линии Sm/Gd в отсутствие значимых количеств Eu, выделенного из смесей осадительными мето-дами [2, с. 82–84], достигают значений более 3.5–4 растворами смесей, содержащих 65% ТАМАН + 35% ТБФ в углеводородном разбавителе, например, керосине [3].
Химия синергетной экстракции нитратами ЧАО в смеси с НФОС обусловлена образованием смешанных комплексов металла комплексообразователя с нитратными группами четвертичной соли и фосфорильными группами НФОС. Основные исследования по химии экстракции РЗЭ этими смесями из нитратных растворов проводились до начала 2000-х годов, после чего наблюдался спад публикаций, вызванный значительным снижением производства соединений РЗЭ в России, странах Европы и США в связи с развитием производственных мощностей в Китае [4]. И лишь после 2011–2014 гг. в связи с восстановлением промышленности РЗЭ в этих странах возрастает потребность в исследованиях по экстракционному разделению РЗЭ из нитратных растворов, в том числе смесями экстрагентов [4, 5].
Обзор по химии синергетной экстракции РЗЭ смесями нитратов ЧАО и НФОС до 2004 г. представлен в работе [6, с. 149–156]. Основные исследования посвящены разработке химии синергетной экстракции элементов средней и тяжелой групп – Sm, Gd, Tb, Dy, Er. Для этих элементов выделяют, как правило, два вида смешанных экстрагируемых соединений: однозарядный нитратный комплекс, содержащий 2–4 молекулы ТБФ в своем составе за счет внедрения фосфорильного лиганда, и двухзарядный нитратный комплекс, содержащий 1–2 молекулы ТБФ, также входящих во внутреннюю координационную сферу фосфорильными лигандами (R4N)2[Ln(NO3)5 ⋅ (1–2)ТБФ].
Синергетной экстракции РЗЭ легкой группы – Ce(III), La, Pr и Nd – смесями нитратов ЧАО и НФОС посвящено меньшее количество работ. Химию экстракции этих элементов связывают с образованием преимущественно однозарядного нитратного комплекса R4N[Ln(NO3)4 ⋅ ТБФ], содержащего одну молекулу ТБФ, и в некоторых случаях двухзарядного комплекса (R4N)2[Ln(NO3)5 ⋅ ТБФ], также содержащего одну молекулу ТБФ. Различия в количестве молекул ТБФ, входящих в состав смешанных комплексов легких и среднетяжелых РЗЭ, обычно объясняют уменьшением ионного радиуса трехвалентных лантаноидов при переходе от Ce(III) к Lu(III) и соответствующим изменением координационного числа. В одной из последних работ изучена синергетная экстракция микроколичеств нитрата неодима смесями изомеров ТБФ с ТАМАН из нитратных растворов [7]. Установлено, что положение максимума синергетного эффекта на графике зависимости от состава изомолярных смесей соответствует мольному отношению НФОС : ТАМАН = 2 : 1 для ТБФ и (4–5) : 1 для три-изо-бутилфосфата (ТиБФ) и три-втор-бутилфосфата (ТвтБФ). Это позволило рассматривать экстракцию неодима как образование комплексов состава R4N[Ln(NO3)4 ⋅ 2ТБФ] и R4N[Ln(NO3)4 ⋅ (4–5)ТиБФ]. При насыщении органической фазы неодимом наблюдалось значительное снижение синергетного эффекта вплоть до его отсутствия, что указывало на распад синергетного комплекса.
Отнесение синергетных свойств смесей нитратов ЧАО и НФОС различного состава к экстракции только одного смешанного комплекса из перечисленных выше не позволяет адекватно описать экстракционное равновесие в широком интервале концентраций распределяемого компонента, экстрагентов и их соотношений. Это обусловлено, в первую очередь, изменением состава экстрагируемого комплекса для различных условий экстракции. Методом математического моделирования изотермы экстракции Nd(NO3)3 смесью 0.3 М ТАМАН–0.7 М ТБФ в толуоле показано, что в интервале концентраций Nd(NO3)3 от 0.05 до 2.5 М в водном растворе химию экстракции определяют три комплекса: один смешанный состава R4N[Nd(NO3)4 ⋅ (1–3)ТБФ], и два индивидуальных с каждым экстрагентом смеси: R4N[Nd(NO3)4] и Nd(NO3)4 ⋅ (1–3)ТБФ [8]. При этом адекватное описание изотермы достигается для смешанного комплекса, содержащего как одну, так две или три молекулы ТБФ. Эти данные свидетельствуют о переменном составе синергетного комплекса, зависящего от соотношения концентраций неодима, экстрагентов в смеси и их мольного соотношения.
Одним из информативных методов, позволяющих определить состав синергетных соединений при экстракции редких элементов смесями экстрагентов различного состава, является вариант метода изомолярных серий, введенный M. Taube и S. Siekierski для количественного изучения синергетной экстракции в двухфазных системах с двумя экстрагентами в работе [9]. Наличие синергетного эффекта авторы связывали с образованием синергетного соединения, включающего оба экстрагента, а его состав определяли по положению максимума на синергетной кривой на графике зависимости величины синергетного эффекта (фактора) (SLn) от состава изомолярной смеси. Наличие одного максимума свидетельствует об образовании одного синергетного соединения, нескольких максимумов – об образовании в экстракционной системе нескольких соединений.
Целью настоящей работы являлось определение методом изомолярных серий областей синергетной экстракции и состава экстрагируемых соединений празеодима и неодима из низкокислотных нитратных растворов с высаливателем NH4NO3 смесями ТОМАН–ТБФ с использованием статистической обработки экспериментальных данных для выявления всех статистически значимых смешанных экстрагируемых соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали Pr6O11, Nd2O3, NH4NO3, ТБФ квалификации “ч.”; NH4OH, HNO3, толуол квалификации “х. ч.”. В качестве нитрата четвертичного аммония был выбран ТОМАН, представляющий собой индивидуальное соединение в отличие от ТАМАН, являющимся смесью нитратов метилтри-н-алкиламмония с длиной алкильных заместителей от С7Н15 до С9Н19 в четвертичном аммониевом катионе. ТОМАН был получен по оригинальной методике из метилсульфата метилтри-н-октиламмония – продукта алкилирования три-н-октиламина диметилсульфатом с содержанием основного вещества CH3(C8H17)3NNO3 99.9% в пересчете на сухой безводный продукт.
Исходные 0.5 М водные растворы Pr(NO3)3 и Nd(NO3)3 готовили растворением точной навески Pr6O11 или Nd2O3 в расчетном количестве концентрированной HNO3, после чего в полученный раствор вносили расчетную навеску твердого NH4NO3 и после полного его растворения доводили рН приготовленного раствора до 2, что соответствовало концентрации HNO3 0.01 М, 1.0 М водным раствором аммиака.
1.0 М изомолярные растворы ТОМАН–ТБФ в толуоле готовили в мерных колбах на 50 или 100 мл. В колбу вносили расчетное количество 3.65 М ТБФ и расчетное количество 1.96 М ТОМАН, после чего смесь доводили толуолом до метки. Концентрацию ТОМАН в исходном экстрагенте устанавливали по содержанию групп R4N+ потенциометрическим титрованием йодидной формы четвертичной соли 0.1 М водным раствором AgNO3 в смеси 50 об. % пропанола и 50 об. % воды в присутствии йодид-селективного электрода фирмы “Radelkis” (Венгрия). Экстракцию празеодима и неодима проводили в стеклянных пробирках с притертыми крышками объемом 10–25 мл при температуре 20 ± 2°С и интенсивном перемешивании, соотношении объемов органической (О) и водной (В) фаз О : В = 1 : 1 (по 5–10 мл), времени контакта фаз 15 мин, времени расслаивания фаз 10–20 мин; после чего проводили отбор аликвоты водной фазы и анализировали на содержание металла комплексонометрическим титрованием в присутствии индикатора ксиленолового оранжевого [10].
Для верификации результатов, полученных при анализе водной фазы на содержание Pr или Nd в отдельных пробах, проводили их определение в равновесных органических фазах после “мокрого” сжигания аликвоты экстракта в смеси кислот HNO3 и HClO4 в колбе Кьельдаля при нагревании на газовой горелке. Пробу раствора после “мокрого” сжигания количественно переносили в коническую колбу из термостойкого стекла на 250 мл и анализировали комплексонометрическим методом.
Коэффициенты распределения DPr и DNd рассчитывали по формуле:
(1)
$D\; = \;{{c}_{{{\text{орг}}}}}{\text{/}}{{с}_{{{\text{водн}}}}}\; = \;({{c}_{{{\text{исх}}}}} - {{c}_{{{\text{водн}}}}}){\text{/}}{{c}_{{{\text{водн}}}}}\; = \;{{c}_{{{\text{исх}}}}}{\text{/}}{{c}_{{{\text{водн}}}}}\, - 1,$Синергетные эффекты (факторы) SPr и SNd рассчитывали по уравнению:
где Dэксп – экспериментально определенный коэффициент распределения Pr или Nd для раствора смеси экстрагентов; D1 и D2 – коэффициенты распределения Pr или Nd для индивидуального раствора каждого экстрагента при их концентрациях, равных в смешанном растворе. При S > 1 наблюдается синергетный эффект, а при S < 1 – антагонистический эффект ([4], с. 135–137; [9]).ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 1 представлена диаграмма метода изомолярных серий для экстракции Nd(NO3)3 из нитратного раствора 1.0 М изомолярными смесями ТОМАН–ТБФ, включающая зависимости DNd от концентрации ТОМАН, ТБФ, состава изомолярных смесей и синергетную кривую – зависимость синергетного фактора SNd от состава смесей ТОМАН–ТБФ. Зависимости DNd от концентрации ТОМАН и ТБФ носят традиционный возрастающий характер и имеют перегибы, отвечающие изменению состава экстрагируемого соединения. Зависимость DNd от состава смесей ТОМАН–ТБФ имеет, по крайней мере, три статистически значимых максимума для смесей 0.3 М ТОМАН–0.7 М ТБФ, 0.55 М ТОМАН–0.45 М ТБФ и 0.85 М ТОМАН–0.15 М ТБФ.
Рис. 1.
Зависимости DNd от концентрации ТБФ (кривая 1), ТОМАН (кривая 2), состава 1.0 М изомолярных смесей ТОМАН–ТБФ в толуоле (кривая 3) и синергетная кривая (кривая 4) при экстракции неодима из раствора, содержащего 0.429 М Nd(NO3)3, 4.0 M NH4NO3 и 0.01 M HNO3.
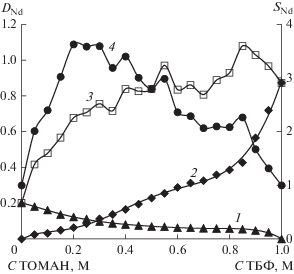
Средняя статистическая ошибка экспериментально определенных значений концентраций Nd в равновесных водных растворах по 6 точкам составила: 2.6% для кривой 1, 2.71% для кривой 2 и 3.67% для кривой 3. Рассчитанные средние значения статистической ошибки в определении величин DNd составили 6.5, 6.72 и 8.64% соответственно.
Синергетная кривая полностью лежит в области SNd > 1, что указывает на проявление синергетной экстракции во всей области изученных составов смесей. Выделяются 4 максимума в области от 0.2 М ТОМАН–0.8 М ТБФ до 0.85 М ТОМАН– 0.15 М ТБФ.
Для определения состава экстрагируемых синергетных комплексов были проведены расчеты мольных отношений Nd : ТОМАН : ТБФ по экспериментально определенным содержаниям неодима в органической фазе (табл. 1).
Таблица 1.
Мольные отношения Nd : ТБФ : ТОМАН в области синергетной экстракции из нитратных растворов, содержащих 0.429 М Nd(NO3)3, 4.0 M NH4NO3 и 0.01 M HNO3
| Компонент | Концентрация компонента, М | ||||||
|---|---|---|---|---|---|---|---|
| ТБФ | 1.0 | 0.95 | 0.90 | 0.85 | 0.80 | 0.75 | 0.70 |
| ТОМАН | 0 | 0.05 | 0.10 | 0.15 | 0.20 | 0.25 | 0.30 |
| Nd(NO3)3, орг.* | 0.109 | 0.135 | 0.144 | 0.162 | 0.183 | 0.186 | 0.195 |
| Мольные отношения | |||||||
| ТБФ : ТОМАН | – | 19 : 1 | 9 : 1 | 5.7 : 1 | 4 : 1 | 3 : 1 | 2.3 : 1 |
| ТБФ : Nd(NO3)3 | 9.17 | 7.0 | 6.25 | 5.25 | 4.37 | 4.03 | 3.59 |
| ТОМАН : Nd(NO3)3 | – | 0.37 | 0.69 | 0.93 | 1.09 | 1.34 | 1.54 |
| Компонент | Концентрация компонента, М | ||||||
| ТБФ | 0.65 | 0.60 | 0.55 | 0.50 | 0.45 | 0.40 | 0.35 |
| ТОМАН | 0.35 | 0.40 | 0.45 | 0.50 | 0.55 | 0.60 | 0.65 |
| Nd(NO3)3, орг. | 0.187 | 0.205 | 0.201 | 0.205 | 0.219 | 0.204 | 0.208 |
| Мольные отношения | |||||||
| ТБФ : ТОМАН | 1.9 : 1 | 3 : 2 | 1.2 : 1 | 1 : 1 | 1 : 1.2 | 2 : 3 | 1 : 1.9 |
| ТБФ : Nd(NO3)3 | 3.48 | 2.92 | 2.74 | 2.44 | 2.05 | 1.96 | 1.68 |
| ТОМАН : Nd(NO3)3 | 1.87 | 1.95 | 2.24 | 2.44 | 2.51 | 2.94 | 3.13 |
| Компонент | Концентрация компонента, М | ||||||
| ТБФ | 0.30 | 0.25 | 0.20 | 0.15 | 0.10 | 0.05 | 0 |
| ТОМАН | 0.70 | 0.75 | 0.80 | 0.85 | 0.90 | 0.95 | 1.0 |
| Nd(NO3)3, орг. | 0.199 | 0.209 | 0.216 | 0.234 | 0.226 | 0.224 | 0.229 |
| Мольные отношения | |||||||
| ТБФ : ТОМАН | 1 : 2.3 | 1 : 3 | 1 : 4 | 1 : 5.7 | 1 : 9 | 1 : 19 | – |
| ТБФ : Nd(NO3)3 | 1.51 | 1.20 | 0.93 | 0.64 | 0.44 | 0.22 | – |
| ТОМАН : Nd(NO3)3 | 3.52 | 3.59 | 3.70 | 3.63 | 3.98 | 4.24 | 4.37 |
1.0 М раствор ТБФ слабо экстрагирует Nd из нитратного раствора с низкой кислотностью. Небольшие добавки ТОМАН резко увеличивают распределение Nd в органическую фазу. В предположении образования смешанных комплексов Nd с ТОМАН и ТБФ область изменения концентрации ТОМАН от 0.05 до 0.2 М в смеси с ТБФ сопровождается экстракцией смешанного комплекса состава R4N[Nd(NO3)4 ⋅ 4ТБФ], полному образованию которого в органической фазе отвечает состав 0.2 М ТОМАН–0.8 М ТБФ. Дальнейшее повышение доли ТОМАН в синергетной смеси приводит к образованию двухзарядного смешанного комплекса, включающего 3 молекулы ТБФ. Полное образование комплекса (R4N)2[Nd(NO3)5 ⋅ 3ТБФ] относится к составу 0.4 М ТОМАН–0.6 М ТБФ. Дальнейшее повышение концентрации ТОМАН приводит к переходу двухзарядного комплекса в трехзарядный, содержащий 2 молекулы ТБФ в своем составе (R4N)3[Nd(NO3)6 ⋅ 2ТБФ]. Образование этого комплекса определяет химию экстракции составами от 0.55 М ТОМАН–0.45 М ТБФ до 0.65 М ТОМАН–0.35 М ТБФ. С дальнейшим ростом концентрации ТОМАН в смеси наблюдается образование четырехзарядного комплекса состава (R4N)4[Nd(NO3)7 ⋅ ТБФ], содержащего одну молекулу ТБФ. В то же время этот комплекс может быть рассмотрен как трехзарядный смешанный комплекс, дополнительно сольватированный избыточными молекулами экстрагента, как ТОМАН, так и ТБФ. В этом случае ему можно приписать следующую формулу: (R4N)3[Nd(NO3)6 ⋅ ТБФ] ⋅ R4NNO3. При высоких содержаниях ТОМАН образование и экстракция четырехзарядного нитратного комплекса сопровождается вытеснением ТБФ из его координационной сферы. Проявление синергетного эффекта для этих составов смесей может быть обусловлено сольватацией трехзарядного комплекса состава (R4N)3[Nd(NO3)6] свободными молекулами ТОМАН и ТБФ с образованием сольвата следующего состава: (R4N)3[Nd(NO3)6] ⋅ R4NNO3 ⋅ ⋅ mТБФ, так и сольватацией молекулами ТБФ четырехзарядного нитратного комплекса с образованием сольвата состава (R4N)4[Nd(NO3)7] ⋅ mТБФ.
Как следует из полученных данных, основным мотивом изменения состава экстрагируемого смешанного комплекса является вытеснение фосфорильных лигандов из координационной сферы нитратными лигандами при увеличении доли ТОМАН в смеси с образованием более высокозарядных нитратных комплексов в органической фазе.
Анализ литературных данных [11] по составу образующихся в водных нитратных растворах анионных комплексов РЗЭ в присутствии значительного избытка солей с одноименным анионом показал, что основным комплексом является однозарядный комплекс Me[Nd(NO3)4], при высоких концентрациях нитратных солей – двухзарядный комплекс Me[Nd(NO3)5], где Ме – щелочной металл или аммоний, а трехзарядный образуется в исчезающе малых количествах. Это обусловлено, прежде всего, высокой концентрацией воды в водных растворах, более 55 М, которая занимает координационную сферу Nd(III), вытесняя нитратные лиганды, избыточная концентрация которых в водной фазе не превышает 2–2.5 М.
При переходе к органической фазе, концентрация воды в которой не превышает 1–1.5 М, а содержание нитратных лигандов в 3–4 раза выше, образование высокозарядных анионных комплексов становится более вероятным за счет заполнения координационной сферы нитратными лигандами.
Метод изомолярных серий был использован также для определения составов экстрагируемых соединений празеодима из нитратных растворов смесями ТОМАН–ТБФ (рис. 2). Средняя статистическая ошибка определения равновесной концентрации Pr в водной фазе по 6 точкам составила 3.87% для кривой 1, 3.46% для кривой 2 и 3.64% для кривой 3. Рассчитанные средние значения статистической ошибки в определении величин DPr составили 8.25, 7.43 и 7.8% соответственно. Зависимости DPr от концентрации ТОМАН, ТБФ и состава смесей ТОМАН–ТБФ носят одинаковый характер с такими же зависимостями для неодима. Синергетная кривая для празеодима характеризуется наличием синергетного эффекта в области изменения концентрации ТОМАН в смесях от 0.2 до 0.65 М.
Рис. 2.
Зависимости DPr от концентрации ТБФ (кривая 1), ТОМАН (кривая 2), состава 1.0 М изомолярных смесей ТОМАН–ТБФ в толуоле (кривая 3) и синергетная кривая (кривая 4) при экстракции празеодима из раствора, содержащего 0.487 М Pr(NO3)3, 4.0 M NH4NO3 и 0.01 M HNO3.
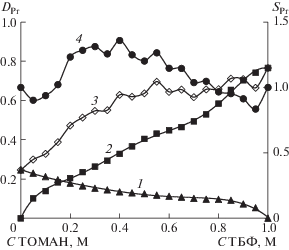
В смежных областях концентраций ТОМАН от 0.05 до 0.20 М и от 0.65 до 1.0 М наблюдается антагонистический эффект. В табл. 2 представлены мольные отношения Pr : ТБФ : ТОМАН для областей синергетной экстракции. Экстракция Pr(III) смесями ТОМАН–ТБФ также сопровождается образованием смешанных комплексов, состав которых изменяется от R4N[Pr(NO3)3 ⋅ (4–5)ТБФ] до (R4N)3[Pr(NO3)6 ⋅ 2ТБФ].
Таблица 2.
Мольные отношения Pr : ТБФ : ТОМАН в области синергетной экстракции из нитратных растворов, содержащих 0.487 М Pr(NO3)3, 4.0 M NH4NO3 и 0.01 M HNO3
| Компонент | Концентрация компонента, М | ||||
|---|---|---|---|---|---|
| ТБФ | 0.80 | 0.75 | 0.70 | 0.65 | 0.60 |
| ТОМАН | 0.20 | 0.25 | 0.30 | 0.35 | 0.40 |
| Pr(NO3)3, орг.* | 0.156 | 0.165 | 0.172 | 0.173 | 0.188 |
| Мольные отношения | |||||
| ТБФ : ТОМАН | 4 : 1 | 3 : 1 | 2.3 : 1 | 1.9 : 1 | 3 : 2 |
| ТБФ : Pr(NO3)3 | 5.13 | 4.55 | 4.07 | 3.76 | 3.19 |
| ТОМАН : Pr(NO3)3 | 1.28 | 1.52 | 1.74 | 2.02 | 2.13 |
| Компонент | Концентрация компонента, М | ||||
| ТБФ | 0.55 | 0.50 | 0.45 | 0.40 | 0.35 |
| ТОМАН | 0.45 | 0.50 | 0.55 | 0.60 | 0.65 |
| Pr(NO3)3, орг. | 0.187 | 0.190 | 0.200 | 0.191 | 0.192 |
| Мольные отношения | |||||
| ТБФ : ТОМАН | 1.2 : 1 | 1 : 1 | 1 : 1.2 | 2 : 3 | 1 : 1.9 |
| ТБФ : Pr(NO3)3 | 2.94 | 2.63 | 2.25 | 2.09 | 1.82 |
| ТОМАН : Pr(NO3)3 | 2.41 | 2.63 | 2.75 | 3.14 | 3.39 |
Изменение состава обусловлено замещением фосфорильных лигандов нитратными с увеличением доли ТОМАН в смеси. Необходимо отметить, что согласно данным табл. 1 и 2 число молекул ТБФ, входящих в состав смешанных комплексов празеодима, больше, чем для неодима. В то же время экстракция празеодима смесями ТОМАН–ТБФ характеризуется двумя областями антагонистического эффекта при избытке в смеси как ТБФ, так и ТОМАН. Причиной проявления антисинергетной экстракции может являться взаимное подавление экстракции празеодима индивидуальными экстрагентами при их значительном избытке. Однако окончательной природы антагонизма в этих системах пока не установлено. Различия в проявлении синергетного и антисинергетного эффектов при экстракции Nd и Pr из нитратных растворов смесями ТОМАН–ТБФ могут быть использованы для разделения этой пары редкоземельных элементов.
ЗАКЛЮЧЕНИЕ
Сочетание метода изомолярных серий с определением мольных отношений Ln : ТОМАН : ТБФ для синергетных участков зависимости SLn от состава смесей позволило определить химию синергетной экстракции празеодима и неодима из низкокислотных нитратных растворов с высаливателем смесями ТОМАН–ТБФ в толуоле как непрерывную последовательность образования смешанных комплексов состава (R4N)n[Ln(NO3)(3 + n) · mТБФ], где n = 1–4, m = 2–5 для празеодима, и n = 1–4, m = 1–3 для неодима, обусловленную ступенчатым замещением нитратными лигандами ТОМАН фосфорильных лигандов ТБФ во внутренней координационной сфере лантаноида с ростом содержания четвертичной соли в смеси вплоть до их полного вытеснения. Этот процесс сопровождается повышением зарядности образующихся анионных нитратных комплексов празеодима и неодима и понижением сольватного числа ТБФ. При значительном избытке ТБФ или ТОМАН в смеси при экстракции празеодима наблюдается антагонистический эффект, обусловленный процессами ассоциации и сольватации экстрагентов в органической фазе.
Список литературы
Вальков А.В., Сергиевский В.В. Смеси фосфорорганических экстрагентов с нитратом метилтриалкиламмония в технологии самария, гадолиния, тербия и эрбия / Тезисы и доклады 1-й Всероссийской научно-практической конференции “Перспективы добычи, производства и применения РЗМ”; 26–27 сентября 2011 г. М.: ВНИИХТ, 2011. С. 1–7.
Степанов С.И., Чекмарев А.М. Разделение редкоземельных элементов: учеб. пособие / М.: РХТУ им. Д.И. Менделеева, 2016. 136 с.
Косынкин В.Д., Сарычев Г.А., Селивановский А.К., Трубаков Ю.М., Федулова Г.Т. Технология получения индивидуальных редкоземельных элементов (РЗЭ) из суммарного концентрата, выделенного из монацита, основанная на отечественных экстрагентах / V Международная конференция-школа по химической технологии ХТ'16: сб. тезисов докладов сателлитной конференции ХХ Менделеевского съезда по общей и прикладной химии. 16–20 мая 2016 г.: в 3 т. Волгоград: ВолгГТУ 2016. Т. 1. С. 124–126. Доступно по: http://www.vstu.ru/upload/conf/2016/sbornik_tom_1.pdf Ссылка активна на 10 января 2021.
Косынкин В.Д., Трубаков Ю.М., Сарычев Г.А. О мировом и российском редкоземельном производстве. ВНИИХТ-65 лет: Сборник научных трудов. М.: ООО “Винпресс”, 2016. С. 38–55.
Поляков Е.Г., Нечаев А.В., Смирнов А.В. Металлургия редкоземельных металлов. М.: Металлургиздат, 2018.
Степанов С.И., Чекмарев А.М. Экстракция редких металлов солями четвертичных аммониевых оснований. М.: ИздАТ, 2004.
Вальков А.В., Хмелевская Н.Д. Экстракция редкоземельных элементов смесями изомеров трибутилфосфата с нитратом триалкилметиламмония // Известия высших учебных заведений. Химия и химическая технология. 2018. Т. 61. № 7. С. 55–61. https://doi.org/10.6060/ivkkt.20186107.5676
Славинский К.А., Степанов С.И. Математическое моделирование изотерм синергетной экстракции урана, тория и РЗЭ из нитратных растворов / Тезисы докладов Третьей Российской школы по радиохимии и ядерным технологиям 8–12 сентября 2008, г. Озерск, 2008. С. 89–94.
Taube M., Siekierski S. General remarks on synergic effects in the extraction of Uranium and Plutonium compounds // Nucleonica. 1961. V. 6. P. 489–501.
Бусев А.И., Типцова В.Г., Иванов В.М. Руководство по аналитической химии редких элементов. М.: Химия, 1978.
Комиссарова Л.Н., Шацкий В.М., Пушкина Г.Я., Щербакова Л.Г., Мамсурова Л.Г., Суханова Г.Е. Соединения редкоземельных элементов. Карбонаты, оксалаты, нитраты, титанаты. М.: Наука, 1984.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах


