Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 498, № 1, стр. 30-33
Синтез и изучение свойств фосфинового псевдопролилглицилпролина
К. В. Шевченко 1, *, М. Э. Дмитриев 2, А. В. Винюков 2, В. П. Шевченко 1, И. П. Калашникова 2, И. Ю. Нагаев 1, В. В. Рагулин 2, академик РАН Н. Ф. Мясоедов 1
1 Институт молекулярной генетики Национального исследовательского центра “Курчатовский институт” (НИЦ “Курчатовский институт” – ИМГ)
123182 Москва, Россия
2 Институт физиологически активных соединений Российской академии наук (ИФАВ РАН)
142432 Черноголовка, Московская область, Россия
* E-mail: ATCarma@mail.ru
Поступила в редакцию 07.11.2020
После доработки 24.12.2020
Принята к публикации 31.12.2020
Аннотация
Проведен синтез рацемического фосфинового трипептида 1 пирролидин-2-ил-{3-[(2-гидроксикарбонил)-пирролидин-1-ил]-3-оксо-пропил}-фосфиновой кислоты, показана его высокая устойчивость к действию лейцинаминопептидазы, карбоксипептидазы Y и ферментной системы мембран мозга крыс. В экспериментах in vitro с использованием синтетического пептида Семакс было обнаружено, что в случае лейцинаминопептидазы и карбоксипептидазы Y влияние полученного трипептида 1 на скорость гидролиза Семакса минимально. В экспериментах с использованием ферментной системы мембран мозга крыс уменьшение скорости гидролиза Семакса было более очевидным.
Известно, что основным механизмом контроля в биологических системах является ингибирование ферментативной активности. Многие лекарства и токсические агенты действуют путем ингибирования ферментов. Ингибирование также может быть источником понимания механизма действия фермента. Фосфиновые псевдопептиды представляют собой очень удобные модели для изучения ингибирования различных ферментов, в основном металлопротеиназ [1–4]. Замена природного остатка [C(O)NH] негидролизуемым метиленфосфорильным фрагментом [P(O)(OH)CH2] позволяет влиять на эффективность пептидного гидролиза [3, 4]. Одним из перспективных объектов структурной модификации является семейство коротких пролинсодержащих пептидов – глипролинов, фрагментов коллагена, состоящих из аминокислот пролина и глицина (ProGly, GlyPro, ProGlyPro), проявляющих фибринолитические, антитромботические свойства, а также обладающих противоязвенной активностью [5–7].
Цель работы – синтез и оценка стабильности фосфинового псевдопролилглицилпролина 1, а также влияния этого соединения на активность протеаз. В качестве репера использовался Семакс (синтетический пептид Met-Glu-His-Phe-Pro-Gly-Pro).
Существует несколько подходов к синтезу фосфиновых пролинсодержащих псевдо-дипептидов. Например, построение аминофосфорильной функции в молекуле фосфиновых псевдо-дипептидов возможно взаимодействием гидрофосфорильного соединения со второй компонентой синтеза, совмещающей амино- и карбонильную функции в одной молекуле алкилиденбискарбамата [8, 9] или ω‑амидоальдегида [10]. Раннее был разработан синтез N-бензилоксикарбонил-пирролидин-2-ил-2’-(этилоксикарбонил)этилфосфиновой кислоты 2 с использованием 4-(бензилоксикарбонил)бутиральдегида 3 взаимодействием со структурным изостером 2-(этилоксикарбонил)этилфосфонистой кислотой 4 в растворе уксусного альдегида [10].
В данной работе предложен более эффективный синтез соединения 2 (схема 1), который предполагает на первом этапе использование альдегидной компоненты и защищенных аминоалкилфосфонистых кислот [11].
Схема 1.
Синтез адамантилового эфира N-бензилоксикарбонил-пирролидин-2-ил-2'-(гидроксикарбонил)этилфосфиновой кислоты 6 (предшественника фосфинового трипептида 1).
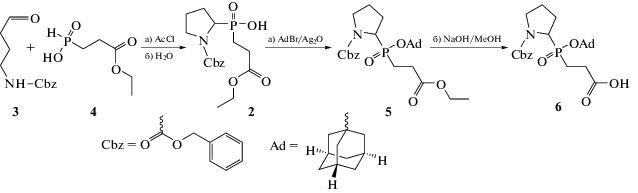
К раствору 1.2 экв. соединения 4 в хлористом ацетиле при температуре 0–5°С по каплям добавляли раствор 1 экв. соединения 3 в сухом толуоле. Образовавшуюся смесь продолжали перемешивать при 0–5°С в течение 2 ч, затем при комнатной температуре в течение ∼5 ч. За ходом реакции наблюдали с помощью 31Р ЯМР-спектроскопии. Затем реакционную смесь упаривали. Остаток обрабатывали водой со льдом и экстрагировали хлороформом. Органический экстракт промывали водой, сушили над сульфатом магния и удаляли растворитель. Маслообразный остаток, согласно спектральным данным [11], представлял собой соединение 2, которое использовали в дальнейших превращениях без дополнительной очистки. Выход соединения 2 достигал 83%.
Синтез адамантилового эфира N-бензилоксикарбонил-пирролидин-2-ил-2'-(этилоксикарбонил)этилфосфиновой кислоты 5 проводили по методу [12]. Затем снимали защитную группу с карбоксила с целью получения адамантилового эфира N-бензилоксикарбонил-пирролидин-2-ил-2'-(гидроксикарбонил)этилфосфиновой кислоты 6 [10–12]. Дальнейший синтез псевдо-трипептида 1 проводили по схеме 2 [13].
К раствору 1 экв. соединения 6 в хлороформе при перемешивании при комнатной температуре вводили 2 экв. дициклогексилкарбодиимида [13]. Через 15 мин прибавляли раствор 2 экв. солянокислого Pro-OBzl в хлороформе с триэтилами- ном (Et3N). Перемешивание продолжали еще 14 ч. Выпавшую мочевину отфильтровывали. Хлороформ удаляли упариванием, остаток лиофилизировали. Очистку адамантилового эфира N-бензилоксикарбонил-пирролидин-2-ил-{3-[(2-бензилоксикарбонил)-пирролидин-1-ил]-3-оксо-пропил}-фосфиновой кислоты 7 проводили на колонке Reprosil pur C18aq (20 ×150 мм, размер частиц 10 мкм) (Германия), в системе A (30% MeOH + 0.1% AcOH), B (MeOH). Скорость подачи элюента 20 мл мин–1. Время удерживания соединения 7 составило 3.60 мин. Выход препарата – 50% ([M + H] = 663, [M + Na] = 685).
Бензилоксикарбонильную и бензиловую защиты снимали каталитическим гидрированием этанольного раствора соединения 7 в присутствии 5% PdO/BaSO4 в течение 3 ч [13]. Анализ проводили на хроматографе Милихром-А02 с использованием колонки ProntoSIL-120-5-C18 AQ DB-2003 (2 × 75 мм, размер частиц 5 мкм) (Германия) в градиенте 0.1% CH3COOH–метанол за 12.5 мин при температуре 35 C. Скорость подачи элюента 0.2 мл мин–1. До гидрирования время удерживания соединения 7–2.50 мин (линейный градиент B от 80 до 100%). После гидрирования время удерживания адамантилового эфира пирролидин-2-ил-{3-[(2-гидроксикарбонил)-пирролидин-1-ил]-3-оксо-пропил}-фосфиновой кислоты 8 – 4.58 мин (линейный градиент B от 30 до 100%). Хроматографический анализ и масс-спектр соединения 8 показали отсутствие исходного соединения. После снятия бензилоксикарбонильной и бензиловой защит по данным масс-спектрометрии в масс-спектре соединения 8 обнаружены пики с массой 439 ([M + H]) и 461 ([M + Na]).
Последнюю стадию синтеза (снятие Ad-защиты с соединения 8) проводили без его предварительной хроматографической очистки обработкой СF3СООН в течение 30 мин. Анализ проводили на хроматографе Милихром-А02 (Россия), как описано выше (линейный градиент B от 0 до 100% за 12.5 мин, подача элюента 0.2 мл мин–1, время удерживания 4.06 мин). Выход соединения 1 при снятии защитных групп составил 64%. Масс-спектр соединения после снятия Ad-защиты содержал один пик, соответствующий массе 304.87 ([M + H]).
Устойчивость рацемического фосфинового трипептида 1 оценивали в присутствии амино- и карбоксипротеиназ. В качестве репера при исследовании влияния этого соединения на функционирование данных ферментов использовали Семакс. В экспериментах использовали лейцинаминопептидазу (К.Ф. 3.4.11.2, Тип VI, микросомальная из почки свиньи, 9.2 ед. акт. мг–1, Sigma-Aldrich, США), карбоксипептидазу Y (К.Ф. 3.4.16.1, из хлебопекарных дрожжей, 17 ед. акт. мг–1, Sigma-Aldrich, США) и микросомальную фракцию мембран мозга крысы (МФМК). Работы in vitro проводили по методикам [14, 15].
Ферментативный гидролиз Семакса и трипептида 1 проводили по следующей методике. К раствору 0.185 мкмоль пептида в 280 мкл фосфатно-солевого буфера (27.4 мМ NaCl, 0.4 мМ KCl, 2 мМ Na3PO4 в 100 мл H2O, рН 7.4) добавляли 0.0184 ед. акт. лейцинаминопептидазы (10 мкмоль ед. акт.–1) или 2 ед. акт. карбоксипептидазы Y (0.092 мкмоль ед. акт.–1) или 120 мкл МФМК в этом же буфере. Инкубационную смесь перемешивали и термостатировали при 30°С, отбирая аликвоты по 20 мкл через определенные промежутки времени. Остановка ферментативного гидролиза осуществлялась добавлением к отбираемым пробам равного объема метанола. Анализ смеси проводили методом ВЭЖХ. При работе с МФМК перед анализом пробы очищали твердофазной экстракцией на обращенной фазе, суть которой заключалась в нанесении пептидной фракции на патрон, упакованный обращенной фазой Lichroprep RP-18 (Merck, Германия), с последующим элюированием пептидов метанолом с 0.1% ТФУ. Далее смесь упаривали и растворяли в 200 мкл смеси метанол : вода = 5 : 95.
Установлено, что трипептид 1 при использовании лейцинаминопептидазы, карбоксипептидазы Y и МФМК устойчив к действию этих ферментных систем. Реакции вели в течение 3 сут. Показано, что даже увеличение концентрации лейцинаминопептидазы в 10 раз или МФМК в 5 раз не сказывалось на изменении содержания трипептида 1 в инкубационной смеси. При проведении экспериментов с участием Семакса установлено, что при использовании лейцинаминопептидазы и карбоксипептидазы Y влияние трипептида 1 на скорость гидролиза Семакса минимально. На определенное влияние трипептида 1 на протеолиз Семакса указывает сохранение небольшого количества Семакса в реакционной смеси при инкубации в течение 3 сут в случае лейцинаминопептидазы на 2.1%, в случае карбоксипептидазы – на 3.2%.
При использовании МФМК изменение скорости гидролиза Cемакса в присутствии рацемического трипептида 1 более очевидно (рис. 1). При увеличении концентрации трипептида 1 протеолиз Cемакса еще больше замедлялся.
Рис. 1.
Протеолиз под действием МФМК Cемакса ($\blacksquare $) и смеси Cемакса и фосфинового трипептида 1 при мольном соотношении 1:1 ($\blacktriangle $) и 1:5 ($ \bullet $).

Этот эффект, по-видимому, связан с тем, что в МФМК присутствуют металлозависимые протеиназы [16]. Ингибирование их фосфиновым псевдопролилглицилпролином приводило к частичному замедлению деградации Cемакса.
Таким образом, есть основание считать, что синтезированный фосфиновый трипептид 1 может влиять на деградацию пептидов за счет ингибирования металлопротеиназ и, следовательно, имеет перспективы для контролирования ферментативной активности в живых организмах.
Список литературы
Collinsova M., Jiracek J. // Current Med. Chem. 2000. V. 7. № 6. P. 629. https://doi.org/10.2174/0929867003374831
Dive V., Georgiadis D., Matziari M., Makaritis A., Beau F., Cuniasse P., Yiotakis A. // Cell. Mol. Life Sci. 2004. V. 61. № 16. P. 2010. https://doi.org/10.1007/s00018-004-4050-y
Mucha A. // Molecules. 2012. V. 17. № 11. P. 13530. https://doi.org/10.3390/molecules171113530
Georgiadis D., Dive V. // Top Curr. Chem. 2015. V. 360. P. 1. https://doi.org/10.1007/128_2014_571
Ashmarin I.P., Samonina G.E., Lyapina L.A., Kamenskii A.A., Levitskaya N.G., Grivennikov I.A., Dolotov O.V., Andreeva L.A., Myasoedov N.F. // Pathophysiology. 2005. V. 11. № 4. P. 179. https://doi.org/10.1016/j.pathophys.2004.10.001
Медведева Е.В., Дмитриева В.Г., Поварова О.В., Лимборская С.А., Скворцова В.И., Мясоедов Н.Ф., Дергунова Л.В. // Молекулярная биология. 2014. Т. 48. № 2. С. 277. https://doi.org/10.7868/S0026898414020128
Ашмарин И.П., Алфеева Л.Ю., Андреева Л.А., Бакаева З.В., Климова П.А., Мясоедов Н.Ф., Павлов Т.С., Самонина Г.Е. // Патент РФ № 2252779 (27.05.2005) Б. И. 2005. № 15. https://fips.ru/registers-doc-view/fips_servlet?DB=RUPAT&rn=6672&DocNumber=2252779&TypeFile=html. Ссылка активна на 12 января 2021.
Dmitriev M.E., Ragulin V.V. // Tetrahedron Lett. 2010. V. 51. № 19. P. 2613. https://doi.org/10.1016/j.tetlet.2010.03.020
Dmitriev M.E., Ragulin V.V. // Tetrahedron Lett. 2012. V. 53. № 13. P. 1634. https://doi.org/10.1016/j.tetlet.2012.01.094
Винюков А.В., Дмитриев М.Э., Афанасьев А.В., Рагулин В.В., Андреева Л.А., Мясоедов Н.Ф. // ЖОХ. 2017. Т. 87. № 2. С. 291.
Винюков А.В. Одинарное, двойное и циклическое амидоалкилирование гидрофосфорильных соединений / Диссертация на соискание ученой степени кандидата химических наук. ИФАВ РАН. Черноголовка. 2017. 95 с. https://www.dissercat.com/content/odinarnoe-dvoinoe-i-tsiklicheskoe-amidoalkilirovanie-gidrofosforilnykh-soedinenii. Ссылка активна на 12 января 2021.
Georgiadis D., Dive V., Yiotakis A. // J. Org. Chem. 2001. V. 66. № 20. P. 6604. https://doi.org/10.1021/jo0156363
Гершкович А.А., Кибирев В.К. Химический синтез пептидов. Киев: Наукова Думка, 1992.
Шевченко К.В., Вьюнова Т.В., Нагаев И.Ю., Андреева Л.А., Мясоедов Н.Ф. // Биоорган. химия. 2013. Т. 39. № 3. Р. 320. https://doi.org/10.7868/S0132342313030159
Шевченко К.В., Вьюнова Т.В., Андреева Л.А., Нагаев И.Ю., Шевченко В.П., Мясоедов Н.Ф. // Хим.-фарм. журнал. 2015. Т. 49. № 2. С. 12.
Антонов В.К. Химия протеолиза. М.: Наука, 1991. 504 с.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах



