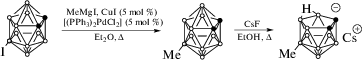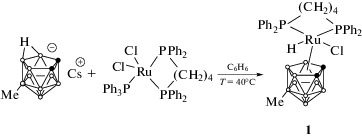Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 498, № 1, стр. 34-41
Комплексы рутения на основе 5-MeC2B9-карборанового лиганда: синтез и применение в катализе полимеризационных процессов
А. М. Зимина 1, С. А. Ануфриев 2, М. А. Дерендяева 1, Н. А. Князева 1, Н. В. Сомов 1, Ю. Б. Малышева 1, И. Б. Сиваев 2, И. Д. Гришин 1, *
1 Национальный исследовательский
Нижегородский государственный университет
им. Н.И. Лобачевского
603950 Нижний Новгород, Россия
2 Институт элементоорганических соединений
им. А.Н. Несмеянова Российской академии наук
119991 Москва, Россия
* E-mail: grishin_i@ichem.unn.ru
Поступила в редакцию 05.02.2021
После доработки 09.03.2021
Принята к публикации 16.03.2021
Аннотация
На основе нидо-карборанового лиганда [5-Me-7,8-C2B9H11]–, содержащего метильный заместитель в нижнем поясе корзины, синтезирован новый комплекс
рутения 3,3-(Ph2P(CH2)4PPh2)-3-H-3-Cl-9-Me-клозо-3,1,2-RuC2B9H10 (1) и его производные 3,3-(Ph2P(CH2)4PPh2)-3-Cl-9-Me-клозо-3,1,2-RuC2B9H10 (2), 3,3,8-(Ph2P(CH2)4PPh-μ- (3) и 3,3,4,8-(Ph2P(CH2)4P-μ-
(3) и 3,3,4,8-(Ph2P(CH2)4P-μ-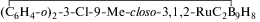 (4). Полученные замещенные рутенакарбораны, сохраняя характерную для незамещенных аналогов
геометрию и стерическую конфигурацию атома металла, характеризуются меньшими значениями
потенциалов перехода Ru(II)–Ru(III). Показана высокая эффективность применения полученных
производных в качестве катализаторов контролируемой радикальной полимеризации метилметакрилата.
(4). Полученные замещенные рутенакарбораны, сохраняя характерную для незамещенных аналогов
геометрию и стерическую конфигурацию атома металла, характеризуются меньшими значениями
потенциалов перехода Ru(II)–Ru(III). Показана высокая эффективность применения полученных
производных в качестве катализаторов контролируемой радикальной полимеризации метилметакрилата.
Открытие методов контролируемой радикальной полимеризации (КРП) на рубеже XX–XXI веков позволило существенно расширить спектр полимерных материалов, применяемых в высокотехнологичных отраслях промышленности и обеспечить активное развитие последних. В настоящее время полимеры, получаемые в контролируемом режиме, активно применяются в качестве дисперсантов, адгезивов, присадок к техническим жидкостям, агентов доставки лекарственных препаратов и других важных областях [1–4]. Среди трех основных методов КРП наиболее широко исследованным и востребованным в плане практического применения является контролируемая радикальная полимеризация с переносом атома, известная в зарубежной литературе как Atom Transfer Radical Polymerization (ATRP) [5–7]. В основе данного метода лежит процесс переноса атома галогена (Hal) между полимерной цепью (∼Pn) и комплексом переходного металла (MnLx), выступающего в качестве катализатора (схема 1).
Схема 1.
Общая схема полимеризации по механизму ATRP. M – атом переходного металла в степени окисления n, L – лиганды.

Результаты многочисленных исследований, проведенных в области ATRP, позволяют сделать вывод о том, что наличие лигандов с высокой донирующей способностью в структуре комплекса переходного металла позволяет увеличить активность катализатора, снизить его концентрацию при сохранении должной степени контроля над молекулярно-массовым распределением [8, 9]. Среди предложенных к настоящему времени катализаторов процесса ATRP следует выделить карборановые комплексы рутения, характеризующиеся высокой эффективностью и стабильностью в условиях полимеризации [10–12]. Уникальное электронное строение борных кластеров, обусловленное образованием неклассических многоцентровых связей, делает их крайне востребованными в катализе широкого спектра процессов, в биомедицинской и других высокотехнологичных областях [13–15]. В рамках данной работы предложен новый подход к повышению каталитической активности металлакарборанов за счет введения заместителей в нижний пояс карборанового лиганда.
Цезиевую соль 5-метил-нидо-карборана получали на основе 9-иод-орто-карборана в две стадии [16] (схема 2).
Сначала согласно методике [17] реакцией кросс-сочетания 9-I-орто-C2B10H11 c MeMgI в присутствии [(Ph3P)2PdCl2] и CuI был получен 9-метил-орто-карборан 9-Me-орто-C2B10H11. Его спектр 1H ЯМР в CDCl3 содержит два уширенных сигнала CH-групп карборанового остова при 3.49 и 3.38 м. д. и сигнал метильного заместителя при 0.24 м. д., а спектр 11B ЯМР содержит сигналы при 7.5 (c, 1B), –1.5 (д, 1B), –8.3 (д, 2B), –13.3 (д, 2B), –14.3 (д, 2B) и –15.5 (д, 2B) м. д.
Затем кипячением 9-метил-орто-карборана с CsF в этаноле получена цезиевая соль карборанового лиганда Cs[5-Me-7,8-C2B9H11], спектр 1H ЯМР которого в ацетоне-d6 содержит два уширенных сигнала CH-групп карборанового остова при 1.71 и 1.45 м. д., уширенный сигнал метильного заместителя при –0.05 м. д. и характерный сигнал BHB-мостика при –2.79 м. д., а спектр 11B ЯМР – сигналы 9 неэквивалентных атомов бора при –4.8 (c), –8.6 (д), –12.4 (д), –18.0 (д), –18.6 (д), –20.8 (д), –22.8 (д), –30.9 (дд) и –36.1 (д) м. д., что хорошо согласуется с литературными данными [18]. Синтез металлакарборанов проводили в атмосфере аргона по методикам [10–12], аналогичным для синтеза их незамещенных аналогов.
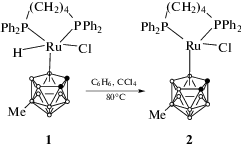
Традиционный метод получения рутенакарборанов клозо-строения включает стадию образования экзо-нидо-комплекса, в котором атом металла связан с карборановой корзиной посредством трех агостических связей [10, 12]. Наличие метильного заместителя в положении 5 борного остова делает образование подобных комплексов невозможным, вследствие чего целевой клозо-комплекс 3,3-(Ph2P(CH2)4PPh2)-3-H-3-Cl-9-Me-клозо-3,1,2-RuC2B9H10 (1) образуется в одну стадию при взаимодействии соли нидо-карборана с фосфиновым комплексом рутения [RuCl2(PPh3)(dppb)] (схема 3).
Примечательно, что образование соединения 1 протекает с более высокой скоростью, чем синтез аналогичного незамещенного рутенакарборана, что, по-видимому, связано с невозможностью образования в качестве промежуточного соединения комплекса экзо-нидо-строения, перегруппировка которого в клозо-продукт является лимитирующей стадией.
Строение соединения 1 было предположено на основании данных спектроскопии ЯМР и элементного анализа и впоследствии подтверждено рентгеноструктурным анализом. Спектр 31Р ЯМР комплекса 1 в CD2Cl2 содержит два триплета от двух неэквивалентных атомов фосфора при 38.0 и 36.3 м. д. Спектр 1H ЯМР имеет характерный для металлакарборанов клозо-строения вид и содержит сигналы ароматических колец дифосфинового лиганда в области 7.3–8.0 м. д., тетраметиленового мостика в виде ряда мультиплетов в диапазоне 1.2–3.8 м. д., двух уширенных синглетов CH-групп карборанового лиганда при 3.62 и 2.88 м. д., а также синглета метильного заместителя в карборановом лиганде при 0.07 м. д. Сигнал атома водорода, связанного с рутением, проявляется при –8.35 м. д., что подтверждает образование соединения с предложенной структурой.
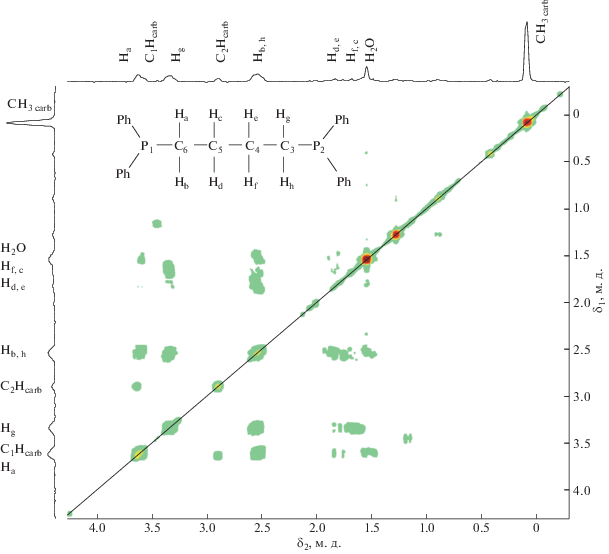
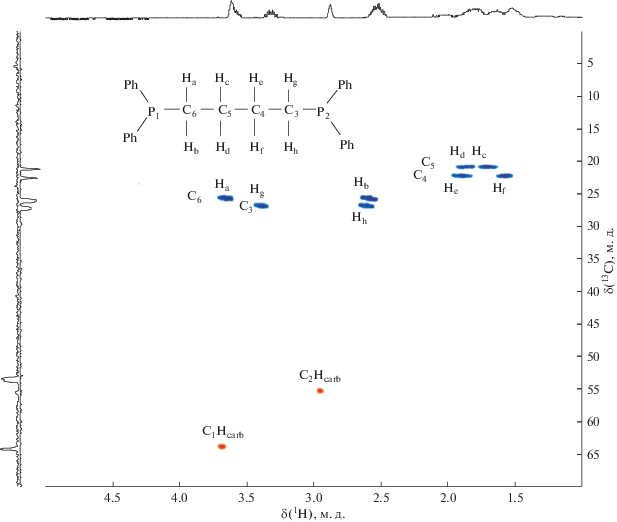
Появление метильного заместителя в структуре карборанового лиганда приводит к потере молекулой плоскости симметрии, что отражается в неэквивалентности атомов фосфора, атомов углерода карборановой корзины и мостиковых групп дифосфиновых лигандов, а также атомов бора. Это, в свою очередь, приводит к увеличению числа сигналов в соответствующих ЯМР-спектрах. На основании детального анализа двумерных 1H–1H COSY и 1H–13C HSQC ЯМР-спектров, приведенных на рис. 1 и 2 соответственно, было проведено соотнесение наблюдаемых в спектре сигналов протонов тетраметиленового мостика.
В 1H–1H COSY спектре четко видны корреляции между магнитно-неэквивалентными геминальными протонами и протонами соседних CH2-групп. В свою очередь, спектр 1H–13C HSQC однозначно показывает неэквивалентность всех четырех атомов углерода тетраметиленового мостика, а также атомов углерода карборанового остова, обусловленную введением заместителя в его структуру.
Спектр 11B{1H} ЯМР содержит сигналы 9 атомов бора при –19.2 (2B), –17.2 (1B), –5.4 (3B), –3.5 (1B), 4.8 (1B) и 8.7 (1B) м. д. Присутствие метильного заместителя карборанового лиганда приводит к неэквивалентности положений 9 и 12, 5 и 11, 7 и 4, что обусловливает более сложную структуру спектра 11B{1H} ЯМР комплекса 1 по сравнению со спектром его незамещенного аналога [12].
Предполагаемое строение комплекса 1 подтверждено рентгеноструктурным анализом (рис. 3). Кристаллографические данные для C31H40.5B9ClP2Ru: моноклинная сингония, пространственная группа P21/c (№ 14); параметры элементарной ячейки при T = 100(2) K: a = 16.8387(2) Å, b = = 20.26530(10) Å, c = 20.8907(2) Å, β = = 107.8700(10)°, V = 6784.84(11) Å3, Z = 8, d = = 1.388 г см–3. Данные РСА депонированы в Кембриджский банк структурных данных (номер CCDC 2058775). Атом рутения координирован открытой C2B3-плоскостью карборанового лиганда и связан с двумя атомами фосфора дифосфинового лиганда, атомами хлора и водорода. Значения длин связей и валентных углов аналогичны таковым для его незамещенного аналога [10], что говорит о том, что наличие заместителя в нижнем поясе карборанового лиганда не оказывает влияния на пространственную конфигурацию атома металла. Согласно результатам анализа, в кристаллической структуре присутствуют два типа независимых молекул, незначительно отличающихся длинами связей и валентных углов. При этом для каждого типа молекул наблюдается разупорядоченность метильных заместителей по двум симметричным положениям (9 и 12), что свидетельствует об образовании в ходе реакции двух энантиомеров. Согласно данным РСА метильный заместитель также может присутствовать в положении 10 карборанового остова. Заселенность данного положения составляет порядка 12%, причем характерна только для одного из двух обнаруженных в кристалле положений молекул. Эти данные говорят о том, что содержание данного изомера не превышает 6%. Столь малое его содержание и возможное перекрывание сигналов с сигналами от его изомера не позволяют обнаружить его присутствие в спектрах ЯМР.
Рис. 3.
Структура комплекса 1. Приведена одна из двух независимых молекул. Разупорядоченность метильного заместителя С7 по положениям В9, В10 и В12 не показана. Избранные длины связей Ru1–Cl1 2.4384(5) и 2.4311(6) Å (для двух независимых молекул), Ru1–H1 1.52(3) и 1.49(4) Å, Ru1–P1/P2 2.3382(6)–2.3701(6) Å, Ru1–C1/C2 2.198(2)–2.274(2) Å и Ru1–B4/B7/B8 2.225(2)–2.298(2) Å; валентные углы P1–Ru1–P2 102.28(2) и 102.13(2)°, H1–Ru1–Cl1 138(1) и 136(1)° и P1–Ru1–Cl1 81.46(2) и 82.78(2)°.

С целью изучения возможности применения комплекса 1 в роли катализатора полимеризации по механизму с переносом атома была исследована его реакционная способность по отношению к четыреххлористому углероду, традиционно используемому в качестве инициатора рассматриваемого процесса. Показано, что нагревание соединения 1 в бензоле в присутствии четыреххлористого углерода при температуре 80°С (схема 4) приводит к образованию 17-электронного парамагнитного комплекса [3,3-(Ph2P(CH2)4PPh2)-3-Cl-9-Me-клозо-3,1,2-RuC2B9H11] (2) с выходом 40%.
В МАЛДИ масс-спектре соединения 2, зарегистрированного в отрицательном режиме, присутствует один типичный интенсивный сигнал в виде “конверта” с центром при 709 Да, отвечающий молекулярному аниону и полностью соответствующий теоретически рассчитанному распределению, что подтверждает предположенное для комплекса строение.
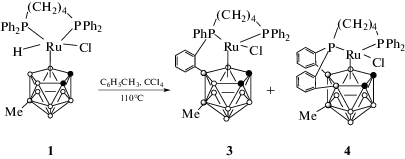
В результате термолиза соединения 1 в толуоле при температуре 110°С в течение 5 ч (схема 5) в присутствии небольшого количест-ва четыреххлористого углерода были выде- лены рутенакарбораны
3,3-(Ph2P(CH2)4PPh-μ- (3) и 3,3-(Ph2P(CH2)4P-μ-
(3) и 3,3-(Ph2P(CH2)4P-μ- (4), содержащие в своей структуре орто-фениленциклоборированные фрагменты, в виде темно-красных кристаллов с выходами 27
и 14% соответственно.
(4), содержащие в своей структуре орто-фениленциклоборированные фрагменты, в виде темно-красных кристаллов с выходами 27
и 14% соответственно.
Идентификацию соединений проводили на основании их масс-спектров и УФ-спектров, сравнивая их с таковыми для ранее полученных незамещенных рутенакарборанов. На основании проведенных экспериментов можно сделать вывод о том, что реакции соединения 1 с четыреххлористым углеродом в бензоле и толуоле в целом аналогичны описанным ранее для его незамещенного аналога, что говорит о том, что наличие метильной группы в нижнем поясе карборанового лиганда не приводит к существенному изменению реакционной способности.
Исследование соединений 3 и 4 методом циклической вольтамперометрии (ЦВА) показало, что указанные соединения претерпевают обратимый переход Ru(III)–Ru(II) при величине потенциалов –423 и –464 мВ относительно ферроцена соответственно (рис. 4). Как видно, для комплекса 4 с двумя орто-фениленциклоборированными фрагментами характерно более низкое значение потенциала. Окисление комплекса 3 происходит необратимо и характеризуется максимумом тока при значении потенциала Epa = –600 мВ, тогда как комплекс 4 способен к обратимому окислению при E1/2 = 555 мВ. Несмотря на то что поведение соединений 3 и 4 в условиях электрохимического эксперимента в целом аналогично поведению их незамещенных аналогов, примечательно, что переходы Ru(II)–Ru(III) происходят при более низких значениях потенциала. Это свидетельствует о том, что метильный заместитель в структуре рутенакарборана следует рассматривать как донор электронной плотности, несмотря на то, что углерод является более электроотрицательным элементом по сравнению с бором. В отличие от соединений 3 и 4, 18-электронный комплекс 1 не способен к обратимым электрохимическим превращениям. Его окисление происходит необратимо и характеризуется максимумом на кривой ЦВА при значении потенциала порядка 960 мВ относительно ферроцена.
Рис. 4.
Кривые ЦВА, зарегистрированные для рутенакарборанов 1, 3 и 4 в 1,2-дихлорэтане (С = 3 × 10–3 М). Фоновый электролит – n-Bu4NPF6 (0.2 M). Скорость развертки потенциала 100 мВ с–1.

Изучение полимеризации метилметакрилата (ММА) в присутствии синтезированных комплексов 1, 3 и 4 показало, что они способны выступать в качестве катализаторов контролируемой радикальной полимеризации по механизму с переносом атома даже при концентрации 0.01 мол. %. Как следует из данных табл. 1, наибольшая скорость процесса полимеризации наблюдалась в случае применения в катализе комплекса 1, а проведение процесса в присутствии соединений 3 и 4 позволило добиться лучшего контроля над молекулярно-массовым распределением. Полученные образцы характеризуются унимодальным молекулярно-массовым распределением. Протекание полимеризации сопровождается ростом молекулярной массы и снижением дисперсии образцов с увеличением степени конверсии. Следует отметить, что наблюдаемые закономерности характерны для процессов, протекающих в контролируемом режиме. Применение в качестве катализаторов соединений 3 и 4 позволило получить образцы, характеризующиеся более узким молекулярно-массовым распределением, чем образцы, полученные в аналогичных условиях в присутствии их незамещенных аналогов или рутенакарборанов, содержащих метильные заместители при атомах углерода в верхнем поясе карборанового лиганда [11].
Таблица 1.
Результаты экспериментов по полимеризации метилметакрилата под действием синтезированных комплексов. Мольное соотношение компонентов [MMA] : [CCl4] : [комплекс] : [i-PrNH2] = 10000 : 25 : 1:40; T = 80°С
| Комплекс | Время, ч | Степень конверсии, % | Среднечисловая молекулярная масса Mn | Дисперсия Ð |
|---|---|---|---|---|
| 1 | 3 | 44 | 25 300 | 1.71 |
| 5 | 68 | 31 200 | 1.55 | |
| 9 | 95 | 39 800 | 1.45 | |
| 11 | 99 | 45 500 | 1.40 | |
| 3 | 3 | 18 | 11 200 | 1.66 |
| 6 | 35 | 17 800 | 1.50 | |
| 9 | 50 | 23 500 | 1.42 | |
| 19 | 83 | 34 800 | 1.32 | |
| 4 | 1 | 5 | 4700 | 1.50 |
| 6 | 29 | 13 400 | 1.44 | |
| 9 | 46 | 19 100 | 1.36 | |
| 13 | 80 | 33 400 | 1.30 |
Выявленные закономерности хорошо коррелируют с ранее наблюдаемым эффектом увеличения каталитической активности циклопентадиенильных (Cp) комплексов рутения при переходе от незамещенного к пентаметилзамещенному (Cp*) лиганду [19], а также при введении электронодорных заместителей в структуру трис(2-пиридилметил)амина [20].
Таким образом, показано, что введение заместителей в нижний пояс карборанового лиганда карборановых кластеров переходных металлов дает возможность управлять их каталитической активностью. При этом, в отличие от известных методов модификации свойств металлакарборанов за счет введения заместителей к атомам углерода или атому бора в положении 8 в верхнем поясе карборанового лиганда, предложенный подход оказывает влияние на распределение электронной плотности в рутенакарборановых кластерах, не затрагивая пространственную конфигурацию атома металла.
Список литературы
Destarac M. // Polym. Chem. 2018. V. 9. № 40. P. 4947–4967. https://doi.org/10.1039/C8PY00970H
Corrigan N., Jung K., Moad G., Hawker C.J., Matyjaszewski K., Boyer C. // Progr. Polym. Sci. 2020. V. 111. Article No. 101311. https://doi.org/10.1016/j.progpolymsci.2020.101311
Гришин Д.Ф., Гришин И.Д. // Успехи химии. 2021. V. 90. № 2. P. 231–264. https://doi.org/10.1070/RCR4964
Król P., Chmielarz P. // Progr. Org. Coat. 2014. V. 77. № 5. P. 913–948. https://doi.org/10.1016/j.porgcoat.2014.01.027
Fung A.K.K., Coote M.L. // Polym. Int. 2020. https://doi.org/10.1002/pi.6130
Ouchi M., Terashima T., Sawamoto M. // Chem. Rev. 2009. V. 109. № 11. P. 4963–5050. https://doi.org/10.1021/cr900234b
Jones G.R., Anastasaki A., Whitfield R., Engelis N., Liarou E., Haddleton D.M. // Angew. Chem. Int. Ed. 2018. V. 57. № 33. P. 10468–10482. https://doi.org/10.1002/anie.201802091
Ribelli T.G., Fantin M., Daran J.-C., Augustine K.F., Poli R., Matyjaszewski K. // J. Am. Chem. Soc. 2018. V. 140. № 4. P. 1525–1534. https://doi.org/10.1021/jacs.7b12180
Lorandi F., Matyjaszewski K. // Isr. J. Chem. 2019. V. 60. № 1–2. P. 108–123. https://doi.org/10.1002/ijch.201900079
Grishin I.D., D’yachihin D.I., Piskunov A.V., Smol’ya-kov A.F., Il’in M.M., Davankov V.A., Chizhevsky I.T., Grishin D.F. // Inorg. Chem. 2011. V. 50. № 16. P. 7574–7585. https://doi.org/10.1021/ic200487w
Гришин И.Д., Тюрмина Е.С., Дьячихин Д.И., Виноградов Д.C., Пискунов А.В., Смоляков А.Ф., Долгушин Ф.М., Чижевский И.Т., Гришин Д.Ф. // Изв. АН Сер. Хим. 2011. № 11. P. 2328–2336.
Чередилин Д.Н., Балагурова Е.В., Годовиков И.А., Солодовников С.П., Чижевский И.Т. // Изв. АH. Сер. хим. 2005. № 11. P. 2455–2459.
Алексеев Е.С., Алентьев А.Ю., Белова А.С., Бог-дан В.И., Богдан Т.В., Быстрова А.В., Гафарова Э.Р., Голубева Е.Н., Гребеник Е.А., Громов О.И., Даван-ков В.А., Злотин С.Г., Киселев М.Г., Коклин А.Е., Кононевич Ю.Н., Лажко А.Э., Лунин В.В., Любимов С.Е., Мартьянов О.Н., Мишанин И.И., Музафаров А.М., Нестеров Н.С., Николаев А.Ю., Опарин Р.Д., Паренаго О.О., Паренаго О.П., Покусаева Я.А., Ронова И.А., Соловьева А.Б., Темников М.Н., Тимашев П.С., Турова О.В., Филатова Е.В., Филиппов А.А., Чибиря-ев А.М., Шалыгин А.С. // Успехи химии. 2020. Т. 89. № 12. С. 1337–1427. https://doi.org/10.1070/RCR4932
Тевяшова А.Н., Чудинов М.В. // Успехи химии. 2021. Т. 90. № 4. С. 451–487. https://doi.org/10.1070/RCR4977
Сиваев И.Б. // Изв. АH. Сер. хим. 2018. № 7. P. 1117–1130.
Andrews J.S., Zayas J., Jones M. // Inorg. Chem. 1985. V. 24. P. 3715–3716. https://doi.org/10.1021/ic00216a053
Гальченко Г.Л., Тамм Н.Б., Павлович В.К., Ольшевская В.А., Захаркин Л.И. // Металлоорг. химия. 1990. V. 3. P. 414–418.
Захаркин Л.И., Ольшевская В.А., Петровский П.В. // Журн. общ. химии. 2000. V. 70. P. 728–732.
Ando T., Kamigaito M., Sawamoto M. // Macromolecules. 2000. V. 33. P. 5825–5829. https://doi.org/10.1021/ma9921596
Ribelli T.G., Fantin M., Daran J-C., Augustine K.F., Poli R., Matyjaszewski K. // J. Am. Chem. Soc. 2018. V. 140. P. 1525–1534. https://doi.org/10.1021/jacs.7b12180
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах