Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 498, № 1, стр. 64-68
Скоростное превращение метана в водород на поверхности углеродного адсорбента, стимулированное микроволновым излучением
А. В. Чистяков 1, *, Г. И. Константинов 1, М. В. Цодиков 1, член-корреспондент РАН А. Л. Максимов 1
1 Институт нефтехимического синтеза
им. А.В. Топчиева Российской академии наук
119991 Москва, Россия
* E-mail: chistyakov@ips.ac.ru
Поступила в редакцию 18.03.2021
После доработки 28.04.2021
Принята к публикации 08.06.2021
Аннотация
В работе представлены результаты по скоростному получению H2 из CH4 путем его прямого разложения в плазменно-каталитическом режиме, стимулированном микроволновым излучением при индуцированной излучением температуре 600°С в реакционном объеме реактора. Метан пропускали через слой железосодержащего углеродного адсорбента, полученного из газового угля, обладающего высоким значением диэлектрических потерь. При микроволновом излучении на поверхности железоуглеродной системы возникают интенсивные пробойные эффекты с генерированием плазмы. Метан в плазме конвертируется в водород и углерод. Разработан способ скоростной регенерации катализатора парами воды с удалением углерода при микроволновом стимулировании. В короткоцикловых экспериментах показана способность каталитической системы к высокой степени конверсии метана и практически полной ее регенерации.
Разработка эффективных подходов к получению водорода из природного газа является одной из актуальных проблем в современной энергетике [1–3]. Известные процессы получения водорода, несмотря на свою эффективность, характеризуются рядом недостатков [4]. Так, паровая конверсия требует больших энергетических затрат, окислительная конверсия с использованием кислорода воздуха небезопасна в результате возможности образования взрывоопасных концентраций [5–7]. Углерод в этих процессах выделяется в виде диоксида, что, с учетом требования декарбонизации, энергетики и химической промышленности, ведет к дополнительным затратам на его улавливание и хранение [8]. Альтернативой может служить процесс пиролиза метана с образованием водорода и углерода как сопутствующего продукта [9]. Для этого могут применяться различные варианты организации процесса: термические (например, в расплавленных металлах [10, 11]), каталитические [12], плазмохимические [13, 14]. В последнем случае возможны различные подходы к реализации процесса, в том числе и с использованием плазмы, генерируемой микроволновым излучением (МВИ).
Нами было показано, что углеродные адсорбенты, разработанные на базе ископаемого и растительного сырья, обладают высоким значением тангенса угла диэлектрических потерь (≥12), превосходящим более чем на порядок аналогичный показатель для воды [21, 22]. Облучение таких адсорбентов МВИ приводило к интенсификации пробойных эффектов и генерированию плазмы. Причем зольные примеси, содержащиеся в количестве до 25% в этих адсорбентах, существенным образом влияют на скорость генерирования плазмы [23]. С учетом этих свойств адсорбентов были разработаны эффективные способы уничтожения аналогов токсичных и техногенных загрязнений [17, 24]. В развитии этого направления большое внимание уделяется разработке альтернативных подходов к получению энергоносителей из высокостабильных органических субстратов нефтяного и растительного происхождения в плазменно-каталитическом режиме, стимулированном МВИ [25–28].
В настоящем сообщении представлены результаты исследования реакции скоростного разложения метана на поверхности железосодержащего углеродного адсорбента, получаемого на основе газового угля, при стимулировании МВИ.
Превращение метана проводили на оригинальной установке, состоящей из генератора МВИ с частотой 2.45–2.50 ГГц, волновода, кварцевого реактора с загруженным адсорбентом и погруженным в волновод и оконечной нагрузки для поглощения остаточного излучения. В типовом эксперименте в кварцевый реактор загружали 20 см3 адсорбента. Для генерирования плазмы использовали железосодержащий углеродный адсорбент, полученный на основе газового угля [29]. Основные свойства адсорбента приведены в табл. 1. Блок-схема разработанного макета установки подробно описана в [30].
Таблица 1.
Основные показатели углеродного адсорбента
| Природа углеродного адсорбента | Ad, % | γнас., г см–3 | tg δ | Объемы и размер пор углеродного адсорбента | Содержание железа, масс. % | |||
|---|---|---|---|---|---|---|---|---|
| VΣ, см3 г–1 | Ws, см3 г–1 | Vма, см3 г–1 | хо, нм | |||||
| Газовый уголь | 26.5 | 0.32 | 12.72 | 1.48 | 0.43 | 1.05 | 0.76 | 3.44 |
Метан пропускали через слой адсорбента со скоростью 60 см3 мин–1. Облучение бегущей волной проводили при силе тока 150 мА и мощности 6–8 мВт. Содержание Н2, СН4, СО и СО2 в получаемом газе определяли методом газовой хроматографии в режиме “on-line” на хроматографе Кристаллюкс-4000М (детектор ДТП, насадочная колонка, заполненная углеродной фазой марки СКТ, газ-элюент Ar; Россия). С целью определения возможности образования газообразных углеводородов пробу газа анализировали на хроматографе Кристаллюкс-4000М (капиллярная колонка HP-PLOT/Al2O3, детектор ПИД, газ-носитель He).
При микроволновом облучении загруженного адсорбента и пропускании через его объем метана наблюдались пробойные эффекты, повышение температуры в реакционном объеме и появление свечения. На рис. 1 представлены основные показатели по превращению метана при температуре 600°С, индуцированной облучением, в реакционном объеме реактора. На рис. 1 видно, что через 1 мин после начала реакции в стационарном режиме степень конверсии метана в водород и углерод составила 84% согласно прямой реакции:
Рис. 1.
Состав реакционного газа ( концентрация CH4, об. %,
концентрация CH4, об. %,  концентрация H2, об. %) и
концентрация H2, об. %) и 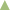 степень конверсии метана (%), полученные в результате разложения метана в плазменно-каталитическом
режиме, стимулированном МВИ.
степень конверсии метана (%), полученные в результате разложения метана в плазменно-каталитическом
режиме, стимулированном МВИ.
На 20-й минуте эксперимента степень конверсии метана снизилась более, чем в двое, до 26%. Через 40 мин степень превращения метана снизилась до 2% при практически полном затухании плазмы.
Для восстановления активности углеродного адсорбента в поглощении МВИ и генерировании плазмы на адсорбент после прекращения облучения подавали 20 см3 дистиллированной воды (влагоемкость углеродного адсорбента по воде 4 см3 г–1) и затем подавали микроволновое облучение одновременно с подачей метана. Обработка паром поверхности адсорбента после стадии переработки метана при облучении МВИ приводит к образованию водорода, моно- и диоксида углерода. Следует отметить, что суммарное количество углерода в оксидах углерода эквивалентно количеству углерода, которое должно было отложиться на адсорбенте в ходе конверсии метана (табл. 2). После 4 мин облучения в реакционной зоне появлялось свечение и наблюдался резкий рост температуры до 600°C (рис. 1). После регенерации адсорбента водой и выхода на режим степень конверсии метана составила 84% после 1 мин экспозиции. Через 4 мин после начала эксперимента степень конверсии метана снизилась на 10%, а также наблюдалось постепенное затухание плазмы. Суммарно было проведено 4 последовательных опыта и три стадии регенерации (рис. 1). В течение трех циклов регенерации наблюдалось полное восстановление способности адсорбента к поглощению МВИ и активности в конверсии метана.
Таблица 2.
Количество углерода, образующееся на стадии прямого разложения метана и удаляемое в ходе регенерации адсорбента
| Номер цикла | Время протекания цикла, мин | Отложилось углерода из пропущенного метанаа, ммоль | Снято углеродаб, ммоль | |
|---|---|---|---|---|
| 1 | Разложение | 40 | 22.2 | – |
| 1а | Регенерация | 4 | – | 22.3 |
| 2 | Разложение | 5 | 8.6 | – |
| 2а | Регенерация | 4 | – | 8.7 |
| 3 | Разложение | 5 | 8.7 | – |
| 3а | Регенерация | 4 | – | 8.7 |
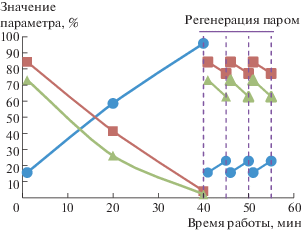
На рис. 2 представлена динамика нагрева реакционного объема реактора, заполненного исходным адсорбентом (кривая 1), адсорбента после 15 мин работы в режиме (кривая 2), после 30 мин работы в режиме в процессе превращения метана (кривая 3), в процессе регенерации (кривая 4). Реакционный объем со свежим углеродным адсорбентом при подаче МВИ в среде метана за 3 мин нагревали до температуры 600°C (рис. 2, кривая 1), при которой происходит превращение метана в плазменно-каталитическом режиме. Через 15 мин после выхода на стационарный режим облучение остановили; реакционная зона остыла до комнатной температуры. Затем, без регенерации адсорбента, облучение МВИ возобновили, и оказалось, что нагрев происходит значительно медленнее и, более того, за 15 мин экспозиции температура не достигает 600°С (рис. 2, кривая 2). Третий цикл измерения динамики нагрева реакционной зоны (суммарно после 30 мин работы в стационарном режиме, рис. 2, кривая 3) показал полную идентичность динамике нагрева во втором цикле. В ходе регенерации адсорбента подъем температуры характеризовался пологим участком в течение первых 4 мин, после чего вода полностью испарялась из реакционного объема и наблюдался резкий подъем температуры (рис. 2, кривая 4). После испарения воды в ходе регенерации динамика нагрева симбатно повторяла нагрев реакционного объема реактора, загруженного исходным углеродным адсорбентом, при этом также наблюдалось свечение реакционной зоны. В этом режиме превращение метана с выделением водорода полностью воспроизводилось как в первоначальном опыте.
Рис. 2.
Динамика нагрева реакционного объема реактора с загруженным исходным адсорбентом (кривая 1), после 15 мин работы в режиме (кривая 2) и после 30 мин работы в режиме в процессе превращения метана (кривая 3) и регенерации (кривая 4).
Ранее при изучении влияния состава пор поверхности углеродных адсорбентов на уровень поглощения МВИ было установлено, что наиболее интенсивная динамика нагрева с генерированием плазмы реализуется на адсорбентах, обладающих повышенным адсорбционным объемом макро- и мезопор, по сравнению с микропористыми образцами [21–23]. На основании полученных результатов и теоретического анализа механизма поглощения МВИ углеродными адсорбентами была высказана гипотеза, что макро- и мезопоры играют роль псевдоконденсаторов при микроволновом излучении – эффекты пробоя в большей степени реализуются на стенках пор, в то время как микропоры могут играть роль неровностей поверхности, усиливая эффекты пробоя согласно известному эффекту Фаулера–Нордгейма. На основании высказанной гипотезы и результатов настоящего исследования можно предположить, что при интенсивном превращении метана образующийся углерод заполняет поры, приводя к снижению пробойных эффектов, гашению плазмы и снижению уровня поглощения МВИ. Адсорбированная на поверхности сорбента вода при МВИ находится в ионизированном состоянии, что, вероятно, повышает активность в эндотермической реакции газификации:
Другим фактором интенсификации эндотермической реакции газификации может быть размерный фактор частиц образующегося углерода. Как результат, за 4 мин выделяется СО в количестве, эквивалентном отложившемуся на поверхности адсорбента углерода в ходе прямого разложения метана (табл. 2).
После удаления углерода с поверхности адсорбента были зафиксированы быстрый рост температуры при МВИ и генерирование плазмы, в режиме которой протекало интенсивное разложение метана с выделением Н2.
В ранее опубликованных работах также отмечалось, что при инициировании МВИ разрушение связи С–Н в алифатических и ароматических углеводородах было наиболее предпочтительным [17, 23–26]. При этом разрыв связи С–Н наблюдался при видимой в реакционной зоне температуре 250–300°C, но, конечно, температура в центрах пробоя и плазмы на поверхности каталитической системы была существенно выше. Наблюдаемый эффект отражает взаимодействие субстратов с поверхностью катализаторов, обладающих высоким значением диэлектрических потерь.
Разрыв высокопрочной связи С–Н, вероятно, происходит в результате взаимодействия метана с поверхностью каталитической системы, на которой интенсивно протекают эффекты пробоя. Не следует также исключать влияние поляризации и переполяризации органических субстратов в плазменном режиме на ослабление С–Н-связи [31].
Таким образом, полученные результаты демонстрируют возможность интенсификации эндотермических реакций, направленных на прямое получение водорода в кратких циклических режимах прямого разложения метана и регенерации при микроволновом стимулировании.
Высокая селективность и эффективность предложенного способа регенерации предполагают существенное упрощение технологии и снижение тепловых затрат на организацию процесса в целом.
Список литературы
Везироглу Т.Н., Сахин Ш. // Международный научный журнал Альтернативная энергетика и экология. 2014. № 2. С. 12–28.
Венгеров Ю.Л., Бутылин В.В., Родионов Д.Н. // Интеграл. 2014. № 1. С. 38–41.
Голуб Н.Б. // Международный научный журнал Альтернативная энергетика и экология. 2014. № 19. С. 53–57.
Sazali N. // Int. J. Hydrogen Energy. 2020. V. 45. № 38. P. 18753–18771. https://doi.org/10.1016/j.ijhydene.2020.05.021
Zhang B., Zhang S.-X., Yao R., Wu Y.H., Qiu J.S. // J. Electron. Sci. Technol. 2021. P. 100080. https://doi.org/10.1016/j.jnlest.2021.100080
Savchenko V.I., Nikitin A.V., Ozerskii A.V., Zimin Y.S., Sedov I.V., Arutyunov V.S. // Pet. Chem. 2020. V. 60. № 7. P. 818–826. https://doi.org/10.1134/S0965544120070130
Haghi S.B., Salehi G., Azad M.T., Nichkoohi A.L. // Pet. Chem. 2020. V. 60. № 11. P. 1251–1259. https://doi.org/10.1134/S0965544120110109
Energy Technology Perspectives 2020 Special Report on Carbon Capture, Utilisation and Storage. IEA 2020. https://www.researchgate.net/publication/345807050_ETP_2020_Special_Report_on_Carbon_Capture_Utilisation_and_Storage_CCUS_in_clean_energy_transitions (Ссылка активна на 16 июня 2021 г.)
Fan Z., Weng W., Zhou J., Gu D., Xiao W. // J. Energy Chem. 2020. V. 58. № 1. P. 415–430. https://doi.org/10.1016/j.jechem2020.10.049
Kudinov I.V., Pimenov A.A., Mikheeva G.V. // Pet. Chem. 2020. V. 60. № 11. P. 1239–1243. https://doi.org/10.1134/S0965544120110122
Parfenov V.E., Nikitchenko N.V., Pimenov A.A., Kuz’min A.E., Kulikova M.V., Chupichev O.B., Maksimov A.L. // Russ. J. Appl. Chem. 2020. V. 93. № 5. P. 625–632. https://doi.org/10.1134/S1070427220050018
Gubanov M.A., Ivantsov M.I., Kulikova M.V., Kryuch-kov V.A., Nikitchenko N.V., Knyazeva M.I., Kulikov A.B., Pimenov A.A., Maksimov A.L. // Pet. Chem. 2020. V. 60. № 9. P. 1043–1051. https://doi.org/10.1134/S096554412009011X
Deminsky M., Jivotov V., Potapkin B., Rusanov V. // Pure Appl. Chem. 2002. V. 74. № 3. P. 413–418. https://doi.org/10.1351/pac200274030413
Slovetskii D.I. // High Energy Chem. 2006. V. 40. № 2. P. 86–92. https://doi.org/10.1134/S0018143906020044
Tsodikov M.V., Arapova O.V., Chistyakova A.V., Konstantinov G.I. // Chem. Eng. Transactions. 2017. V. 57. P. 223–228. https://doi.org/10.3303/CET1757038
Tsodikov M.V., Ellert O.G., Nikolaev S.A., Arapova O.V., Bukhtenko O.V., Maksimov Yu.V., Kirdyankin D.I., Vasil’kov A.Yu. // J. Nanopart. Res. 2018. V. 20. № 3. Article no. 86. https://doi.org/10.1007/s11051-018-4185-7
Цодиков М.В., Хаджиев С.Н., Передерий М.А., Кадиев Х.М., Чистяков А.В., Мартынов Б.И., Константинов Г.И., Марин В.П. / Патент РФ № 2462500. 2012.
Стром Дж.Дж., Лайхен Дж.К., Робертс Б.К., Макмейкин Д.Л., Шин Д.М., Гриффин Д.У., Франц Д.А. / Патент РФ № 2636151. 2017.
Wu Z., Zhao X., Zhang J., Li X., Zhang Y., Wang F. // Bioresour. Technol. 2019. V. 278. P. 187–194. https://doi.org/10.1016/j.biortech.2019.01.082
Wang W., Ma Z., Zhao X., Liu S., Cai L., Shi S.Q., Ni Y. // ACS Sustainable Chem. Eng. 2020. V. 8. № 43. P. 16086–16090. https://doi.org/10.1021/acssuschemeng.0c04658
Цодиков М.В., Передерий М.А., Карасева М.С., Максимов Ю.В., Суздалев И.П., Гурко А.А., Жеваго Н.К. // Российские нанотехнологии. 2006. Т. 1. № 1–2. С. 153–161.
Цодиков М.В., Передерий М.А., Карасева М.С., Гурко А.А., Марин В.П., Жеваго Н.К., Максимов Ю.В., Суздалев И.П. // Наукоемкие технологии. 2007. Т. 8. № 4. С. 58–67.
Tsodikov M.V., Perederii M.A., Chistyakov A.V., Konstantinov G.I., Kadiev K.M., Khadzhiev S.N. // Solid Fuel Chem. 2012. V. 46. № 2. P. 121–127. https://doi.org/10.3103/S0361521912020115
Tsodikov M.V., Ellert O.G., Nikolaev S.A., Arapova O.V., Bukhtenko O.V., Maksimov Yu.V., Kirdyankin D.I., Vasil’kov A.Yu. // J. Nanopart. Res.2018. V. 20. № 3. P. 86–101. https://doi.org/10.1007/s11051-018-4185-7
Arapova O.V., Chistyakov A.V., Palankoev T.A., Bondarenko G.N., Tsodikov M.V. // Petr. Chem. 2020. V. 60. № 9. P. 1019–1025. https://doi.org/10.1134/S0965544120090029
Arapova O.V., Chistyakov A.V., Tsodikov M.V., Moise- ev I.I. // Pet. Chem. 2020. V. 60. P. 227–243. https://doi.org/10.1134/S0965544120030044
Li L., Feng H. // Pet. Sci. Technol. 2020. V. 38. № 8. P. 659–665. https://doi.org/10.1080/10916466.2020.1777161
Zaker A., Chen Z., Wang X., Zhang Q. // Fuel Process. Technol. 2019. V. 187. P. 84–104. https://doi.org/10.1016/j.fuproc.2018.12.011
Передерий М.А., Носкова Ю.А., Карасева М.С., Коновалов П.Н. // Химия твердого топлива. 2009. № 6. С. 36–46.
Arapova O.V., Bondarenko G.N., Chistyakov A.V., Tsodikov M.V. // Russ. J. Phys. Chem. A. 2017. V. 91. № 9. P. 1717–1729. https://doi.org/10.1134/S0036024417090059
Microwave Discharcharges: Fundamental and Applications, X International Workshop, (3–7 September, 2018, Zvenigorod, Russia), Edited by Yu.A. Lebedev, Yanus-K Moscow, 2018, 267 p. http://www.fpl.gpi.ru/md-10/program.html (Ссылка активна на 16 июня 2021 г.)
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах


