Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 498, № 1, стр. 42-50
Сравнительное исследование структуры и молекулярный докинг индолиновых спиропиранов, содержащих фрагмент альфа-липоевой кислоты
И. В. Ожогин 1, *, В. В. Ткачев 2, 3, А. С. Козленко 1, А. Д. Пугачев 1, М. Б. Лукьянова 1, академик РАН С. М. Алдошин 2, академик РАН В. И. Минкин 1, Б. С. Лукьянов 1, 4
1 НИИ физической и органической химии
Южного федерального университета
344090 Ростов-на-Дону, Россия
2 Институт проблем химической физики
Российской академии наук
142432 Черноголовка, Московская обл., Россия
3 Институт физиологически активных веществ Российской академии наук
142432 Черноголовка, Московская обл., Россия
4 Донской государственный технический университет
344007 Ростов-на-Дону, Россия
* E-mail: iozhogin@sfedu.ru
Поступила в редакцию 03.04.2021
После доработки 02.05.2021
Принята к публикации 19.05.2021
Аннотация
Работа посвящена исследованию двух производных спиропиранов индолинового ряда и α-липоевой кислоты, которые рассматриваются в качестве потенциальных фотофармакологических агентов с управляемой биологической активностью. Структура соединений детально изучена с помощью рентгеноструктурного анализа, выявившего высокую лабильность липоевых фрагментов молекул. Для оценки потенциальной биологической активности был проведен молекулярный докинг возможности связывания молекул спиропиранов с белком амилином с целью ингибирования его агрегации. Результаты молекулярного докинга показали потенциальное повышение аффинности у спироциклических производных к данному белку по сравнению с α-липоевой кислотой.
Спиропираны представляют собой один из наиболее интересных классов органических фотохромных соединений, молекулы которых способны претерпевать обратимую изомеризацию между обычно бесцветной спироциклической и яркоокрашенной мероцианиновой формами под действием различных внешних факторов, благодаря чему могут быть использованы в качестве легко настраиваемых молекулярных переключателей в самых разнообразных передовых отраслях науки и техники [1, 2].
В последнее время все более перспективным становится применение спиропиранов в области биомедицины. В частности, на основе существенного изменения дипольного момента молекул спиропиранов при облучении стала возможна фотоконтролируемая доставка лекарственных средств [3, 4], а проявление ими фотоуправляемых флуоресцентных свойств делает их эффективными флуоресцентными зондами для биовизуализации [5, 6]. Особо интересным направлением является создание молекулярных диад на основе биологически активных соединений и спиропиранов, так как наличие у такой гибридной молекулы фотохромной функции позволяет ожидать от нее проявления биологической активности, управлять которой можно дистанционно при облучении светом, а также с помощью других внешних факторов (температура, рН и т.д.), что предполагает использование подобных систем в рамках концепции фотофармакологии [7].
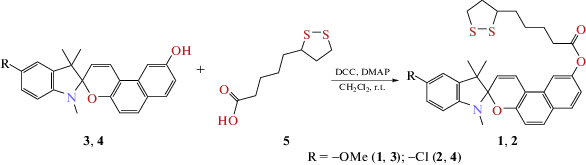
Ранее нами были получены молекулярные гибриды спиропиранов и α-липоевой кислоты (АЛК), обладающие крайне низкой цитотоксичностью и ярко выраженными сигнальными антиоксидантными свойствами, превосходящими таковые свойства у АЛК [8]. Целями данной работы были сравнительное исследование структуры гибридных соединений 1 [8] и 2, полученных на основе гидроксизамещенных спироиндолинонафтопиранов 3, 4 и АЛК 5 по реакции этерификации (схема 1), а также оценка их перспективности в качестве ингибиторов агрегации белка амилина с помощью методов молекулярного докинга.
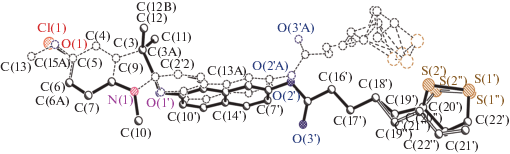
Кристаллы соединений 1 и 2, пригодные для рентгеноструктурного анализа, были получены из растворов в смеси метанол–ацетонитрил (1 : 1). Молекулярная структура полученных спиропиранов показана на рис. 1. Кристаллографические данные для соединений 1 и 2 представлены в табл. 1, а избранные длины связей, плоские и торсионные углы – в табл. 2.
Таблица 1.
Кристаллографические данные для соединений 1 и 2
| Параметр | Соединение 1 | Соединение 2 | |
|---|---|---|---|
| Формула | C32H30NO4S2 | C31H29ClNO3S2 | |
| Цвет кристаллов | светло-серый | бесцветный | |
| Молекулярная масса, г моль–1 | 556.69 | 563.02 | |
| Номер CCDC | 2042952 | 2043910 | |
| Температура, K | 150 | 100 | |
| Сингония | моноклинная | триклинная | |
| Пространственная группа | P21/n | P1 | |
| Параметры элементарной ячейки | a, Å | 13.7775(9) | 6.2600(13) |
| b, Å | 10.4189(7) | 11.0200(18) | |
| c, Å | 19.6652(15) | 21.034(2) | |
| α, град. | 90.00 | 88.520(9) | |
| β, град. | 92.839(7) | 81.440(9) | |
| γ, град. | 90.00 | 80.000(9) | |
| Объем V, Å3 | 2819.4(3) | 1413.1(4) | |
| Z | 4 | 2 | |
| Рассчитанная плотность ρ, г cм–3 | 1.311 | 1.319 | |
| μ(МоKα), мм–1 | 0.227 | 0.316 | |
| F(000) | 1172 | 589.8 | |
| Размер кристалла, мм | 0.37 × 0.35 × 0.32 | 0.38 × 0.23 × 0.13 | |
| Θmax, град. | 29.968 | 29.06 | |
| Измеренные отражения | 6093 | 5518 | |
| Независимые отражения | 3167 | 2761 | |
| Диапазон индексов | –17 < h < 17 | –7 < h < 7 | |
| –13 < k < 12 | –13 < k < 13 | ||
| –25 < l < 10 | –25 < l < 25 | ||
| Отражения с F > 4σ(F ) | 4066 | 2861 | |
| Количество уточненных параметров | 383 | 398 | |
| GOF | 1.047 | 1.228 | |
| wR2 | 0.2236 | 0.416 | |
| Rint | 0.0363 | 0.0596 | |
| R-фактор | 0.0808 | 0.1407 | |
Таблица 2.
Избранные длины связей l, углы и торсионные углы ω для соединений 1 и 2
| Связь | Соединение 1 | Соединение 2 |
|---|---|---|
| l, Å | ||
| O(1')–C(11') | 1.365(4) | 1.362(7) |
| O(1')–C(2'2) | 1.471(4) | 1.470(6) |
| N(1)–C(8) | 1.412(4) | 1.422(8) |
| N(1)–C(2'2) | 1.455(4) | 1.457(7) |
| N(1)–C(10) | 1.438(4) | 1.474(7) |
| C(3)–C(2'2) | 1.560(4) | 1.550(7) |
| C(2'2)–C(3') | 1.488(4) | 1.499(8) |
| C(3')–C(4') | 1.321(4) | 1.319(9) |
| O(1)–C(5) | 1.391(4) | – |
| O(1)–C(13) | 1.418(4) | – |
| Cl(1)–C(5) | – | 1.75(1) |
| C(6')–O(2') | 1.409(4) | 1.396(9) |
| C(15')–O(2') | 1.349(5) | 1.368(8) |
| C(15')–O(3') | 1.184(5) | 1.207(9) |
| C(15')–C(16') | 1.498(6) | 1.48(1) |
| C(22')–S(1') | 1.824(7) | 1.49(3) |
| C(20')–S(2') | 1.860(6) | 1.77(2) |
| S(1')–S(2') | 2.056(4) | 2.07(2) |
| Угол | ω, град. | |
| C(11')–O(1')–C(2'2) | 119.8(2) | 121.0(4) |
| C(8)–N(1)–C(2'2) | 107.9(2) | 106.9(4) |
| C(3')–C(2'2)–O(1') | 110.3(2) | 111.7(4) |
| C(2'2)–C(3)–C(9) | 101.6(2) | 101.3(5) |
| C(5')–C(6')–C(7') | 121.7(3) | 122.0(6) |
| C(4)–C(5)–C(6) | 121.7(3) | 123.1(9) |
| C(6')–O(2')–C(15') | 118.6(3) | 117.6(5) |
| O(2')–C(15')–O(3') | 122.5(4) | 121.0(7) |
| C(11')–C(12')–C(4') | 116.9(3) | 115.6(4) |
| C(3)–C(2'2)–N(1) | 103.0(2) | 102.7(4) |
| C(22')–S(1')–S(2') | 95.5(2) | 95(2) |
| C(21')–C(20')–S(2') | 107.4(4) | 107(2) |
| C(13)–O(1)–C(5) | 116.4(3) | – |
| Cl(1)–C(5)–C(6) | – | 118.4(8) |
| Торсионный угол | ω, град. | |
| C(6')–O(2')–C(15')–C(16') | –178.9(3) | 176.2(6) |
| C(18')–C(19')–C(20')–S(2') | –62.0(4) | 63(5) |
| C(8)–N(1)–C(2'2)–O(1') | –84.9(3) | –85.6(5) |
| C(16')–C(17')–C(18')–C(19') | 175.0(3) | –170(3) |
Липоевые фрагменты молекул в обоих случаях разупорядочены от атома С(18') по двум положениям a и b в соотношении 0.82 : 0.18 для соединения 1 и 0.45 : 0.55 для соединения 2, что обусловлено высокой подвижностью алкильной цепи (рис. 1).
Углы между среднеквадратичными плоскостями спиро-сочлененных индолинового и бензопиранового фрагментов в структурах 1 и 2 равны 84.92° и 85.60° соответственно. Для соединения 2 угол между среднеквадратичными плоскостями бензольного кольца и пиррольного цикла в индолиновой части равен 7.62°, а пиранового фрагмента и аннелированного к нему цикла – 3.13°, что указывает на неплоское строение вышеуказанных гетероциклов. Атомы нафталинового фрагмента пирановой части молекулы лежат в одной плоскости. Индолиновый атом азота имеет пирамидальное строение, сумма углов при нем равна 348.43°. При этом он лежит практически в плоскости бензольного ядра и атома С(3), отклонение от среднеквадратичной плоскости С(8–3) 0.003 Å. Такая деформация валентных углов вызвана значительным отклонением атома С(2,2') от плоскости С(8–3), которое составляет 0.456 Å. Пирановый цикл имеет конформацию полукресла с отклонением С(2,2') атома от среднеквадратичной плоскости остальных атомов цикла на 0.250 Å и атома О(1') на 0.229 Å. Длины связей N(1)–C(2,2'), С(2,2')–О(1') и О(1')–С(11') равны 1.457(7), 1.470(6) и 1.362(7) Å соответственно.
Фрагмент липоевой кислоты лежит вблизи плоскости нафталинового ядра молекулы. Торсионные углы C(5')–C(6')–O(2')–C(15'), C(6')–O(2')–C(15')–C(16') и O(2')–C(15')–C(16')–С(17') равны 115.76°, –176.21° и 171.98° соответственно. Отклонение атома О(2') от среднеквадратичной плоскости атомов нафталинового цикла составляет 0.107 Å, а угол между плоскостями нафталинового фрагмента и связи С(15')–О(3') – 66.83°. Торсионные углы С(17')–С(18')–С(19')–С(20'), С(17')–С(18')–С(19'')–С(20'') и С(18')–С(19')–С(20')–С(21'), С(18')–С(19'')–С(20'')–С(21'') соответственно равны 169.57°, –167.23°, –176.49° и 179.35°. Дитиолановые фрагменты имеют конформацию полукресла с отклонением атомов S(1'), S(2'), S(1'') и S(2'') от углеродных атомов соответствующих циклов на 0.759, 0.261, 0.395 и 0.629 Å соответственно.
Молекула спиропирана 1 деформирована несколько сильнее, что можно увидеть при пространственном наложении структур соединений 1 и 2 (рис. 2). Торсионные углы C(5')–C(6')–O(2')–C(15'), C(6')–O(2')–C(15')–C(16') и O(2')–C(15')–C(16')–С(17') соответственно равны –115.87°, –178.90° и –67.56°. Угол между среднеквадратичными плоскостями бензольного кольца и пиррольного цикла в индолиновой части равен 5.87°, а пиранового фрагмента и аннелированного к нему цикла – 5.88°. Нафталиновый фрагмент также непланарен – угол между аннелированными циклами составляет 2.12°. Индолиновый атом азота имеет пирамидальное строение, сумма углов при атоме азота составляет 348.05°. Атом азота лежит в плоскости бензольного ядра и атома С(3), отклонение от среднеквадратичной плоскости С(8–3) равно 0.002 Å. Как и в предыдущем случае, атом С(2,2') также достаточно сильно отклоняется от плоскости С(8–3) – на 0.446 Å. Метоксильная группа несколько повернута относительно плоскости бензольного цикла – отклонение для атома О(1) составляет 0.143 Å, а для С(13) – 0.169 Å. Пирановый цикл имеет конформацию полукресла с отклонением атома С(2,2') от среднеквадратичной плоскости остальных атомов цикла на 0.335 Å и атома О(1') на 0.294 Å. Длины связей N(1)–C(2,2'), С(2,2')–О(1') и О(1')–С(11') близки к таковым для спиропирана 1 и соответственно равны 1.456(4), 1.469(4) и 1.367(4) Å.
Атом O(2') отклоняется от среднеквадратичной плоскости нафталинового цикла на 0.154 Å, а угол между плоскостями цикла и связи С(15')–О(3') составляет 69.01°. Торсионные углы С(17')–С(18')–С(19')–С(20'), С(17')–С(18')–С(19'')–С(20''), С(18')–С(19')–С(20')–С(21') и С(18')–С(19'')–С(20'')–С(21'') равны 173.06°, –176.69°, 178.13° и 104.32° соответственно. Дитиолановые фрагменты имеют конформацию полукресла с отклонением атомов С(21'), С(22'), С(21'') и С(22'') от среднеквадратичной плоскости остальных атомов соответствующих циклов на 0.332, 0.375, 0.594 и 0.259 Å соответственно.
Кристаллы спиропирана 1 имеют слоистую, а 2 – колончатую структуру (рис. 3), что подтверждается наличием соответствующих укороченных контактов.
Рис. 3.
Упаковка молекул в кристаллах спиропиранов 1 (вид вдоль оси b) (а) и 2 (вид вдоль оси а) (б).

Благодаря наличию в молекуле фрагмента биологически активной АЛК, возможно рассматривать спиропираны 1 и 2 в качестве потенциальных фотофармакологических агентов. Ранее мы установили, что антиоксидантная активность 1 и 2 может превышать соответствующие показатели для АЛК [8]. При этом сама АЛК обладает широким спектром терапевтического действия и может применяться при лечении таких заболеваний, как диабетическая полинейропатия, болезнь Альцгеймера и других нейродегенеративных расстройств [9]. Одной из возможных причин биологической активности АЛК является способность ингибирования агрегации белка амилина, сопутствующей вышеупомянутым патологическим состояниям [10, 11].
Нами было проведено сравнение способности соединений 1 и 2 к связыванию с амилином (островковым амилоидным полипептидом IAPP) по сравнению с АЛК при помощи метода молекулярного докинга. Аффинность в паре белок–лиганд рассчитана с помощью ПО AutoDock Vina при использовании подхода гибкого докинга относительно нежестких фрагментов молекул лигандов, структуры которых были установлены методом РСА. Основные результаты докинга приведены в табл. 3. Наиболее выгодная конформация спиропирана 1 при его взаимодействии с амилином с точки зрения оценочной функции докинга и их двумерная диаграмма взаимодействий, полученная с помощью программы LigPlot+, представлены на рис. 4.
Таблица 3.
Результаты молекулярного докинга между белком амилином и ингибирующими лигандами
| Соединение | Аминокислотные остатки, участвующие во взаимодействиях с лигандом | Энергия связывания (Vina docking score), ккал моль–1 | |
|---|---|---|---|
| Гидрофобное взаимодействие | Водородные связи | ||
| 1 | Gln10, Arg11, Asn14, Phe15, Asn21, Asn22, Ala25, Val32 | O(3')…Asn31(l = 2.31 Å) | –8.0 |
| 2 | Arg11, Asn14, Phe15 | O(3')…Asn31(l = 2.31 Å) | –7.0 |
| α-липоевая кислота | Phe15, Asn21 | O(1)…Asn14 (l = 2.41 Å) | –3.7 |
| O(2)…Asn31 (l = 2.46 Å) | |||
Рис. 4.
Наиболее выгодная конформация спиропирана 1 при его взаимодействии с амилином (а) и их двумерная диаграмма взаимодействий (б).
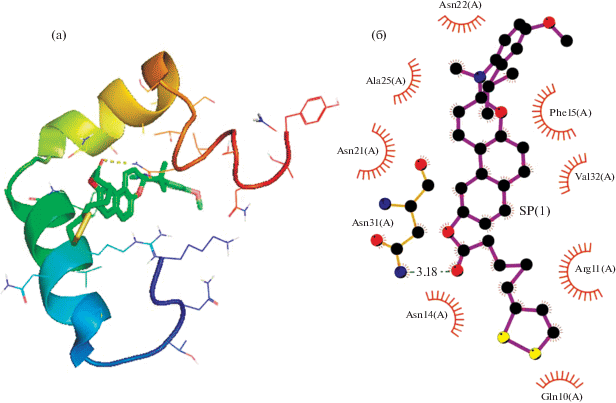
Результаты молекулярного докинга показали, что оба исследованных спиропирана могут образовывать водородную связь с аминокислотным остатком амилина Asn31. При этом соединение 1 образует еще восемь гидрофобных контактов с белком, в том числе с аспарагиновыми и аланиновым остатками Asn21, Asn22 и Ala25, находящимися на участке цепи (Ser20–Ser29) – одном из наиболее амилоидогенных регионов молекулы амилина [12]. Соединение 2 образует три гидрофобных контакта с Arg11, Asn14 и Phe15, а АЛК – с остатками Phe15 и Asn21. Также для АЛК было предсказано образование двух водородных связей с пептидными остатками Asn14 и Asn31. Оценочные энергии связывания соединений 1, 2 и АЛК с амилином составили –8.0, –7.0 и –3.7 ккал моль–1 соответственно, что позволяет ожидать от гибридных спиропиранов повышенной либо сравнимой с АЛК ингибирующей способности.
Таким образом, проведено исследование двух производных спиропиранов индолинового ряда и α-липоевой кислоты; спиропиран 2 является новым в данной серии. Молекулярная структура полученных соединений детально исследована методом РСА. Полученные данные показали высокую лабильность липоевых фрагментов в молекулах, которая достигается как за счет собственной подвижности алкильной цепи, так и вследствие неполного сопряжения между атомами кислорода сложноэфирной группы и деформированным нафталиновым фрагментом. Такая повышенная лабильность также может косвенно указывать на возможность образования более прочных невалентных взаимодействий, например, в случае лиганд-белковых комплексов. Моделирование методом молекулярного докинга показало возможность повышения аффинности к белку амилину при переходе от АЛК, для которой ранее установлена ингибирующая его агрегацию активность [11] к спироциклическим производным АЛК. Это указывает на высокий потенциал для использования полученных соединений в качестве ингибиторов агрегации амилина. При этом наиболее перспективным кандидатом является спиропиран 1, для которого, помимо наибольшей по модулю оценочной энергии связывания, были предсказаны гидрофобные взаимодействия с аминокислотными остатками на одном из ответственных за амилоидогенность участке молекулы. Также для спиропирана 1 была зарегистрирована склонность к фотоиндуцируемой изомеризации [8], что позволяет рассматривать его в качестве потенциального фотофармакологического агента с управляемой биологической активностью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Соединения 1 и 2 были получены по разработанной нами ранее методике [8].
[1,3,3-триметил-5-хлорспиро(индолин-2,2'-бензо[f]хромен)-6'-ил]5-(дитиолан-3-ил)пентаноат 2. В круглодонную колбу поместили 0.378 г спиропирана 4 (1 ммоль), 0.206 г АЛК 5 (1 ммоль), 0.206 г N,N'-дициклогексилкарбодиимина (DCC) (1 ммоль), 0.007 г 4‑диметиламинопиридина (DMAP) и добавили 20 мл дихлорметана. Полученный раствор перемешивали в атмосфере аргона в течение 24 ч при комнатной температуре. Затем смесь обработали водой и отделили органическую фазу. Растворитель отогнали на водяной бане, полученный продукт очищали колоночной хроматографией (носитель – силикагель, элюент – хлороформ). Выход 0.170 г (30%). Тпл = 153–155°С. ИК (KBr, ν, см–1): 1756 (C=O); 1625, 1645 (C=C); 1263 (C–N); 946, 1023 (Cspiro-O). 1Н ЯМР (CDCl3, δ, м. д., J/Гц): 1.19 (3H, с, 3-СН3), 1.29 (3H, с, 3-СН3), 1.52–1.67 (2H, м, 18'-H), 1.73–1.80 (2H, м, 19'-H), 1.80–1.89 (2H, м, 17'-H), 1.94 (1H, дк, J 13.7, 6.9, 21'-H), 2.48 (1H, тд, J1 12.4, J2 6.6, 21'-H), 2.64 (2H, т, J 7.4, 16'-H), 2.69 (3H, с, N–CH3), 3.13 (1H, дт, J1 11.0, J2 6.9, 22'-H), 3.16–3.22 (1H, м, 22'-H), 3.56–3.67 (1H, м, 20'-H), 5.74 (1H, д, J 10.4, 3'-H), 6.41 (1H, д, J 8.2, 7-H), 6.93 (1H, д, J 8.9, 10'-H), 7.02 (1H, д, J 2.1, 4-H), 7.05 (1H, дд, J1 8.7, J2 2.2, 7'-H), 7.11 (дд, J1 8.2, J2 2.1, 6-H), 7.47 (1H, д, J 10.5, 4'-H), 7.60 (1H, д, J 8.9, 9'-H), 7.69 (1H, д, J 2.1, 5'-H), 7.72 (1H, д, J 8.8, 8'-H). 13С ЯМР (CDCl3, δ, м. д.): 20.00, 24.70, 25.54, 28.74, 28.93, 34.24, 34.61, 38.51, 40.25, 51.64, 56.34, 104.49, 107.61, 110.54, 112.12, 117.05, 117.18, 118.44, 122.07, 123.81, 125.09, 126.78, 127.25, 130.00, 130.05, 130.49, 138.63, 146.69, 149.57, 153.02, 172.14. ESI-MS: m/z 566.1589 [M + H]+; выч. для С31Н33ClNО3S$_{2}^{ + }$ 566.1585. Найдено (%): С, 65.67; Н, 5.73; Cl, 6.24; N, 2.44; S, 11.28. Выч. для С31Н32ClNО3S2 (%): С, 65.76; Н, 5.70; Cl, 6.26; N, 2.47; S, 11.33.
Рентгеноструктурный анализ. Рентгеноструктурные исследования выполнены на автоматическом дифрактометре XCalibur (Agilent, США) с координатным CCD детектором EOS (Agilent Technologies UK Ltd, Yarnton, Oxfordshire, Великобритания). Сбор отражений, определение и уточнение параметров элементарных ячеек проведены с использованием специализированного программного пакета CrysAlis PRO v. 171.35.19 (Agilent Technologies UK Ltd, Yarnton, Oxfordshire, England, 2011). Рентгенодифракционные данные были получены с использованием MoKα (λ = = 0.71073 Å) излучения. Заполняемость экспериментального массива (2θ = 52.64°) составила 99.8%. Структуры решены прямыми методами. Полноматричное уточнение позиций и тепловых параметров неводородных атомов выполнялось изотропно, а затем анизотропно методом наименьших квадратов. Все вычисления проведены по комплексу программ SHELXTL [13]. Полный набор кристаллографических данных для соединений 1 и 2 представлен в табл. 1.
Молекулярный докинг. Структура белка-мишени получена из международной базы белков (PDB). В качестве наиболее подходящей для данного исследования была выбрана структура 2L86, расшифрованная с использованием данных ЯМР при физиологическом значении pH. Структура α-липоевой кислоты получена из базы данных Кембриджского кристаллографического центра данных (CCDC 1270583). Подготовка белка и лигандов к докингу проводилась на основе координат атомов, полученных по данным РСА, с использованием программного пакета Autodock Tools [14]. В процессе подготовки из структуры молекулы белка были удалены молекулы воды и добавлены атомы водорода. Область докинга включала всю поверхность белка ввиду его относительно небольшого размера. В случае АЛК процедура подготовки файла также включала в себя добавление атомов водорода, а в структурах 1 и 2 они были уточнены изначально. Подготовка структур проводилась с использованием DS ViewerPro 6.0 (Accelrys, Cambridge, United Kingdom, 2005). Для проведения докинга использовали ПО AutoDock Vina [15], визуализацию полученных результатов осуществляли при помощи программного пакета PyMOL2 (The PyMOL Molecular Graphics System, Version 2.0 Schrödinger, LLC). Двумерная диаграмма взаимодействий белок–лиганд получена с использованием программы LigPlot+ v.1.4.5 [16].
Список литературы
Klajn R. // Chem. Soc. Rev. 2014. V. 43. № 1. P. 148–184. https://doi.org/10.1039/C3CS60181A
Pugachev A.D., Mukhanov E.L., Ozhogin I.V., Kozlen-ko A.S., Metelitsa A.V., Lukyanov B.S. // Chem. Heterocycl. Compd. 2021. V. 57. № 2. P. 122–130. https://doi.org/10.1007/s10593-021-02881-y
Razavi B., Abdollahi A., Roghani-Mamaqani H., Salami-Kalajahi M. // Polymer. 2020. V. 187. Article № 122046. https://doi.org/10.1016/j.polymer.2019.122046
Jiang M., Gao X., Zhao N., Cheng X., Yuan W. // Materials Letters. 2021. V. 284. Article № 129008. https://doi.org/10.1016/j.matlet.2020.129008
Liu Q., Zhao Y., Zhang Y., Xie K., Liu R., Ren B., Yan Y., Li L. // Analyst. V. 145. № 24. P. 8016–8021. https://doi.org/10.1039/d0an01298j
Chai X., Han H.H., Sedgwick A.C., Li N., Zang Y., James T.D., Zhang J., Hu X.L., Yu Y., Li Y., Wang Y., Li J., He X.P., Tian H. // J. Am. Chem. Soc. 2020. V. 142. № 42. P. 18005–18013. https://doi.org/10.1021/jacs.0c05379
Hüll K., Morstein J., Trauner D. // Chem. Rev. 2018. V. 118. № 21. P. 10710–10747. https://doi.org/10.1021/acs.chemrev.8b00037
Ozhogin I.V., Zolotukhin P.V., Mukhanov E.L., Rostov-tseva I.A., Makarova N.I., Tkachev V.V., Beseda D.K., Metelitsa A.V., Lukyanov B.S. // Bioorg. Med. Chem. Lett. 2021. V. 31. Article № 127709. https://doi.org/10.1016/j.bmcl.2020.127709
Salehi B., Berkay Yılmaz Y., Antika G., Boyunegmez Tumer T., Fawzi Mahomoodally M., Lobine D., Akram M., Riaz M., Capanoglu E., Sharopov F., Martins N., Cho W.C., Sharifi-Rad J. // Biomolecules. 2019. V. 9. Article № 356. https://doi.org/10.3390/biom9080356
Ono K., Hirohata M., Yamada M. // Biochem. Biophys. Res. Commun. 2006. V. 341. № 4. P. 1046–1052. https://doi.org/10.1016/j.bbrc.2006.01.063
Azzam S.K., Jang H., Choi M.C., Alsafar H., Lukman S., Lee S. // Mol. Pharmaceutics. 2018. V. 15. № 6. P. 2098–2106. https://doi.org/10.1021/acs.molpharmaceut.7b01009
Jeong H.R., An S.S. // Clin. interv. aging. 2015. V. 10. P. 1873–1879. https://doi.org/10.2147/CIA.S95297
Sheldrick G.M. // SHELXTL. Bruker AXS Inc., Madison, Wisconsin, USA, 2000.
Morris G.M., Huey R., Lindstrom W., Sanner M.F., Belew R.K., Goodsell D.S., Olson A.J. // J. Comput. Chem. 2009. V. 30. P. 2785–2791. https://doi.org/10.1002/jcc.21256
Trott O., Olson A.J. // J. Comput. Chem. 2010. V. 31. P. 455–461. https://doi.org/10.1002/jcc.21334
Laskowski R.A., Swindells M.B. // J. Chem. Inf. Model. 2011. V. 51. P. 2778–2786. https://doi.org/10.1021/ci200227u
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах