Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 498, № 1, стр. 51-54
Фазовая диаграмма системы TiO2–B2O3–P2O5
М. Н. Смирнова 1, *, М. А. Копьева 1, Г. Д. Нипан 1, Г. Е. Никифорова 1
1 Институт общей и неорганической химии
им. Н.С. Курнакова Российской академии наук
119991 Москва, Россия
* E-mail: smirnova_macha1989@mail.ru
Поступила в редакцию 07.04.2021
После доработки 04.05.2021
Принята к публикации 09.06.2021
Аннотация
Впервые экспериментально определены границы твердого раствора со структурой анатаза, полученного замещением титана на бор и фосфор. Образцы номинального состава Ti1 – x(BP)x/2O2, синтезированные методом сжигания геля, исследованы методом рентгенофазового анализа и инфракрасной спектроскопии. На основании полученных данных построена диаграмма системы TiO2–B2O3–P2O5, описывающая фазовые равновесия между твердым раствором со структурой анатаза, Ti5P4O20, TiP2O7 и BPO4.
В настоящее время широко применяется способ обеззараживания воды, основанный на разложении органических соединений под воздействием видимого или ультрафиолетового излучения в присутствии катализаторов на основе допированного TiO2. Такой способ влечет за собой необходимость предотвращать попадание токсичных неорганических веществ из катализатора в воду. Использование в качестве добавок простых оксидов бора и фосфора значительно снижает степень загрязнения воды токсичными веществами, но не приводит к эффективному фотокатализу в видимой области излучения, по сравнению с активностью чистого TiO2 при ультрафиолетовом излучении [1]. Однако теоретический анализ показывает, что проблема может быть решена при двойном замещении Ti4+ в анатазе на B3+ и P5+ [2]. Эффективность такого подхода фрагментарно рассмотрена в работах X. Zhou и соавт. [3] и M.H. Basha и соавт. [4], но количественно возможность замещения не исследована. В результате анодного оксидирования титана в органическом электролите, содержащем триэтилборат (C2H5O)3B и трибутилфосфат (C4H9O)3PO, после отжига при 450°C были получены нанотрубки TiO2, допированные 2.57 ат. % бора и 2.87 ат. % фосфора (согласно данным рентгеновской фотоэлектронной спектроскопии, РФЭС) [3]. Золь–гель методом при использовании смеси (C3H7O)4Ti, H3BO3 и H3PO4 после отжига ксерогеля при 400, 500, 600 и 700°C получены образцы анатаза, содержащие B и P, согласно данным РФЭС, для которых улучшилась фотокаталитическая активность в видимой части спектра, по сравнению с чистым TiO2 [4]. Одинарное замещение на бор в результате золь-гель синтеза с использованием Ti(C4H9O)4 и H3BO3 позволило получить однофазный анатаз при исходном соотношении B : Ti = 0.1, сохранявший гомогенность в интервале температур 400–500°C [5]. В интервале 600–700°C выделялся B2O3, а при 800°C вместо примеси B2O3 образовывалась высокотемпературная модификация TiO2–рутил [5]. Твердофазный синтез (добавка 5 мол. % B2O3 к TiO2) при 1200°C приводил к образованию гомогенного рутила [6]. В работе [7] сообщается о получении анатаза золь–гель методом в широком интервале исходных соотношений (B : Ti = 0.1–0.8, отжиг при 600°C, образование рутила при 650°C), но РФЭС-анализ образца B : Ti = 0.6 показал, что реальное содержание бора составило 3.48 ат. %. При гомогенном допировании оксида титана 3 вес. % бора (золь-гель синтез, отжиг при 500°C) обнаружен концентрационный градиент: в объеме анатаза соотношение B : Ti = 0.068 (согласно данным масс-спектрометрии с индуктивно-связанной плазмой, ИСП-МС), а на поверхности – 0.469 (согласно данным РФЭС-анализа) [8]. В не однофазном образце, содержащем B2O3/H3BO3 (12 вес. % B), соотношения B : Ti для анатаза составили 0.273 (согласно данным ИСП-МС) и 0.693 (согласно данным РФЭС-анализа) [8]. Соотношение B : Ti = 0.6 соответствовало исходному (согласно данным энергодисперсионной рентгеновской спектроскопии, ЭДРС) для гомогенного образца 8 вес. % B–TiO2, полученного золь-гель гидротермальным методом и отожженного при 500°C [9]. При соосаждении с помощью NH4OH из раствора Ti(C4H9O)4 и H3BO3 и последующем отжиге осадка при 500°C образовывалась смесь анатаза и рутила, содержащая до 15 вес. % бора [10].
Замещение титана на фосфор в TiO2 осложняется образованием на воздухе соединений TiP2O7 и (TiO)2P2O7 [или Ti2O(PO4)2], а при низком парциальном давлении кислорода или в атмосфере галогена – Ti5O4(PO4)4, Ti31O24(PO4)24, Ti4O3(PO4)3 и TiPO4. В результате золь-гель синтеза с Ti(C4H9O)4 и H3PO4 после отжига при 900°C анатаз оставался однофазным для исходного соотношения P : Ti = 0.1 (согласно данным ИСП-МС соотношение P : Ti равно 0.1061, инфракрасной спектроскопии с преобразованием Фурье – 0.0938, РФЭС – 0.1992) и переходил в рутил при 1000°C [11]. Более низкие температуры (600°C) позволяли сохранять гомогенность до P : Ti = 0.3 [12]. Однофазный анатаз с соотношением P : Ti = = 0.1 (прекурсоры Ti(C4H9O)4 и H3PO4) кристаллизовался в результате гидротермального синтеза при 200°C [13]. Введение фосфора в TiO2 позволило повысить температуру полиморфного перехода анатаз–рутил на сотни градусов.
В настоящей работе определено предельное замещение титана на бор и фосфор в TiO2 при сохранении структуры анатаза и построена изобарно-изотермическая диаграмма фазовых равновесий системы TiO2–B2O3–P2O5.
Для получения образцов состава Ti1 – x(BP)x/2O2 (0 ≤ x ≤ 1) применяли метод сжигания геля. В качестве исходных реагентов использовали тетрабутоксититан (C4H9O)4Ti, борную кислоту Н3ВО3 и дигидроортофосфат аммония NH4H2РO4. Рассчитанное количество (C4H9O)4Ti прикапывали к водному раствору смеси Н3ВО3 и NH4H2PO4 и добавляли 2 мл разбавленной азотной кислоты. Полученный раствор приливали к горячему раствору поливинилового спирта. Раствор упаривали досуха, образовавшийся порошок переносили в керамический тигель, отжигали при 620°C в течение 3 ч и затем охлаждали на воздухе до комнатной температуры.
Рентгенофазовый анализ (РФА) порошков выполняли на дифрактометре Bruker Advance D8 (Германия), излучение Cu-Kα, интервал углов 2θ = 10°–70° с шагом сканирования 0.0133°. Обработка результатов проводилась с помощью программного пакета DIFFRAC.EVA.
ИК-исследование образцов в диапазоне волновых чисел 400–4000 см–1 с шагом сканирования 1 см–1 проводили на спектрометре ИНФРАЛЮМ-ФТ2 (ООО “Люмэкс-маркетинг”, Россия).
Дифрактограммы образцов Ti1 – x(BP)x/2O2 (0 ≤ ≤ x ≤ 1) представлены на рис. 1. Синтезированный TiO2 имеет структуру анатаза (А), однако в нем присутствует примесь рутила (R) в небольшом количестве (около 7%). При эквимолярном замещении Ti на B и P ограниченный твердый раствор со структурой анатаза распространяется до состава Ti0.8B0.1P0.1O2, при этом примесь рутила исчезает (рис. 1, кривая 2). Рефлекс около 28° для состава Ti0.9B0.05P0.05O2 (рис. 1, кривая 1), вероятно, относится к образующемуся сассолину (H3BO3). В интервале составов Ti0.7B0.15P0.15O2–Ti0.5B0.25P0.25O2, наряду с анатазом, образуется Ti5P4O20 (рис. 1, кривые 3–6), а для Ti0.4B0.3P0.3O2 появляется примесь BPO4 (рис. 1, кривая 6). В результате дальнейшего замещения – Ti0.3B0.35P0.35O2–Ti0.1B0.45P0.5O2 – исчезает анатаз, вместо Ti5P4O20 образуется TiP2O7 и увеличивается содержание тетрагональной фазы BPO4 (рис. 1, кривые 7–9), которая, как показали эксперименты, не растворяет TiO2 в заметных количествах. При добавлении B2O3 к смеси TiP2O7 с Ti5P4O20 увеличилось содержание фазы Ti5P4O20, что свидетельствует об ограниченной растворимости в ней B2O3.
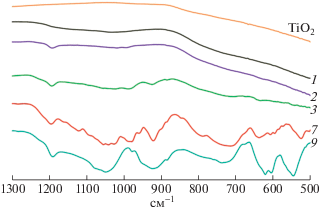
Спектры отдельных образцов в информативной ИК-области пропускания 500–1300 см–1 приведены на рис. 2. На спектрах TiO2 и Ti0.9B0.05P0.05O2 отсутствуют заметные пики (рис. 2, спектр 1). Для Ti0.8B0.1P0.1O2 (рис. 2, спектр 2) при 1190 и 880 см–1 появляются пики валентных колебаний B–O в твердофазных B2O3 [5] и H3BO3 [9] соответственно, сохраняющиеся на спектрах 3, 7 и 9, а также пики асимметричных и симметричных валентных колебаний группы PO4 при 1010 и 990 см–1 [14]. Начиная с Ti0.7B0.15P0.15O2 (рис. 2, спектр 3), на спектрах присутствует пик асимметричных валентных колебаний связи P–O–P при 925 см–1 [11]. В случае Ti0.3B0.35P0.35O2 (рис. 2, спектр 7) асимметричные и симметричные валентные колебания PO4 представлены наборами пиков в интервалах 1020–1160 и 950–1000 см–1 соответственно, а асимметричным деформационным колебаниям PO4 соответствуют пики в интервале 525–635 см–1 [14]. Кроме того, пик при 1040 см–1 и набор пиков в интервале 700–850 см–1 отвечают колебаниям связи P–O [11] и непрерывных цепей –Ti–O– в матрице Ti–O–P [11, 14] соответственно. На спектре Ti0.1B0.45P0.45O2 (рис. 2, спектр 9) пики, соответствующие –Ti–O–, исчезают и проявляются пики, характерные для кристаллического BPO4 (545, 605, 620, 940 и 1080 см–1) [15, 16].
Рис. 2.
ИК-спектры образцов Ti1 – x(BP)x/2O2: x = 0.0 (TiO2), 0.1 (1), 0.2 (2), 0.3 (3), 0.7 (7) и 0.9 (9).
На рис. 3 представлена диаграмма, построенная по данным РФА и ИК-спектрометрии и описывающая фазовые равновесия в тройной системе TiO2–B2O3–P2O5 при температуре 620°C и парциальном давлении кислорода 21 кПа. Образцы Ti0.9B0.05P0.05O2 и Ti0.8B0.1P0.1O2 находятся в области гомогенности ограниченного твердого раствора со структурой анатаза (область серого цвета на рис. 3). Заштрихованные области отвечают двухфазным равновесиям твердого раствора на основе анатаза TiO2(A) с расплавом на основе B2O3 [B2O3(L)] и TiO2(A) c кристаллическим Ti5P4O20. Четыре образца от Ti0.7B0.15P0.15O2 до Ti0.4B0.3P0.3O2 участвуют в трехфазном равновесии TiO2(A)–B2O3(L)–Ti5P4O20. Составы Ti0.3B0.35P0.35O2 и Ti0.2B0.4P0.4O2 оказываются в трехфазном равновесии Ti5P4O20–B2O3(L)–TiP2O7, а образец Ti0.1B0.45P0.45O2 – в трехфазном равновесии TiP2O7–B2O3(L)–BPO4. Существование равновесия TiP2O7–BPO4–P2O5(L) является следствием правила фаз.
Рис. 3.
Фазовая диаграмма системы TiO2–B2O3–P2O5 при температуре 620°C и парциальном давлении кислорода 21 кПа.

Таким образом, в рамках исследования методом сжигания геля с поливиниловым спиртом впервые получен гомогенный образец состава Ti0.8B0.1P0.1O2 со структурой анатаза, который является предельным с точки зрения двойного замещения титана на бор и фосфор.
Рентгенографические и ИК-спектральные исследования образцов Ti1 – x(BP)x/2O2 (0 ≤ х ≤ 1, шаг х = 0.1) позволили определить область гомогенности твердого раствора со структурой анатаза при температуре 620°C и парциальном давлении кислорода 21 кПа и построить диаграмму фазовых равновесий системы TiO2–B2O3–P2O5 с участием твердого раствора на основе TiO2, Ti5P4O20, TiP2O7 и BPO4.
Полученные результаты и разработанные подходы являются перспективными для дальнейшего развития научно-исследовательских и прикладных работ в области создания безопасных материалов для обеззараживания и очистки воды.
Список литературы
Valeeva A.A., Dorosheva I.B., Kozlova E.A., Kamalov R.V., Vokhmintsev A.S., Selishchev D.S., Saraev A.A., Gerasi-mov E.Yu., Weinstein I.A., Rempel A.A. // J. All. Compds. 2019. V. 796. P. 293–299. https://doi.org/10.1016/j.jallcom.2019.04.342
Li L., Meng F., Hu X., Qiao L., Sun C.Q., Tian H., Zheng W. // PLoS ONE. 2016. V. 11. № 4. e0152726. https://doi.org/10.1371/ journal.pone.0152726
Zhou X., Jin B., Zhang S., Wang H., Yu H., Peng F. // Electrochim. Commun. 2012. V. 19. P. 127–130. https://doi.org/10.1016/j.elecom.2012.03.020
Basha M.H., Gopal N.O., Nimbalkar D.B., Ke S.-C. // J. Mater. Sci: Mater. Electron. 2017. V. 28. № 1. P. 987–993. https://doi.org/10.1007/s10854-016-5618-7
Chen D., Yang D., Wang Q., Jiang Z. // Ind. Eng. Chem. Res. 2006. V. 45. № 12. P. 4110–4116. https://doi.org/10.1021/ie0600902
Kitagawa H., Kunisada T., Yamada Y., Kubo S. // J. All. Compds. 2010. V. 508 № 2. P. 582–586. https://doi.org/10.1016/j.jallcom.2010.08.125
Min Z., Ying D., Shijin Z., Wen C. // Rare Metals. 2011. V. 30. № 1. P. 243–248. https://doi.org/10.1007/s12598-011-0278-5
Quiñones D.H., Rey A., Álvarez P.M., Beltrán F.J., Li Puma G. // Appl. Catal. B: Environ. 2015. V. 178. P. 74–81. https://doi.org/10.1016/j.apcatb.2014.10.036
Bilgin Simsek E. // Appl. Catal. B: Environ. 2017. V. 200. P. 309–322. https://doi.org/10.1016/j.apcatb.2016.07.016
Niu P., Wu G., Chen P., Zheng H., Cao Q., Jiang H. // Front. Chem. 2020. V. 8. 172. https://doi.org/10.3389/fchem.2020.00172
Li F., Jiang Y., Xia M., Sun M., Xue B., Liu D., Zhang X. // J. Phys. Chem. C. 2009. V. 113. № 42. P. 18134–18141. https://doi.org/10.1021/jp902558z
Yu H.-F. // J. Phys. Chem. Solids. 2007. V. 68. № 4. P. 600–607. https://doi.org/10.1016/j.jpcs.2007.01.050
Guo S., Han S., Haifeng M., Zeng C., Sun Y., Chi B., Li J. // Mater. Res. Bull. 2013. V. 48. № 9. P. 3032–3036. https://doi.org/10.1016/j.materresbull.2013.04.056
Benmokhtar S., El jazouli A., Chaminade J.P., Grave-reau P., Ménétrier M., Bourée F. // J. Solid State Chem. 2007. V. 180. № 10. P. 2713–2722. https://doi.org/10.1016/j.jssc.2007.07.028
Chen S., Ye M., Chen H.-H., Yang X.-X., Zhao J.-T. // J. Inorg. Organomet. Polym. 2009. V. 19. № 2. P. 139–142. https://doi.org/10.1007/s10904-008-9245-5
Zhang C., Lin C., Li C., Quan Z., Liu X., Lin J. // J. Phys. Chem. C. 2008. V. 112. № 6. P. 2183–2192. https://doi.org/10.1021/jp710046x
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах



