Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 499, № 1, стр. 45-49
Новые подходы к синтезу фосфатов титана из кристаллических прекурсоров
М. В. Маслова 1, *, В. И. Иваненко 1, Л. Г. Герасимова 1, член-корреспондент РАН А. И. Николаев 1
1 Институт химии и технологии редких элементов
и минерального сырья им. И.В. Тананаева – обособленное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Кольский научный центр Российской академии наук” (ИХТРЭМС КНЦ РАН)
184209 Апатиты, Россия
* E-mail: m.maslova@ksc.ru
Поступила в редакцию 01.06.2021
После доработки 26.08.2021
Принята к публикации 30.08.2021
Аннотация
Впервые показана возможность синтеза фосфата титана из кристаллических титановых солей. Найдены оптимальные условия синтеза, при которых гетерогенное взаимодействие титансодержащих прекурсоров с фосфорной кислотой обеспечивает получение монофазного продукта состава Ti(HPO4)2 · H2O или TiO(OH)H2PO4 · 2H2O. Процесс продолжается 3–5 ч при стехиометрическом расходе компонентов и является более экологически и экономически привлекательным по сравнению с известными методами синтеза.
В последние время слоистые фосфаты привлекают внимание исследователей благодаря их возможному использованию в качестве сорбентов, катализаторов, биосенсоров, ионных проводников и электродных материалов [1–3]. Среди семейства слоистых фосфатных материалов фосфаты титана (ФТ) известны широким разнообразием композиции и кристаллических структур. Наиболее изученным является слоистый фосфат титана состава Ti(HPO4)2 · H2O (α-TiP) [4]. Внедрение органических молекул в его межслоевое пространство ведет к получению новых композиций, имеющих широкую область применения – от косметики до создания материалов с супер-ионной проводимостью [5]. Кроме того, замещение водорода фосфатных групп на катионы других металлов в кристаллической решетке α-TiP наделяет его уникальными свойствами, такими как нелинейные оптические, электрохимические свойства и антимикробная активность [6, 7]. Менее изученным является фосфат титана TiO(OH)H2PO4 · 2H2O (TiHP). Наличие H2PO$_{4}^{ - }$ сильнокислотных центров обеспечивает его успешную работу в качестве сорбента по отношению к тяжелым металлам в широкой области рН рабочих растворов, а также в качестве прекурсора при получении анодных материалов [8].
Большинство известных способов синтеза указанных ФТ основано на взаимодействии фосфорной кислоты с растворами титансодержащих прекурсоров (сульфаты или хлориды титана). Синтез таких материалов достаточно сложен, это длительный и многоступенчатый процесс, требующий жестких условий ведения процесса, большого расхода реагентов, высоких температур, использования автоклавного оборудования и органических темплатов, характеризуется низкими скоростями проведения практически всех операций, при которых образуется большой объем жидких стоков. Кроме того, как правило, одностадийным синтезом не удается получить чистую фазу и требуются дополнительные операции по разделению смеси фаз на монопродукты [1, 9]. Экономическая и экологическая нецелесообразность производства таких материалов известными методами требует поиска новых решений с привлечением более эффективных прекурсоров.
В рамках данной работы предложен новый подход к синтезу фосфатов титана из кристаллических титановых солей – сульфата титанила и аммония (NH4)2TiO(SO4)2 · Н2О (СТА) и сульфата титанила моногидрата – TiOSO4 · H2O (СТМ), которые являются полупродуктами переработки практически любого титанового сырья. Несмотря на то что растворы таких солей широко используются для синтеза ФТ, данных об использовании кристаллических титановых прекурсоров как в отечественной, так и зарубежной литературе не найдено.
Синтез ФТ осуществлялся путем гетерогенного взаимодействия кристаллических солей титана с раствором фосфорной кислоты концентрации 10–50% при мольном соотношении TiО2 : P2О5 = = 1 : 0.5–1.5. Процесс проводился при температуре 60°C в течение 3–5 ч. Полученные осадки отделялись фильтрованием, промывались водой для удаления маточного раствора и сушились при 60°С.
Для обоснования нового метода синтеза ФТ изучено влияние состава прекурсора, а также расхода и концентрации фосфорной кислоты на состав и структуру образующегося фосфата титана. Все составы конечных и промежуточных фаз подтверждены данными химического анализа, методами РФА, ТГ–ДТА, ЯМР- и ИК-спектроскопии.
При обработке СТА фосфорной кислотой получены поликомпонентные осадки, содержащие фазы состава TiO(NH4)[(NH4)2PO4](HPO4) · nH2O и TiOH(H2PO4)(HPO4) · nH2O (рис. 1а).
Рис. 1.
Спектры 31Р ЯМР: аммонийсодержащий ФТ, полученный при обработке СТА раствором 30%-й Н3РО4 (а); TiHP, полученный после промывки аммонийсодержащего ФТ 0.1 М HCl (б); α-TiP, полученный при обработке СТМ раствором 50%-й H3PO4 (б).

Обработка осадков раствором 0.1 М HCl сопровождалась протонированием гидрофосфатных и аммонийсодержащих групп. В результате протонирования дифосфатного соединения при его кислотной обработке получена чистая фаза аморфного TiO(OH)H2PO4 · nH2O. Найденная корреляция между условиями синтеза и составом конечных фаз позволила выбрать и научно обосновать оптимальные параметры синтеза (30%-я Н3РО4 при мольном расходе TiO2 : P2O5 = 1 : 1.5, время синтеза – 4 ч), обеспечивающие получение монофазного конечного продукта – TiO(OH)H2PO4 · 2H2O (TiHP) (рис. 1б). Эта же фаза выделяется при взаимодействии другого кристаллического прекурсора – СТМ с 10%-й H3PO4 за 5 ч от начала синтеза при стехиометрическом расходе компонентов (TiО2 : P2О5 = 1 : 0.5).
Согласно литературным данным, достаточно трудно получить чистую фазу α-фосфата титана при стехиометрическом расходе компонентов. Известна только одна работа, в которой при исходном мольном отношении TiO2 : P2O5 = 1 : 1.2 удалось получить полукристаллический α-TiP [10].
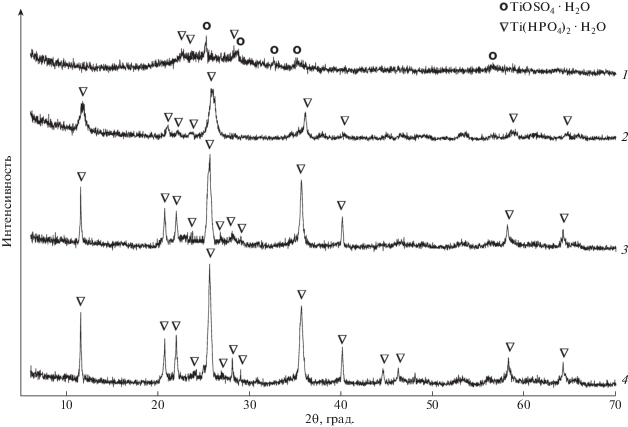
Настоящие исследования показали, что гетерогенное взаимодействие СТМ и 20–40%-й фосфорной кислоты при мольном расходе TiO2 : P2O5 = = 1 : 0.5–1.0 приводит к образованию смеси двух фаз – TiНР и α-TiP. Чем более концентрированная фосфорная кислота использовалась в синтезе, тем выше была доля α-TiP в составе конечного продукта. При концентрации H3PO4 50% и стехиометрическом расходе TiO2 : P2O5 = 1 : 1 через 3 ч гетерогенного взаимодействия на РФА-спектре зарегистрированы пики, соответствующие только кристаллической фазе α-TiP (рис. 1б; рис. 2, кривая 4), что указывает на чистоту конечного продукта.
Рис. 2.
Спектры РФА продукта взаимодействия СТМ с 50%-й H3PO4 при различном времени синтеза: 0.5 ч (спектр 1), 1 ч (спектр 2), 2 ч (спектр 3) и 3 ч (спектр 4).
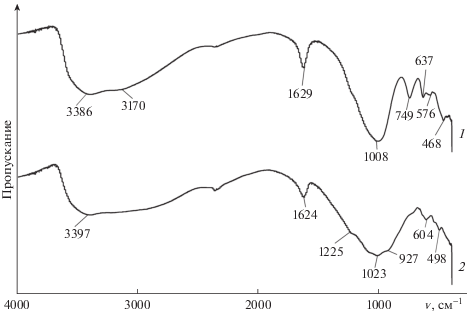
На рис. 3 приведены ИК-спектры образцов аморфного TiHP и кристаллического α-TiP. Полоса поглощения в области 3400 см–1 соответствует валентным колебаниям O–H-связей, а в области 1630 см–1 – деформационным колебаниям молекул воды и гидроксильных групп. О наличии более развитой системы водородных связей в образце TiHP, по сравнению с α-фосфатом титана, свидетельствует появление полосы 637 см–1 (спектр 1), которую можно отнести к либрационным колебаниям связи Ti–OH2, обусловленным ограничением в подвижности аквалиганда за счет посторонних межатомных взаимодействий, приводящих к образованию водородных связей.
Широкая полоса в области 900–1300 см–1 (спектр 2) относится к валентным колебаниям связи P–O тетраэдра [PO4] [11]. Слабая связь HPO4-иона с титаном (IV) из-за повышенного отрицательного заряда атомов кислорода во внутренней координационной сфере титана (IV) и водородно-мостиковый характер связывания существенно не изменяют симметрию тетраэдра [PO4]. На спектрах TiHP наблюдается одна широкая полоса поглощения. В отличие от аморфного TiHP, для кристаллического α-TiP наблюдается расщепление полос, что указывает на снижение симметрии [PO4]-групп и вызвано заменой связи Ti–OPO(OH)2 на связь Ti=O2PO(OH). Это, как видно на спектре, приводит к уменьшению длины P–O-связи и, таким образом, к сдвигу колебаний в высокочастотную область. Такая же тенденция наблюдается для деформационных колебаний связей P–O в диапазоне 400–600 см–1. Для образца TiHP полоса 749 см–1 отнесена к валентному колебанию Ti–OH-групп [12]. Результаты ИК-спектроскопии подтвердили выводы о составе полученных фосфатов титана.
На основании результатов исследований предложен механизм формирования фосфатов титана при гетерогенном взаимодействии СТА и СТМ с фосфорной кислотой различной концентрации.
Поскольку СТА обладает высокой растворимостью в водных средах, механизм формирования ФТ основан на процессах растворения СТА/осаждения ФТ. Растворение СТА сопровождается переходом титанил-иона, сульфатных групп и аммонийного иона в раствор. При этом титанил-ион подвергается частичному гидролизу в соответствии с реакцией:
(1)
${\text{Ti}}{{{\text{O}}}^{{2 + }}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow {\text{TiO(OH}}{{{\text{)}}}^{ + }} + {{{\text{H}}}^{ + }}.$Взаимодействие TiO(OH)+ с фосфат-ионами протекает по реакции:
(2)
${\text{TiO(OH}}{{{\text{)}}}^{ + }} + {{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{ - } \to {\text{TiO(OH)}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{4}}.$При взаимодействии TiO2+ с H2PO$_{4}^{ - }$ сильная поляризация последнего в поле иона титана (IV) приводит к его депротонированию с образованием бидентатного лиганда HPO$_{4}^{{2 - }}$. Перераспределение электронной плотности между ионами октаэдрической внутренней координационной сферы титана (IV) вызывает удлинение Ti–O-связи. У атома кислорода титанильной группы появляется более высокий эффективный отрицательный заряд и, следовательно, повышенная активность к межмолекулярному взаимодействию, особенно с ионами водорода или аммония, с образованием Ti–O–H- или Ti–O–NH4-связей. При этом значительная концентрация ионов аммония в растворе обусловливает наличие в твердой фазе NH$_{4}^{ + }$-замещенных фосфатных групп. Таким образом, образующиеся дифосфатные соединения титана, полученные гетерогенным взаимодействием СТА и фосфорной кислоты, имеют вид TiO(NH4)[(NH4)2PO4](HPO4) · nH2O. Результатом протонирования такого дифосфатного соединения титана при кислотной промывке раствором 0.1 M HCl следует ожидать образование соединения состава TiOH(H2PO4)(HPO4) · nH2O и последующую его трансформацию по схеме:
(3)
$\begin{gathered} {\text{TiOH(}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}}{\text{)(HP}}{{{\text{O}}}_{{\text{4}}}}{\text{)}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to \\ \to {\text{TiO(OH)}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {{{\text{Н}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}}. \\ \end{gathered} $Учитывая ограниченную растворимость кристаллического СТМ в водных средах, процесс его взаимодействия с раствором фосфорной кислоты может включать образование фосфата титана как непосредственно на поверхности кристаллической твердой фазы, так и в растворе при частичном растворении СТМ. Процесс начинается с разрыва связи между титанил-ионом и сульфатной группой. Как и в случае с использованием СТА, отсутствие высокой концентрации ионов водорода в реакционной смеси обусловливает частичный гидролиз титанил-ионов как на поверхности твердой фазы, так и в растворе.
В 10%-й H3PO4 равновесие (1) в системе сдвинуто вправо, что ведет к образованию TiHP в соответствии с реакцией (2).
Чем более концентрированная кислота используется для синтеза, тем меньше TiO(OH)+ образуется в реакционной системе, и равновесие реакции (1) сдвигается в сторону негидролизованного TiO2+. Взаимодействие титанил-иона с H2PO$_{4}^{ - }$ ведет к образованию Ti(HPO4)2 · H2O через TiO(H2PO4)2 с последующим протонированием оксолиганда титанильной группы и депротонированием дигидрофосфатных групп:
(4)
$\begin{gathered} {\text{Ti}}{{{\text{O}}}^{{2 + }}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{ - } \to {\text{TiO}}{{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{2}} \to \\ \to {\text{Ti}}{{\left( {{\text{HP}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{2}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $Протонированию способствует перераспределение электронной плотности во внутренней координационной сфере образующегося промежуточного комплексного соединения TiO(H2PO4)2 · Н2О, когда H2PO4-лиганды, входя во внутреннюю координационную сферу, ослабляют связь Ti=O титанильной группы и увеличивают отрицательный заряд оксо-лиганда, делая последний более способным к межмолекулярному взаимодействию. Значительная концентрация ионов водорода в растворе приводит к протонированию кислорода с переводом оксо-лиганда в аква-лиганд. При этом атом титана становится более электронодифицитным и поляризует находящиеся во внутренней координационной сфере ацидо-лиганды, ослабляя их связь с протонами. Это в свою очередь приводит к депротонированию монодентатных H2PO4-лигандов и образованию бидентатных HPO4-лигандов.
Таким образом, разработан новый метод синтеза монофазных фосфатов титана различного состава из кристаллических титансодержащих прекурсоров. По сравнению с известными методами синтеза ФТ предложенный способ экологически привлекателен, протекает в течение 3–5 ч и позволяет получать фосфат титана заданного структурного типа в одну стадию при стехиометрическом расходе компонентов. Новый метод отвечает всем требованиям “зеленой технологии” и открывает большие возможности получения фосфатов титана для различных практических применений. Предложенные способы синтеза защищены патентами РФ [13, 14] и прошли испытания в укрупненном масштабе.
Список литературы
Kapnisti M., Noli F., Misaelides P., Vourlias G., Karfaridis D., Hatzidimitriou A. // Chem. Eng. J. 2018. V. 342. P. 184–195. https://doi.org/10.1016/j.cej.2018.02.066
Dasireddy V.D.B.C., Hanzel D., Bharuth-Ram K., Likozar B. // RSC Adv. 2019. V. 9 (53). P. 30989–31003. https://doi.org/10.1039/C9RA02327E
Nakano K., Noda Y., Tanibata N., Nakayama M., Kajihara K., Kanamura K. // RSC Adv. 2019. V. 9 (22). P. 12590–12595. https://doi.org/10.1039/C9RA00513G
Alberti G. // Accounts Chem. Res. 1978. V. 11 (4). P. 163–170. https://doi.org/10.1021/ar50124a007
Guo S., Han S. // J. Power Sources 2014. V. 267. P. 9–15. https://doi.org/10.1016/j.jpowsour.2014.05.011
Zhu Y., Hasegawa G., Kanamori K., Kiyomura T., Kurata H., Hayashi K., Nakanishi K. // CrystEngComm. 2017. V. 19 (31). P. 4551–4560. https://doi.org/10.1039/c7ce01123g
Rajini A., Adepu A.K., Chirra S., Venkatathri N. // RSC Adv. 2015. V. 5 (106). V. 87713–87722. https://doi.org/10.1039/C5RA15084A
Maslova M., Ivanenko V., Gerasimova L., Larsson A.-C., Antzutkin O.N. // J. Mater. Sci. 2021. V. 56 (16). P. 9929–9950. https://doi.org/10.1007/s10853-021-05876-4
Hazra Chowdhury A., Hazra Chowdhury I., Biswas S., Chakrabortty P., Islam S.M. // New J. Chem. 2020. V. 44 (38). P. 16452–16460. https://doi.org/10.1039/D0NJ03182H
Trublet M., Rusanova D., Antzutkin O.N. // New J. Chem. 2018. V. 42 (2). P. 838–845. https://doi.org/10.1039/c7nj03065g
Stanghellini P.L., Boccaleri E., Diana E., Alberti G., Vivani R. // Inorg. Chem. 2004. V. 43. P. 5698–5703. https://doi.org/10.1021/ic049565c
Takahashi H., Oi T., Hosoe M. // J. Mater. Chem. 2002. V.12 (8). P. 2513–2518. https://doi.org/10.1039/b203266j
Герасимова Л.Г., Николаев А.И., Маслова М.В., Щукина Е.С. / Патент РФ № 2595657. 2016.
Маслова М.В., Герасимова Л.Г., Щукина Е.С., Рыжук Н.Л. / Патент РФ № 2647304. 2018.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах