Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 500, № 1, стр. 29-34
LaCo1/3Sb5/3O6 – новый оксидный катализатор окисления СО
С. В. Голодухина 1, *, Л. С. Разворотнева 1, 2, А. В. Егорышева 1, О. Г. Эллерт 1, член-корреспондент РАН В. К. Иванов 1
1 Институт общей и неорганической химии
им. Н.С. Курнакова Российской академии наук
119991 Москва, Россия
2 Национальный исследовательский университет “Высшая школа экономики”
101000 Москва, Россия
* E-mail: brightorangedandelion@gmail.com
Поступила в редакцию 15.07.2021
После доработки 24.08.2021
Принята к публикации 03.09.2021
Аннотация
Разработана методика синтеза слоистого оксида LaCo1/3Sb5/3O6 со структурой розиаита, основанная на применении метода гидротермальной обработки соосажденных осадков с последующим их отжигом. Исследование каталитических свойств этого материала показало его эффективность при окислении СО. Полученные данные подтверждают перспективность использования соединений со структурой розиаита в реакциях окислительного катализа.
Вопросу экологической безопасности в современном мире уделяется особое внимание. Основными техногенными источниками загрязнения атмосферы являются транспорт и предприятия энергетики. Монооксид углерода – один из главных побочных продуктов, образующихся при сжигании любых видов топлива [1]. Высокая токсичность СО является серьезной мотивацией для поиска способов его окисления до углекислого газа. Скорость реакции окисления СО кислородом при невысоких температурах в отсутствие катализатора незначительна, поскольку определяется скоростью диссоциации молекул O2 на атомы, которые быстро реагируют с молекулами СО с образованием CO2 [2, 3]. Температура, необходимая для инициирования диссоциации кислорода, превышает 700°С, поэтому реакцию окисления CO проводят в присутствии катализаторов. Согласно [1], наибольшую эффективность в реакции окисления СО проявляют катализаторы, содержащие платиноиды (Pd, Pt).
В последнее время сложные оксиды d- и f-элементов со структурами перовскита, шпинели и пирохлора рассматриваются в качестве более экономичной замены Pt и Pd катализаторов [4–6]. Их высокая каталитическая активность определяется их способностью к редокс-превращениям, высокой подвижностью кислорода за счет большого количества кислородных вакансий в кристаллической решетке и химической устойчивостью в широком интервале температур, а высокая изоморфная емкость структур позволяет адаптировать их свойства для применения в различных каталитических процессах.
Подобными свойствами обладают и слоистые оксиды со структурой типа розиаита, относящейся к пространственной группе P-31m. Данные соединения практически не изучены. Однако недавно нами было показано, что соединения LnFe0.5Sb1.5O6 (Ln = La–Sm) со структурой розиаита являются эффективными катализаторами в реакции окисления СO [7, 8], по своей активности превосходящими близкие по составу соединения со структурой перовскита и пирохлора [9, 10]. Установлено, что в процессе реакции на их поверхности происходят окислительно-восстановительные процессы с участием катионов Sb3+ ↔ Sb5+ и Fe3+ ↔ Fe2+, а также решеточного кислорода и кислородных вакансий. Вероятной причиной высокой каталитической активности розиаитов является их слоистая квази‑2D структура [7]. Структура розиаита построена из отрицательно заряженных слоев связанных по ребру октаэдров (Fe/Sb)O6. Катионы Ln3+ находятся в межслоевом пространстве. Подобное пространственное разделение заряда повышает вероятность образования и взаимодействия реакционных фрагментов – радикалов и ионов – на поверхности частиц. Это обстоятельство указывает на перспективность дальнейшего исследования каталитических свойств соединений данного структурного типа. Интерес представляют кобальтсодержащие розиаиты, поскольку сложные оксиды кобальта демонстрируют высокую активность в реакциях окислительного катализа [10, 11]. Однако исследование каталитических свойств сложных антимонатов кобальта со структурой розиаита ранее не проводили. Более того, синтез и свойства единственного известного антимоната кобальта LaCo1/3Sb5/3O6 со структурой розиаита также не описаны.
Настоящее исследование посвящено изучению каталитических свойств слоистого соединения LaCo1/3Sb5/3O6 со структурой розиаита в реакции окисления СО в зависимости от условий синтеза. Для этого разработаны различные способы получения LaCo1/3Sb5/3O6 методами твердофазной реакции, термического разложения нитратов, цитратным способом, а также соосаждения с последующей гидротермальной обработкой осадков и отжигом. Проведен сравнительный анализ каталитической активности полученных соединений с образцом антимоната железа LaFe0.5Sb1.5O6, ранее продемонстрировавшим наибольшую активность среди розиаитов в реакции окисления СО [7, 8].
ЭКСПЕРИМЕНТ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Синтез образцов. Синтез антимонатов редкоземельных элементов (РЗЭ) твердофазным методом из оксидов имеет ряд особенностей. Из-за высокой летучести оксида сурьмы невозможно проводить синтез при высоких температурах, необходимых для обеспечения достаточной реакционной способности оксидов РЗЭ. Поэтому синтез LaCo1/3Sb5/3O6 проводили из шихты с 10%-м избытком Sb2O3 путем ступенчатого отжига при температурах 650, 900, 1050 и 1200°С (табл. 1). Выбор температур определялся термодинамическими свойствами оксида сурьмы, а также необходимостью образования промежуточных соединений нелетучих при высокой температуре. Было установлено, что метод твердофазного синтеза не позволяет получить однофазный образец даже при температуре отжига 1200°С (рис. 1). Поскольку неоднофазность образцов могла быть вызвана кинетическими затруднениями протекания реакции между твердыми прекурсорами, в качестве исходных соединений также были использованы нитраты соответствующих элементов (табл. 1). Содержание примесей в образцах оказалось ниже, чем при синтезе из оксидов, но получить однофазный образец этим методом также не удалось (рис. 1). Проведение синтеза цитратным методом (табл. 1) позволило получить образец, на дифрактограмме которого отсутствовали рефлексы посторонних фаз (рис. 1). Однако, учитывая, что использование цитратного метода может привести к загрязнению поверхности образцов продуктами сгорания органических прекурсоров и, тем самым, снизить каталитическую активность материала, в качестве базового был выбран метод соосаждения с последующим отжигом.
Таблица 1.
Сравнение каталитической активности сложных оксидов LaCo1/3Sb5/3O6 и LaFe0.5Sb1.5O6, синтезированных различными методами
| Метод синтеза | LaCo1/3Sb5/3O6 | LaFe0.5Sb1.5O6 | ||||
|---|---|---|---|---|---|---|
| Sуд, м2 г–1 | Т50, °С | Т90, °С | Sуд, м2 г–1 | Т50, °С | Т90, °С | |
| Твердофазный из оксидов: ступенчатый отжиг смеси оксидов La2O3, Co3O4 и Sb2O3 при 650°С – 24 ч, 900°С – 24 ч, 1050°С – 48 ч, 1200°С – 24 ч |
– | – | – | – | – | – |
| Разложение нитратов: ступенчатый отжиг смеси La(NO3)3 · 6H2O, Co(NO3)3 · 6H2O и Sb2O3 при 650°С – 24 ч, 900°С – 24 ч, 1050°С – 48 ч |
1.4 | – | – | 0.9 | – | – |
| Цитратный: полимеризация смеси нитратов La, Co и оксида Sb2O3 с лимонной кислотой и этиленгликолем при 80°С, отжиг при 450°С – 6 ч, 650°С – 24 ч, 900°С – 24 ч, 1050°С – 48 ч |
1.6 | 295 | 334 | 1.3 | 333 | 372 |
| Соосаждение с последующей гидротермальной обработкой и отжигом: соосаждение щелочью (NaOH) из водных растворов La(NO3)3 · 6H2O и Co(NO3)2 · 6H2O, отмывание до нейтрального pH, суспендирование смеси осадков и Sb2O3 в дистиллированной воде, выдерживание в гидротермальных условиях при 200°С в течение 24 ч и отжиг при 1050°С – 24 ч |
3.2 | 254 | 263 | 1.8 | 245 | 263 |
Рис. 1.
Дифрактограммы образцов LaCo1/3Sb5/3O6, синтезированных различными методами с конечным отжигом при 1050°С: твердофазный метод (кривая 1), разложение нитратов (кривая 2), цитратный метод (кривая 3), соосаждение с последующей гидротермальной обработкой и отжигом (кривая 4). Звездочкой обозначены рефлексы примесных фаз.

Сложность разработки метода состояла в том, что из-за растворимости гидроксида кобальта в растворе аммиака, а гидроксида сурьмы в щелочных растворах, совместное осаждение гидроксидов лантана, кобальта и сурьмы невозможно. Было рассмотрено несколько вариантов раздельного получения осадков с их последующим смешением и гомогенизацией, однако ни один из них не позволил получить однофазные образцы. Вероятно, необходимость раздельного промывания осадков от щелочи и аммиака приводила к потере части вещества, что, в свою очередь, могло вызвать отклонение состава от стехиометрического и образование примесных фаз.
Решить задачу получения однофазного образца удалось только с использованием гидротермальной обработки осадков (рис. 1). Смесь свежеосажденных осадков, полученных методом обратного соосаждения в концентрированном растворе NaOH (0.9 М) из водных растворов смеси нитратов Co и La (0.1 и 0.033 М соответственно), отмывали до нейтрального pH. К промытому осадку добавляли Sb2O3, полученную смесь суспендировали в дистиллированной воде и помещали в автоклав. Для успешного проведения синтеза и получения впоследствии однофазного образца, продолжительность гидротермальной обработки смеси составила не менее 24 ч при температуре 200°С. После выдерживания смеси в гидротермальных условиях в течение 24 ч наблюдалось образование промежуточных кристаллических фаз, идентифицировать которые не удалось. Вероятно, образование этих промежуточных фаз является ключевым при дальнейшем синтезе LaCo1/3Sb5/3O6. Последующий отжиг смеси приводил к получению однофазного образца. Применение данного метода позволило понизить температуру начала образования фазы LaCo1/3Sb5/3O6 с 900 до 650°С, по сравнению с твердофазным методом, и отказаться от использования избытка оксида сурьмы. Однако для получения однофазного образца требовался отжиг при 1050°С в течение 24 ч.
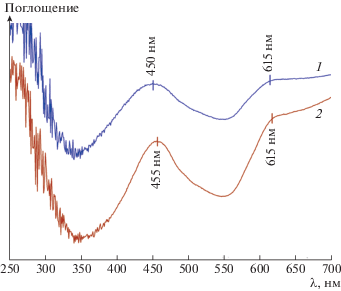
Элементный состав полученных однофазных образцов, синтезированных цитратным методом и соосаждением с гидротермальной обработкой, был установлен методом рентгеноспектрального микроанализа (табл. 2). Состав образцов близок к теоретическому, рассчитаному для LaCo1/3Sb5/3O6. Спектры диффузного отражения образцов LaCo1/3Sb5/3O6 (рис. 2) подтвердили присутствие кобальта в степени окисления 2+ в октаэдрическом окружении. В спектре присутствуют две широких полосы поглощения. Полоса поглощения при 450–455 нм обусловлена переходом 4T1g(t52e2) → → 4T1g(t42e3), а широкую полосу с максимумом при 615 нм можно отнести к переходу 4T1g(t52e2) → → 4A2g(t32e4) [11].
Таблица 2.
Массовые доли элементов (%) в образцах LaCo1/3Sb5/3O6, синтезированных различными методами
| La | Co | Sb | |
|---|---|---|---|
| Рассчитано для LaCo1/3Sb5/3O6 | 38.0 | 5.0 | 56.0 |
| Метод соосаждения с последующей гидротермальной обработкой и отжигом | 38.5 | 4.7 | 56.8 |
| Цитратный метод | 31.4 | 6.0 | 62.6 |
Рис. 2.
Спектры диффузного отражения образцов LaCo1/3Sb5/3O6, синтезированных различными методами: цитратный метод (кривая 1), соосаждение с последующей гидротермальной обработкой и отжигом (кривая 2).
Образцы имеют морфологические различия, однако величины их удельной поверхности оказались сопоставимы (табл. 1). Синтезированные путем термического разложения нитратов и цитратным методом образцы представляли собой керамику с размером зерна от 100 нм до 1 мкм (рис. 3). Величины их удельной поверхности, определенные методом низкотемпературной абсорбции азота, не превышали 2 м2 г–1. Образец, полученный методом соосаждения с гидротермальной обработкой осадков, состоял из сросшихся друг с другом частиц от 100 до 500 нм, образующих подобие объемной сетки. Величина его удельной поверхности составила 3.2 м2 г–1.
Рис. 3.
Микрофотографии образцов LaCo1/3Sb5/3O6, синтезированных при разложении нитратов (а), цитратным методом (б) и соосаждением с гидротермальной обработкой осадков и последующим отжигом (в).

В соответствии с разработанными методиками для синтеза LaCo1/3Sb5/3O6 нами была предпринята попытка получить другие соединения изоструктурного ряда LnCo1/3Sb5/3O6 (Ln = Pr–Gd, Er). Однако все синтезированные образцы представляли собой смесь различных фаз. Вероятной причиной может являться уменьшение радиуса катиона редкоземельного элемента (РЗ-катион) в ряду La–Er. Ранее на примере соединений LnM0.5Sb1.5O6, где M = Fe, Ga [7, 15], нами было показано, что устойчивость кристаллической решетки розиаита обеспечивается электростатическим взаимодействием между отрицательно заряженными слоями сочлененных октаэдров (M/Sb)O6 и РЗ-катионами в межслоевом пространстве. Сближение слоев из-за уменьшения радиуса РЗ-катиона может привести к снижению электростатической стабилизации и потере устойчивости слоистой структуры. В результате этого соединение состава LnCo1/3Sb5/3O6 со структурой розиаита существует только в системе La2O3–CoO–Sb2O5. С остальными РЗЭ ряда соединение со структурой розиаита не кристаллизуется.
Исследование каталитических свойств. Анализ каталитической активности LaCo1/3Sb5/3O6 в реакции окисления СО проводили на образцах, синтезированных методом соосаждения с гидротермальной обработкой, цитратным методом, а также путем разложения нитратов. Для сравнения теми же методами были синтезированы образцы LaFe0.5Sb1.5O6, проявившего ранее [7, 8] высокие каталитические свойства. Состав модельной смеси газов соответствовал (об. %): СО – 1.5; О2 – 10; N2 – баланс. Для оценки степени протекания реакции окисления СО (α, %) использовали формулу: α = [(С0 – С)/С0] × 100, где С0 – исходная концентрация СО в модельной смеси, об. %; С – текущая концентрация газа на выходе из реактора, об. %.
Каталитическая активность образцов LaCo1/3Sb5/3O6 и LaFe0.5Sb1.5O6, синтезированных методом термического разложения нитратов и цитратным методом, оказалась низкой (рис. 4), что можно объяснить возможным отравлением поверхности катализатора в процессе синтеза. Наилучшие результаты в реакции окисления СО продемонстрировали образцы, синтезированные методом соосаждения с гидротермальной обработкой осадков и последующим отжигом. Следует отметить, что температура, при которой окисляется 90% СО, для образца LaCo1/3Sb5/3O6 составила 265°С и практически совпала с аналогичной характеристикой для LaFe0.5Sb1.5O6 (263°С, табл. 1). При этом концентрация ионов кобальта, принимающих участие в каталитическом превращении, в LaCo1/3Sb5/3O6 в полтора раза ниже, чем ионов железа в LaFe0.5Sb1.5O6. Повторные испытания показали стабильность каталитических свойств LaCo1/3Sb5/3O6 и LaFe0.5Sb1.5O6, синтезированных методом соосаждения с гидротермальной обработкой осадков и последующим отжигом (табл. 3).
ЗАКЛЮЧЕНИЕ
Разработаны новые методики синтеза слоистого соединения со структурой розиаита LaCo1/3Sb5/3O6 с различной морфологией. Исследована зависимость каталитических свойств LaCo1/3Sb5/3O6 от метода синтеза материалов. Благодаря использованию метода гидротермальной обработки соосажденных осадков получен новый эффективный материал LaCo1/3Sb5/3O6 для каталитического окисления CO. Обобщая полученные данные и результаты проведенных нами ранее исследований LnFe0.5Sb1.5O6 [7, 8], можно сделать вывод о перспективности нового класса соединений со структурой розиаита при их использовании в реакциях окислительного катализа.
Список литературы
Ertl G., Knözinger H., Weitkamp J. (Eds.) Handbook of Heterogeneous Catalysis. VCH, 2008. https://doi.org/10.1002/9783527619474
Heck R.M., Farrauto R.J., Gulati S.T. Catalytic Air Pollution Control. John Wiley & Sons, Inc., Hoboken, NJ, USA, 2009. https://doi.org/10.1002/9781118397749
Royer S., Duprez D. // ChemCatChem. 2011. V. 3. P. 24–65. https://doi.org/10.1002/cctc.201000378
Dey S., Dhal G.C. // Mater. Sci. Energy Technol. 2019. V. 2. P. 575–588. https://doi.org/10.1016/j.mset.2019.06.003
Pakhare D., Schwartz V., Abdelsayed V., Haynes D., Shekhawat D., Poston J., Spivey J.J. // Catal. 2014. V. 316. P. 78–92. https://doi.org/10.1016/j.jcat.2014.04.023
Zhang Y.Q., Xuan Y., Qian S.S., Li X.L., Jia Y.Q. // J. Mater. Sci. 1999. V. 34. P. 4475–4480. https://doi.org/10.1023/A:1004685104797
Egorysheva A.V., Ellert O.G., Liberman E.Y., Kirdyankin D.I., Golodukhina S.V., Gajtko O.M., Svetogorov R.D. // J. Alloys Compd. 2019. V. 777. P. 655–662. https://doi.org/10.1016/j.jallcom.2018.11.008
Ellert O.G., Egorysheva A.V., Liberman E.Y., Golodu-khina S.V., Arapova O.V., Bondarenko G.N. // Ceram. Int. 2020. V. 46. P. 27725–27733. https://doi.org/10.1016/j.ceramint.2020.07.271
Ciambelli P., Cimino S., De Rossi S., Lisi L., Minelli G., Porta P., Russo G. // Appl. Catal. B Environ. 2001. V. 29. P. 239–250. https://doi.org/10.1016/S0926-3373(00)00215-0
Ellert O.G., Egorysheva A.V., Liberman E.Y., Golodu-khina S.V., Kirdyankin D.I., Gajtko O.M. Inorg. Mater. 2019. V. 55. P. 1257–1263. https://doi.org/10.1134/S0020168519120033
Álvarez-Galván M.C., Constantinou D.A., Navarro R.M., Villoria J.A., Fierro J.L.G., Efstathiou A.M. // Appl. Catal. B Environ. 2011. V. 102. P. 291–301. https://doi.org/10.1016/j.apcatb.2010.12.015
Faure B., Alphonse P. // Appl. Catal. B Environ. 2016. V. 180. P. 715–725. https://doi.org/10.1016/j.apcatb.2015.07.019
Blasse G., De Pauw A.D.M. // J. Inorg. Nucl. Chem. 1970. V. 32. P. 2533–2537. https://doi.org/10.1016/0022-1902(70)80298-6
Свиридов Д.Т., Свиридова Р.К., Смирнов Ю.Ф. Оптические спектры ионов переходных металлов в кристаллах. М.: Наука, 1976. 268 с.
Egorysheva A.V., Golodukhina S.V., Tyurin A.V., Khoroshilov A.V., Veselova V.O., Svetogorov R.D. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1073–1080. https://doi.org/10.1134/S0036023619090109
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах



