Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 500, № 1, стр. 35-39
Хлорирование сульфониевых производных клозо-декаборатного аниона с карбоксилсодержащими заместителями
А. В. Голубев 1, *, А. С. Кубасов 1, А. Ю. Быков 1, член-корреспондент РАН К. Ю. Жижин 1, академик РАН Н. Т. Кузнецов 1
1 Институт общей и неорганической химии
им. Н.С. Курнакова Российской академии наук
119991 Москва, Россия
* E-mail: golalekseival@mail.ru
Поступила в редакцию 19.07.2021
После доработки 20.10.2021
Принята к публикации 26.10.2021
Аннотация
Изучено взаимодействие сульфониевых производных клозо-декаборатного аниона, содержащих карбоксильные группы, с сульфурилхлоридом SO2Cl2 как галогенирующим агентом. Получены полностью галогенированные производные клозо-декаборатного аниона состава (n-Bu4N)[2-B10Cl9SR2] (R = –CH2COOEt, –CH2COOH), что было подтверждено данными 11В, 1Н, 13С ЯМР и ИК-спектроскопии. Структура аниона [2-B10Cl9S(CH2COOEt)2]– установлена с использованием монокристального РСА.
Современная химия соединений бора включает большое число различных классов, начиная с его простейших гидридов до высших кластерных анионов, а также карборанов и металлокарборанов [1, 2]. Известно, что эти соединения могут выступать в качестве слабо-донорных лигандов, образующих комплексы с мягкими кислотами Льюиса [3, 4]. Кроме того, полная замена атомов водорода в борном остове на атомы галогенов приводит к перераспределению электронной плотности в соответствующем полиэдрическом анионе [5], что приводит к изменению его свойств [6]. Это расширяет область использования соединений подобного типа, например, для стабилизации таких катионов, как [R2Al]+ или [R3Si]+ [7, 8]. Возможность введения различных функциональных групп (–OH, –OCOR, –SH, –SR2, –NH3, –NCR) позволяет значительно расширить область применения таких соединений [9, 10].
В литературе описан метод получения сульфонио-клозо-декаборатного аниона с карбоксилсодержащими заместителями [2-B10H9S(CH2COOH)2]– [11]. В данной работе поставлена цель изучить возможность получения пергалогенированных клозо-декаборатных производных с заместителями данного типа. Было установлено, что взаимодействие сульфониевого производного клозо-декаборатного аниона, содержащего карборксильную группу, с сульфурилхлоридом приводит к последующему разложению борного кластера до его простых производных с образованием связей B–OH. Однако разложение борного кластера не происходит при галогенировании сульфониевого производного клозо-декаборатного аниона, содержащего сложноэфирные группы [2-B10H9S(CH2COOEt)2]–, и может быть в последующем гидролизовано до искомой кислоты (схема 1).
Схема 1.
Получение пергалогенированных сульфониевых производных клозо-боратов с карбоксилсодержащими заместителями.
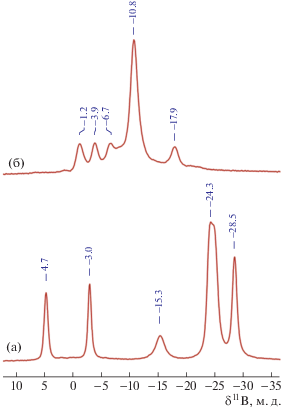
11В ЯМР-спектр продукта полного галогенирования моноаниона [2-B10H9S(CH2COOEt)2]– содержит пять сигналов с интегральным отношением 1 : 1 : 1 : 6 : 1: два сигнала апикальных атомов бора при –1.2 и –3.9 м. д., один сигнал от ипсо-атома бора при –6.7 м. д., тогда как сигнал от противоположного атома бора B4, находящийся в одном с ним экваториальном поясе, зафиксирован при –17.9 м. д. Сигналы остальных атомов бора этого и нижнего экваториальных поясов наблюдаются при δ11В = –10.8 м. д.
ИК-спектр полученного соединения не содержит полосы в области 2500 см–1, являющиеся характеристическими для валентных колебаний связей B–H, и наблюдается возникновение интенсивных полос при 1180, 1030 и 525 см–1, сооветствующих валентным колебаниям B–Cl.
Рис. 1.
11В ЯМР-спектры соединений (n-Bu4N)[2-B10H9S(CH2COOC2H5)2] (а) и (n-Bu4N)[2-B10Сl9S(CH2COOC2H5)2] (б).
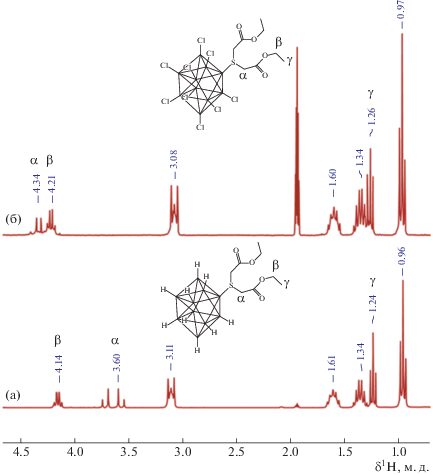
В 1Н ЯМР-спектре соединения (n-Bu4N)[2-B10Cl9S(CH2COOC2H5)2], в отличие от спектра его не галогенированного сульфониевого предшественника, наблюдается смещение сигналов от протонов α‑метиленовых групп экзо-полиэдрического заместителя в область слабых полей на 0.75 м. д. Тогда как сигналы протонов остальных групп (β, γ) в этом заместителе смещаются в эту же область незначительно. Обнаруженный эффект связан со смещением электронной плотности сильно электроноакцепторных атомов галогенов в результате полного замещения борного остова (рис. 2). Этот же эффект наблюдается в 13С ЯМР спектроскопии: происходит смещение сигнала δ13С атома углерода метиленовой группы заместителя при атоме серы в область слабых полей на 4.3 м. д., тогда как сигналы остальных атомов углерода этого заместителя смещаются незначительно.
Рис. 2.
1Н ЯМР-спектры соединений (n-Bu4N)[2-B10H9S(CH2COOC2H5)2] (а) и (n-Bu4N)[2-B10Сl9S(CH2COOC2H5)2] (б).
Кристаллическая и молекулярная структура соединения (n-Bu4N)[2-B10Cl9S(CH2COOEt)2] была установлена методом монокристального РСА (рис. 3). Анализ проводили на автоматическом дифрактометре Bruker APEX2 CCD (λMoKα, графитовый монохроматор, ω–ϕ сканирование). Структура расшифрована прямым методом с последующим расчетом разностных синтезов Фурье. Все неводородные атомы катионов и атомы бора уточнены в анизотропном приближении. Неводородные атомы растворителя и экзополиэдрического заместителя аниона уточнены в изотропном приближении. Все атомы водорода уточнены по модели наездника с тепловыми параметрами Uизо = 1.2Uэкв соответствующего неводородного атома (1.5Uизо для СН3-групп). При сборе и обработке массива отражений использовались программы APEX2, SAINT и SADABS [12]. Структура расшифрована и уточнена с помощью программ комплекса OLEX2 [13]. Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDС № 2097273).
Кристаллографическая независимая часть моноклинной элементарной ячейки (С2/m) его кристалла содержит половину аниона [2-B10Cl9S(CH2COOEt)2]– и катиона (n-Bu4N)+. Длина связи B–S составляет 1.906(11) Å и практически аналогична таковой (1.910(3)) в случае его негалогенированного предшественника ([2-B10Cl9S(CH2COOEt)2]–. Длины связей B–Cl для апикальных атомов бора B1 и B10 равны 1.770(11) и 1.813(12) Å соответственно, тогда как длины связей B–Cl для экваториальных атомов бора B3–B9 значительно больше и находятся в диапазоне 1.792(8)–1.845(8) Å.
На следующем этапе настоящего исследования был проведен гидролиз экзо-полиэдрического заместителя при борном полиэдре в щелочной среде. 11В ЯМР-спектр полученного продукта (n-Bu4N)[2-B10Cl9S(CH2COOH)2] близок к спектру исходного соединения. Отмечены лишь небольшие различия в величине химических сдвигов для аналогичных атомов бора.
1Н ЯМР-спектр этого сложноэфирного продукта гидролиза не содержит сигналов протонов углеводородного радикала, тогда как сигнал протонов метиленовых групп при атоме серы практически сохраняется. Кроме того, наблюдается широкий синглетный сигнал при 7.8 м. д., отнесенный к атому водорода карбоксильной группы. Аналогичные изменения наблюдали и в его 13С ЯМР-спектре.
ВЫВОДЫ
В ходе данной работы было установлено, что получение перхлорированного сульфониевого производного с карбоксильными группами [2-B10Cl9S(CH2COOH)2]– невозможно осуществить прямым взаимодействием исходного производного клозо-декаборатного аниона с сульфурилхлоридом. Тем не менее данное соединение может быть получено путем хлорирования сульфониевого производного клозо-декаборатного аниона с экзо-полиэдрическими сложноэфирными группами [2-B10H9S(CH2COOC2H5)2]– с последующим гидролизом полученного соединения.
Список литературы
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czech. Chem. Commun. 2010. V. 75. № 11. P. 1149–1199. https://doi.org/10.1135/cccc2010054
Avdeeva V.V., Malinina E.A., Sivaev I.B., Bregadze V.I., Kuznetsov N.T. // Crystals. 2016. V. 6. 60. https://doi.org/10.3390/cryst6050060
Avdeeva V.V., Malinina E.A., Zhizhin K.Y., Kuzne-tsov N.T. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. P. 514–534. https://doi.org/10.1134/S0036023620040026
Avdeeva V.V., Polyakova I.N., Churakov A.V., Vologzhanina A.V., Malinina E.A., Zhizhin K.Y., Kuzne-tsov N.T. // Polyhedron. 2019. V. 162. P. 65–70. https://doi.org/10.1016/j.poly.2019.01.051
Kubasov A.S., Golubev A.V., Bykov A.Yu., Matveev E.Yu., Zhizhin K.Yu., Kuznetsov N.T. // J. Molec. Struct. 2021. V. 1241. 130591. https://doi.org/10.1016/j.molstruc.2021.130591
Golubev A.V., Kubasov A.S., Bykov A.Yu., Zhizhin K.Yu., Kravchenko E.A., Gippius A.A., Zhurenko S.V., Semenova V.A., Korlyukov A.A., Kuznetsov N.T. // Inorg. Chem. 2021. V. 60. № 12. P. 8592–8604. https://doi.org/10.1021/acs.inorgchem.1c00516
Kim K.C., Reed C.A., Long G.S., Sen A. // J. Am. Chem. Soc. 2002. V. 124. № 26. P. 7662–7663. https://doi.org/10.1021/ja0259990
Reed C.A. // Acc. Chem. Res. 2010. V. 43. № 1. P. 121–128. https://doi.org/10.1021/ar900159e
Ali F., Hosmane N.S., Zhu Y. // Molecules. 2020. V. 25. № 4. 828. https://doi.org/10.3390/molecules25040828
Olejniczak A.B., Nawrot B., Leśnikowski Z.J. // Int. J. Mol. Sci. 2018. V. 19. 3501. https://doi.org/10.3390/ijms19113501
Kubasov A.S., Matveev E.Y., Turyshev E.S., Polyakova I.N., Nichugovskiy A.I., Zhizhin K.Y., Kuznetsov N.T. // Inorg. Chim. Acta. 2018. V. 477. P. 277–283. https://doi.org/10.1016/j.ica.2018.03.013
Sheldrick G.M. // Acta Crystallogr., Sect. C: Struct. Chem. 2015. V. 71. P. 3–8. https://doi.org/10.1107/S2053229614024218
Dolomanov O.V., Bourhis L.J., Gildea R.J., Howard J.A.K., Puschmann H. // J. Appl. Crystallogr. 2009. V. 42. № 2. P. 339–341. https://doi.org/10.1107/S0021889808042726
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах



