Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 501, № 1, стр. 59-64
Получение и изучение свойств нового биокомпозита хитозана и 5,7-бис-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)-8-оксихинолина
И. С. Чащин 1, *, Е. И. Перепелкин 2, В. И. Дяченко 1
1 Институт элементоорганических соединений
им. А.Н. Несмеянова Российской академии наук
119991 Москва, Россия
2 Российский химико-технологический университет
им. Д.И. Менделеева
125047 Москва, Россия
* E-mail: chaschin@polly.phys.msu.ru
Поступила в редакцию 30.08.2021
После доработки 08.11.2021
Принята к публикации 17.11.2021
Аннотация
Импрегнацией 5,7-бис-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)-8-оксихинолина (ФОХ) в хитозан в 60%-й уксусной кислоте получен новый биоорганический композит. Показано, что полученный комплекс обладает высокой стабильностью за счет водородных связей между аминогруппами хитозана и обладающими повышенной кислотностью ОН-группами ФОХ. Установлено, что данный композит в значительно большей степени, чем сам хитозан, ингибирует рост грамположительных и грамотрицательных бактерий. Ожидается, что полученный биокомпозит может быть использован в качестве антибактериального покрытия с пролонгированным сроком действия для коллагеновых матриксов, используемых в кардиопротезировании.
В кардиохирургической практике широко применяются ксеногенные биологические протезы, основу которых составляет бычий или свиной перикард, сшитый глутаровым альдегидом [1]. Однако не задействованные в сшивке коллагеновых фибрилл его альдегидные группы являются инициаторами кальциноза, в значительной степени сокращающего функциональный срок службы кардиопротезов [2]. В этой связи для увеличения продолжительности срока службы и улучшения механических характеристик кардиопротезов применяют концепцию создания “защитного экрана”, связывающего свободные альдегидные группы [2].
Оказалось, для создания защитного экрана на коллагеновом биоматриксе по многим характеристикам подходит полимер природного происхождения – хитозан [3]. Хитозановое покрытие, нанесенное на коллагеновую матрицу, имеет высокую стабильность вследствие ковалентного связывания аминогрупп хитозана со свободными (остаточными) альдегидными группами глутарового альдегида [4]. Хитозановое покрытие, нанесенное из растворов в угольной кислоте под давлением, эффективно решает проблему кальцификации ксеногенной коллагеновой ткани [5].
Другим фактором преждевременной деградации биопротезов является развитие инфекционного эндокардита в области имплантации [6]. Для предотвращения этих патогенных процессов прибегают к приданию антимикробных свойств как самой коллагеновой ткани протеза, так и ее хитозановому покрытию. Как правило, это достигается за счет нанесения и внедрения в них антимикробных веществ (антибиотики, наночастицы серебра и т.п.) [7–12]. Несмотря на значительные успехи в этом направлении, инфекционный эндокардит до сих пор остается насущной проблемой.
Целью настоящей работы является разработка метода получения комплекса хитозана с 5,7-бис-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)-8-гидроксихинолином, обладающим высоким антимикробным действием, а также изучение стабильности, физико-химических и антибактериальных свойств этого комплекса.
Для длительного сохранения антибактериальных свойств хитозанового покрытия традиционные антибиотики не пригодны вследствие их малой стабильности. Гидролиз амидных, сложноэфирных, гликозидных связей, ацетальных и кетальных групп, имеющихся в составе сложных молекул высокоэффективных антибиотиков, приводит к изменению их структуры и конформации и, как следствие, потере активности [13]. В этой связи поиск пригодных для этих целей веществ должен вестись среди относительно простых по структуре соединений, не имеющих лабильных легко гидролизуемых связей. К тому же они должны быть устойчивы к окислению и обладать сильным антибактериальным эффектом. Для создания антибактериального хитозанового покрытия с длительным сроком действия был взят 5,7-бис-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)-8-гидроксихинолин (ФОХ) (рис. 1), превышающий по активности в отношении грамположительных бактерий и споровых культур применяемый в клинической практике нитроксолин (5-НОК) [14] (табл. 1). Помимо этого, данное соединение обладает низкой токсичностью, его ЛД50 превышает 2000 мг кг−1 массы тела животных [15].
Рис. 1.
Структурная формула 5,7-бис-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)-8-гидроксихинолина (ФОХ).
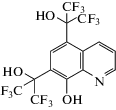
Таблица 1.
Антимикробные свойства ФОХ в сравнении с нитроксолином (5‑НОК)
| Соединение | Минимальная подавляющая концентрация, мкг мл–1 | Минимальная бактерицидная концентрация, мкг мл–1 | ||||||
|---|---|---|---|---|---|---|---|---|
| S. aureus | S. faecalis | M. luteus | B. anthracis | S. aureus | S. faecalis | M. luteus | B. anthracis | |
| ФОХ | 1.00 | 0.83 | 0.062 | 0.19 | 1.50 | 2.60 | 0.125 | 1.00 |
| Эталон: | ||||||||
| 5-НOК | 3.13 | 3.13 | 0.78 | 2.55 | 7.00 | 8.30 | 5.21 | 3.80 |
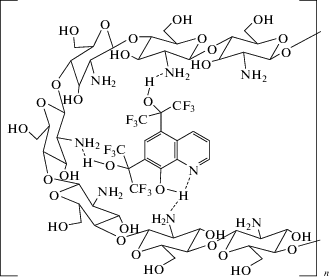
Важным фактором структурного строения ФОХ, имеющим значение для его ассоциации в межполимерных цепях хитозана, является наличие в положениях 5 и 7 молекулы двух стерически объемных гексафторизопропанольных групп. Отрицательный индукционный эффект СF3-групп значительно повышает кислотность третичных спиртовых ОН-групп ФОХ, что, в свою очередь, приводит к сильной сольватации ими NH2-групп ß‑D-глюкозаминовых полимерных цепей хитозана (рис. 2). По-видимому, эти особенности строения ФОХ в значительной степени препятствуют его эмиссии из хитозановой матрицы.
5,7-Бис-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)-8-гидроксихинолин был получен реакцией гексафорацетона и 8-гидроксихинолина с выходом 94% ранее описанным методом [14]. Спектры 1H и 19F ЯМР соединения регистрировали в СDCl3 на спектрометре “Bruker Avance-400” (“Bruker”, США) с рабочими частотами 400 и 376 МГц соответственно. Величины химических сдвигов в спектрах 1Н ЯМР приведены относительно ТМС (внутренний стандарт), в 19F ЯМР спектрах приведены относительно СF3CO2H (внешний стандарт). Константы спин-спинового взаимодействия приведены в Гц. 1Н ЯМР (ДМСО-d6, δ, м. д., J, Гц): 13.01 (уш. с, 1Н, ОН), 9.65 (д, 1Н, Н4, 3JH–H 8), 9.18 (с, 1Н, ОН), 8.93 (д, 1Н, Н2, JH–H 4), 8.01 (дд, 1Н, Н3, 3JH−H 8, 3JH–H 4), 7.90 (с, 1Н, Н6), 3.66 (уш. с, 1Н, ОН). 19F ЯМР (ДМСО-d6, δ, м. д.): −3.67 (c, 6F, 2CF3), −0.85 (c, 6F, 2CF3). Масс-спектры получены на квадрупольном масс-спектрометре FINNIGAN МАТ INCOS 50 (“Scientific Instrument Services”, США); прямой ввод, электронный удар, энергия ионизации 70 эВ. Масс-спектр, m/z (%): 477 (18) [M+], 408 (100), 338 (36), 268 (10), 268 (12), 241 (12), 99 (17), 69 (93), 28 (12), 18 (27). Найдено, %: С, 37.76; Н, 1.42; N, 3.14; F, 47.95. Вычислено для С15Н7F12NO3, %: С, 37.74; Н, 1.48; N, 3.02; F, 47.80.
Для получения полимерного композита использовали низкомолекулярный хитозан (#448869, Mw ~ ~ 210 кг моль−1, СД = 84%, “Sigma-Aldrich”, США).
Комплекс моделировали таким образом, чтобы на одну молекулу ФОХ приходилось около 20 звеньев D-глюкозаминовых звеньев полимерной цепи хитозана. Подобрана концентрация водной уксусной кислоты (60%), в которой растворялись оба компонента композита. При этом объем растворителя, значения рН среды и температуры должны быть таковы, чтобы полимерные цепи были как можно меньше ассоциированы и ФОХ мог равномерно между ними распределиться.
Получение композита хитозана и ФОХ. В стеклянную круглодонную коническую колбу объемом 50 мл, снабженную магнитной мешалкой с подогревом, помещали 10 мг ФОХ и 2 мл 99%-й уксусной кислоты. В полученный раствор при перемешивании и температуре 45°С прибавляли 90 мг хитозана. После перемешивания в этих условиях в течение 10 мин образовалась однородная эмульсия. Для получения гомогенной системы в раствор добавили по каплям еще 4 мл 99%-й уксусной кислоты, затем 4 мл воды. При этом наблюдалось полное растворение хитозана с образованием прозрачного гелеобразного раствора желтого цвета. Реакционную массу перемешивали еще 30 мин при 45°С. Затем нагрев отключали и давали реактору самопроизвольно охладиться до 20°С. Раствор упаривали на роторном испарителе до постоянного веса при пониженном давлении и температуре водяной бани ≤45°С. На внутренней поверхности колбы получили целевой композит в виде пленки желтого цвета.
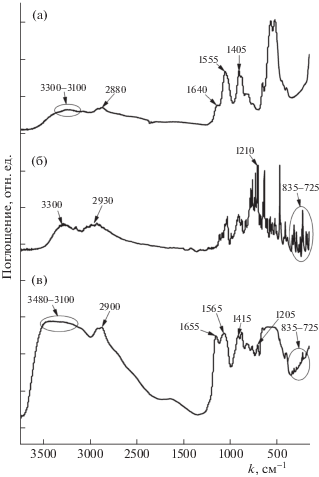
Строение образцов композитных пленок изучали на основании ИК-спектров нарушенного полного внутреннего отражения (НПВО). Исследования проводили с помощью прибора Thermo Nicolet IS5 FT-IR” (“Thermo Fisher Scientific”, США) с приставкой ID5 ATR (алмазный кристалл). На спектре комплекса (рис. 3в) отчетливо идентифицируются характеристические полосы поглощения хитозана при 1655 и 1565 см–1 (N–H) [16], которые сдвинуты относительно полос пленки из чистого полимера (рис. 3a; 1640 и 1555 см−1), что свидетельствует об образовании водородных связей и донорно-акцепторном взаимодействии между аминогруппами хитозана и гидроксильными группами ФОХ [17]. Кроме того, на спектре комплекса проявляется система пиков в области 725−835 см−1 (С–Н, ароматические углеводороды), присутствующих на спектре чистого ФОХ (рис. 3б) и пик при 1205 см−1 (С–F), который также является характерным для антибактериального агента. Следует отметить сигналы водородных связей в области 3300 и 2900 см−1. Интенсивность данных пиков на ИК-спектре комплекса увеличивается в несколько раз в сравнении со спектрами составляющих композит индивидуальных веществ, что говорит об образовании многочисленных водородных связей между хитозаном и ФОХ.
Масс-спектральный анализ полученного комплекса, выполненный методом прямого ввода, показал, помимо характерных фрагментов разложения D‑глюкозамина хитозана, присутствие следов разложения ФОХ. Об этом свидетельствует наличие фрагмента с массой 408, образованного отщеплением от молекулы ФОХ трифторметильной группы [М+−СF3], а также фрагмента с массой 338, образовавшегося вследствие отщепления двух СF3-групп. В масс-спектре биокомпозита также присутствует ион с массой 69, принадлежащий трифторметильной группе. Следует отметить, эти же ионы присутствуют и в масс-спектре самого ФОХ.
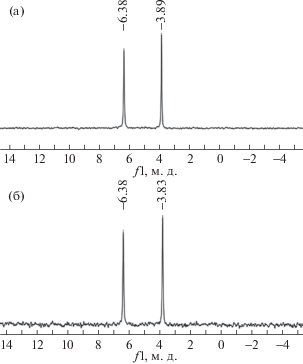
Наличие взаимодействий между составляющими биокомпозита хитозаном и ФОХ частично подтверждается и данными 19F ЯМР-спектроскопии. Действительно, сигналы ядер 19F трифторметильных групп двух гексафторизопропанольных заместителей ФОХ в спектре, снятом в 60%-й уксусной кислоте, зарегистрированы в области −6.38 и −3.89 м. д. соответственно. В тоже время в спектрах 19F ЯМР сигналы гексафторизопропанольных заместителей ФОХ в комплексе, снятых в этих же условиях, регистрируются в области −6.38 и −3.83 м. д. Смещение одного из сигналов гексафторизопропанольного заместителя на 0.06 м. д. в область слабого магнитного поля свидетельствует о том, что входящая в его состав ОН-группа более ассоциирована с D-глюкозаминовыми звеньями хитозана (рис. 4).
Исследование антимикробных свойств композита хитозана и ФОХ. Для изучения антимикробной активности были проведены сравнительные исследования модифицированной ФОХ композитной пленки хитозана и пленки из чистого хитозана в качестве контрольного образца, полученных методом полива из раствора уксусной кислоты. Антимикробную активность оценивали по зоне лизиса вокруг образцов пленок размером 1 × 1 см2, помещенных на плотную питательную среду с газоном музейных штаммов тест-культур S. aureus и E. faecalis. Количественная оценка эффективности антимикробной активности проведена методом сравнительного анализа зоны лизиса опытных и контрольных пленок согласно соотношению (1):
(1)
$I \cong \left( {\frac{{{{\delta }_{{\text{о}}}}}}{{{{\delta }_{{\text{к}}}}}} - 1} \right) \times 100\% ,$Для модифицированной пленки ФОХ наблюдали существенное подавление роста как грамположительных (S. aureus), так и грамотрицательных (E. coli) типов бактерий (табл. 2). Очевидно, что комплекс обладает выраженной антимикробной активностью. Рассчитанный индекс антимикробной активности для композита хитозан−ФОХ составил 43 ± 7% относительно S. aureus и 70 ± 10% относительно E. coli (табл. 2). Следует отметить, умеренные показатели антимикробной активности полученного композита объясняются медленной эмиссией бактерицидного агента из хитозанового комплекса (табл. 2). Именно наличие многочисленных водородных связей между составляющими композита (рис. 1) является препятствующим фактором быстрого высвобождения ФОХ из биополимера. В свою очередь это может свидетельствовать в пользу его пролонгированного действия в отношении патогенных бактерий и споровых культур, вызывающих патогенез.
Таблица 2.
Результаты исследования антимикробной активности по отношению к штаммам S. aureus ATCC 2913 и E. coli ATCC 2913 полученного комплекса ФОХ и хитозана путем определения размеров зон лизиса бактерий, инкубированных в питательной среде
| Референс- штамм | Расстояние от образца биокомпозита хитозана с ФОХ до границы зоны лизиса ${{\delta }_{{\text{о}}}}$, мм | Расстояние от контрольного образца хитозановой пленки до границы зоны лизиса ${{\delta }_{{\text{к}}}}$, мм | Индекс антимикробной активности I, % |
|---|---|---|---|
| S. aureus ATCC 2913 | 1.00 ± 0.10 | 0.70 ± 0.10 | 43 ± 7 |
| E. coli ATCC 2913 | 1.20 ± 0.15 | 0.85 ± 0.10 | 70 ± 10 |
Таким образом, на основе хитозана и 5,7-бис(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)-8-оксихинолина получен новый полимерный биокомпозит. Методом 19F ЯМР, ИК- и масс-спектрометрии изучено его строение. Показано, что стабильность данного биополимерного комплекса достигается благодаря наличию водородных связей между ОН-группами ФОХ и NH2-группами хитозана, а также конформационно-стерическим эффектам его составляющих.
Методом сравнительного анализа зон лизиса вокруг образцов пленок показана более высокая антибактериальная активность ФОХ-содержащего хитозанового композита, чем самого хитозана.
Таким образом, полученный на основе хитозана и 5,7-бис-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)-8-гидроксихинолина биокомпозит обладает ярко выраженными антибактериальными свойствами и может быть использован при создании покрытий для биопротезов и других медицинских устройств.
Список литературы
Jana S., Tefft B.J., Spoon D.B. // Acta Biomat. 2014. V. 10. P. 2877–2893. https://doi.org/10.1016/j.actbio.2014.03.014
Schoen F.J., Levy R.J. // Ann. Thorac. Surg. 2005. V. 79. P. 1072–80. https://doi.org/10.1016/j.athoracsur.2004.06.033
Wenjie W., Changhu X., Xiangzhao M. // Int. J. Biol. Macromol. 2020. V. 164. P. 4532−4546. https://doi.org/10.1016/j.ijbiomac.2020.09.042
Kildeeva N.R., Perminov P.A., Vladimirov L.V., Novikov V.V., Mikhailov S.N. // Russ. J. Bioorg. Chem. 2009. V. 35. P. 360–369. https://doi.org/10.1134/S106816200903011X
Chaschin I.S., Badun G.A., Chernysheva M.G., Grigo-riev T.E., Krasheninnikov S.V., Anuchina N.M., Bakuleva N.P. // J. Mech. Behav. Biomed. Mater. 2019. V. 94. P. 213−221. https://doi.org/10.1016/j.jmbbm.2019.03.012
Bruun N.E., Habib G., Thuny F., Sogaard P. // Eur. Heart J. 2014. V. 35. P. 624–632. https://doi.org/10.1093/eurheartj/eht274
Govender S., Pillay V., Chetty D.J., Essak S.Y., Dan-gor C.M., Govender T. // Int. J. Pharm. 2005. V. 306. P. 24–40. https://doi.org/10.1016/j.ijpharm.2005.07.026
Kausar R., Khan A.-U., Jamil B., Shahzad Y., ul-Haq. I. // Carbohydr. Polym. 2021. V. 265. P. 117565. https://doi.org/10.1016/j.carbpol.2020.117565
El-Alfy E.A., El-Bisi M.K., Taha G.M., Ibrahim H.M. // Int. J. Biol. Macromol. 2020. V. 161. P. 1247–1260. https://doi.org/10.1016/j.ijbiomac.2020.06.118
Patel G., Yadav B.K.N. // Recent Patents on Nanotech. 2020. V. 14. P. 210–224. https://doi.org/10.2174/1872210513666190702165556
Brkich L.L., Pyatigorskaya N.V., Brkich G.E., Belov A.A., Krasnyuk I.I. // J. Pharm. Sci. Res. 2018. V. 10. P. 2027–2029.
Janes K.A., Fresneau M.P., Marazuela A., Fabra A., Alonso M.J. // J. Controlled Release. 2001. V. 73. P. 255–267. https://doi.org/10.1016/S0168-3659(01)00294-2
Kümmerer K. // Chemosphere. 2009. V. 75. P. 417–434. https://doi.org/10.1016/j.chemosphere.2008.11.086
Дяченко В.И., Коломиец А.Ф., Фокин А.В., Александрова Г.А., Рычкова М.И. // Бюл. изобретений. Полезные модели. 2007. № 18. А. с. СССР № 1793687.
Саноцкий И.В., Уланова И.П. Критерии вредности в гигиене и токсикологии при оценке опасности химических соединений. М.: Медицина, 1975. 328 с.
Theapsak S., Watthanaphanit A., Rujiravanit R. // ACS Appl. Mater. Interfaces. 2012. V. 4. P. 2474–2482. https://doi.org/10.1021/am300168a
Akhil Kumar M.M., Biju V.M. // New J. Chem. 2020. V. 44. P. 8044–8054. https://doi.org/10.1039/d0nj01757d
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах