Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 501, № 1, стр. 65-72
Термодинамика парообразования GeO2 по данным высокотемпературной масс-спектрометрии
А. С. Смирнов 1, *, К. Г. Сморчков 1, Н. А. Грибченкова 1, А. С. Алиханян 1
1 Институт общей и неорганической химии
им. Н.С. Курнакова Российской академии наук
Москва, Россия
* E-mail: prostreet02@rambler.ru
Поступила в редакцию 29.09.2021
После доработки 02.12.2021
Принята к публикации 05.12.2021
Аннотация
Эффузионным методом Кнудсена в сочетании с масс-спектральным анализом газовой фазы исследованы процессы парообразования GeO2 (тетрагональной и гексагональной кристаллических модификаций) в интервале температур 1250–1370 K. Установлено, что насыщенный пар над GeO2 состоит из молекул GeO и O2. Найдены парциальные давления компонентов равновесного пара и их зависимости от температуры. По 2-му и 3-му законам термодинамики определены стандартная энтальпия гетерофазной реакции GeO2(тв) = GeO(г) + 1/2O2(г) и стандартная энтальпия образования ∆fH$_{{298}}^{^\circ }$(GeO(г)) = −41.7 ± 17.6 кДж моль–1.
ВВЕДЕНИЕ
Оксид германия является перспективным материалом в передовых оптоэлектронных устройствах благодаря сочетанию электрофизических и оптических свойств. GeO2 – это полупроводник со сверхширокой запрещенной зоной (~6 эВ) и высокой подвижностью носителей зарядов, что дает возможность рассматривать его в качестве компонента МОП-транзисторов [1]. Для получения тонкопленочных функциональных оксидных материалов используют методы вакуумного напыления, поэтому состав газовой фазы и абсолютные величины парциальных давлений имеют ключевое значение при выборе условий осаждения вещества на подложку [2].
При стандартном давлении GeO2 существует в виде двух кристаллических модификаций – тетрагональной GeO2(t) (структурный тип рутила, P42/mnm), устойчивой в интервале температур 0–1308 K, гексагональной GeO2(h) (структурный тип α-кварца, P3221), устойчивой в интервале температур 1308–1388 К, – и в виде стекла [3].
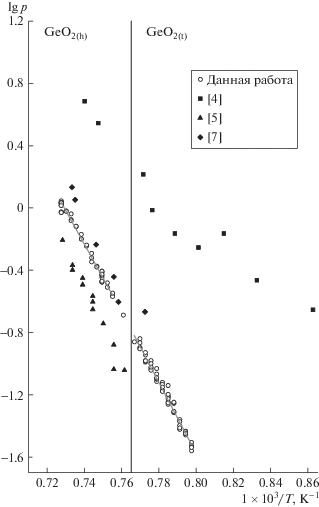
Сублимацию оксида германия эффузионным методом Кнудсена исследовали ранее [4–7]. В работах использовали эффузионные камеры, изготовленные из кварца [4, 5] и сплава 90% Pt + 10% Rh [6, 7]. Согласно анализу с точки зрения термодинамики, проведенному в [8], и сравнению с величинами, рассчитанными на основе данных термодинамической базы [9], определенные в работе [5] значения парциальных давлений компонентов газовой фазы существенно занижены и не соответствуют равновесным. Полученные в работе [4] величины энтальпии парообразования GeO2, рассчитанные по 2-му и 3-му законам термодинамики, различаются примерно на 200 кДж моль–1. Низкие давления в работах [5] и [7] (рис. 1) и различие в значениях энтальпии в работе [4] (табл. 1), по-видимому, обусловлены двумя причинами: взаимодействием GeO2 с материалом эффузионной камеры (SiO2) и ненасыщенным паром над GeO2, т.е. отсутствием равновесия в эффузионной камере. В работе [10] было установлено, что при исследуемых температурах (1160–1370 K) GeO2 и SiO2 образуют протяженную область твердого раствора. Следовательно, активность GeO2 может значительно меняться в течение экспериментов с использованием кварцевой эффузионной камеры при высоких температурах. Отсутствие равновесия в эффузионной камере может быть обусловлено низкой скоростью испарения вещества, что нередко наблюдается для труднолетучих оксидов. В работе [11], посвященной исследованию системы B2O3–GeO2, выполненной методом высокотемпературной масс-спектрометрии, был определен коэффициент испарения расплава GeO2 из платиновой эффузионной камеры, который составил 0.064 при температуре плавления оксида германия.
Таблица 1.
Стандартные энтальпии гетерофазной реакции (1) и энтальпия образования GeO(г), рассчитанные по 2-му и 3-му законам термодинамикиа
| T, K | Кристаллическая модификация | ΔrH$_{{298}}^{^\circ }$, Дж моль–1 | ΔfH$_{{298}}^{^\circ }$ (GeO, г), Дж моль–1 | Ссылка | ||||
|---|---|---|---|---|---|---|---|---|
| 2-й закон | 3-й закон | 2-й закон | 3-й закон | |||||
| 1250–1300 | Тетрагональная | 674.5 ± 68.4 | 585.9 ± 14.2 | 542.2 ± 18.2б | 94.3 ± 68.4 | 5.7 ± 14.3 | −38.0 ± 18.2б | Данная работа |
| 1320–1370 | Гексагональная | 639.3 ± 28.1 | 560.3 ± 14.2 | 514.0 ± 18.2б | 80.6 ± 28.1 | 1.8 ± 14.3 | −44.7 ± 18.2б | Данная работа |
| 1160–1350 | Гексагональная | 325.3 ± 70.6 | 516.5 ± 16.2 | −254.9 ± 70.6 | −42.2 ± 16.3 | [4] | ||
| 1310–1370 | Гексагональная | 752.8 ± 87.5 | 571.4 ± 14.4 | 194.1 ± 87.5 | 12.7 ± 14.4 | [5] | ||
| 1290–1360 | Гексагональная | 642.1 ± 161.7 | 554.5 ± 14.7 | 83.4 ± 161.7 | −4.2 ± 14.7 | [7] | ||
| Рекомендованное значение | −41.7с ± 17.6 | |||||||
| ТСИВ [9] | Тетрагональная | 542.5 ± 13.9 | −37.7 ± 4.0 | |||||
| Гексагональная | 521.0 ± 13.9 | |||||||
а Энтальпии реакций и энтальпии образования рассчитаны на основании экспериментальных данных работ [4, 5, 7] с использованием термодинамических функций ТСИВ [9]. Погрешности термодинамических функций взяты в соответствии с классом точности таблиц, приведенных в справочнике. б Значения энтальпии, рассчитанные на основании рекомендованных величин парциальных давлений. Погрешность значения получена с учетом ошибки в коэффициенте испарения 100%. с Рекомендованное значение вычислено как среднее арифметическое между величинами, полученными по 3-му закону термодинамики в данной работе и работе [4].
Необходимо подчеркнуть, что в упомянутых выше работах [4–7] была исследована только гексагональная кристаллическая модификация GeO2, которая является метастабильной в интервале температур до 1308 К. Следует заметить, что коммерческие препараты оксида германия представляют собой именно гексагональную модификацию, иногда с незначительной примесью тетрагональной. Фазовый переход из гексагональной в термодинамически стабильную тетрагональную фазу значительно затруднен кинетически и, по-видимому, имеет высокий потенциальный барьер, что обусловливает отсутствие полноты трансформации с образованием равновесного GeO2(t) даже при относительно длительном отжиге: получаемые препараты содержат до 10 мол. % GeO2(t) [12]. Данной проблеме посвящено большое количество работ, выполненных различными методами. В том числе было установлено, что полиморфному превращению GeO2(h) в GeO2(t) способствуют использование катализаторов при отжиге и применение высокого давления [12]. Таким образом, состав и парциальные давления компонентов пара над тетрагональной фазой оксида к настоящему времени определены не были. Исключение составляет единственная работа по масс-спектральному анализу продуктов испарения тетрагональной фазы GeO2, на которую дана ссылка в справочнике ТСИВ [9] (внутренняя ссылка [344a], на момент выхода справочника работа готовилась к публикации), и которая, по-видимому, так и не была опубликована: поиск данной работы среди открытых источников литературы не дал результатов. Таким образом, невозможно было уточнить детали работы и провести анализ и оценку полученных данных.
Настоящая работа была проведена с целью получения достоверной информации о термодинамике испарения оксида германия методом высокотемпературной масс-спектрометрии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
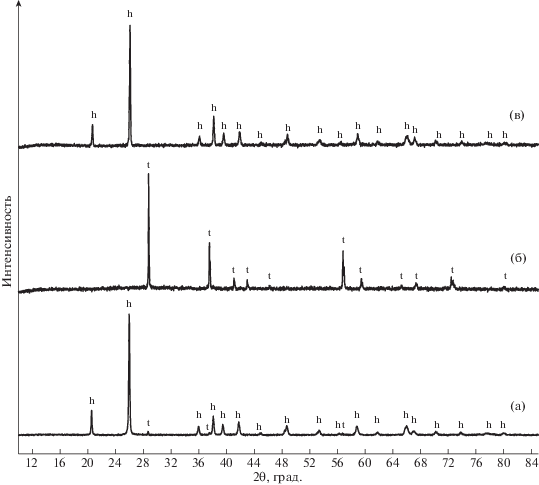
В работе использовали коммерческий препарат GeO2 (99.99%, Merck, Германия), который был представлен в основном гексагональной фазой с незначительной примесью тетрагональной. Тетрагональную кристаллическую модификацию синтезировали с использованием в качестве катализатора CsNO3 в соответствии с методикой, представленной в работе [13]. Полноту протекания фазового превращения контролировали методом рентгенофазового анализа (РФА) (Bruker D8 ADVANCE, Германия; CuKα-излучение). Полученный таким образом GeO2(t) последовательно отжигали в платиновом тигле в вакууме (1173 K, 12 ч) для удаления примеси оксида цезия, а затем на воздухе (1173 K, 12 ч) для устранения возможного отклонения от стехиометрии по кислороду. В результате, согласно данным РФА (рис. 2), был получен однофазный образец GeO2 тетрагональной модификации. Отсутствие в масс-спектре пара над образцами ионов Cs+ свидетельствовало о чистоте полученной фазы.
Рис. 2.
Дифрактограммы образцов GeO2 (a) исходного коммерческого препарата, прокаленного в течение 8 ч при 1073 K на воздухе; (б) тетрагональной модификации, полученной в данной работе; (в) после масс-спектрального эксперимента. h – отражения гексагональной модификации (номер карточки JCPDS [83-543]), t – отражения тетрагональной модификации (номер карточки JCPDS [71-651]).
Непосредственно перед эффузионным экспериментом образцы оксидов германия отжигали в платиновых тиглях на воздухе (1073 K, 8 ч) для удаления адсорбированных газов и воды. Фазовый и элементный состав отожженных оксидов и образцов после эффузионного эксперимента, определяли методами РФА и рентгенофлуоресцентного (РФлА) (Bruker M4 Tornado, Германия) анализа.
Парообразование GeO2 исследовали эффузионным методом Кнудсена с масс-спектральным анализом газовой фазы на приборе МС-1301 (СКБ АП АН, СССР). Испарение порошка оксида германия проводили из алундовой камеры, в которой отношение площади сублимации к площади эффузии составляло ~100. Площадь сублимации принимали равной площади поперечного сечения эффузионной камеры. Камеру Кнудсена нагревали печью сопротивления, температуру в которой поддерживали в пределах ±1 K. Температуру измеряли термопарой Pt–Pt/Rh (10%), калиброванной по температуре плавления серебра. Значение температурной поправки составило +20.0 ± 2.5 К.
Эффузионный эксперимент по исследованию зависимостей ионных токов от температуры и времени проводили в температурном диапазоне 1250–1370 K. Константу чувствительности прибора k определяли непосредственно в эксперименте по испарению оксида германия, используя уравнение Герца–Кнудсена. Максимальная относительная погрешность в значении константы чувствительности Ur(k) составила 30%. При расчете Ur(k), согласно методикам, рекомендованным в [14, 15], были учтены погрешности в определении площади отверстия эффузионной камеры, коэффициента Клаузинга, массы образца, ионного тока, температуры (величины расположены в порядке убывания) [14, 15].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведение высокотемпературных масс-спектральных экспериментов в алундовой эффузионной камере в данной работе было обусловлено доступностью камеры и принципиальной возможностью ее использования на основании известных фазовых равновесий в системе Al2O3–GeO2 [16]. Согласно равновесной фазовой диаграмме, в данной системе имеется гетерогенная область [GeO2(тв) + 2GeO2(тв) · 3Al2O3(тв)] и отсутствует заметная растворимость оксида алюминия в GeO2(тв), т.е. термодинамическая активность оксида германия практически равна единице. Таким образом, даже при наличии взаимодействия на поверхности контакта образца и камеры в эффузионном эксперименте, давления компонентов газовой фазы GeO2 будут соответствовать равновесным. Тем не менее для исключения влияния возможного взаимодействия на величину определяемого коэффициента чувствительности по методу изотермического испарения [17] в предварительных и основном экспериментах проводили исследование образцов оксида германия, извлеченного из эффузионной камеры после высокотемпературного эксперимента по неполному испарению навески методами РФА и РФлА (рис. 2, табл. 2). На полученных дифрактограммах отсутствуют отражения примесных фаз, элементный анализ также не выявил примеси алюминия. Отсутствие заметного растворения GeO2 в материале камеры было установлено по постоянству массы эффузионной камеры, которую взвешивали на аналитических весах (Kern ABS 80-4, Германия) с точностью до 0.1 мг после каждого эксперимента. Согласно полученным результатам, взаимодействие GeO2 с алундом не происходило, что, вероятно, обусловлено кинетическими факторами, такими как скорости диффузии, скорость твердофазной реакции, состоянием и площадью контактной поверхности – поверхность алундовой камеры имеет низкую шероховатость и высокую плотность, как следствие, низкую реакционную способность. Результатом действия совокупности этих факторов было отсутствие сторонних фаз и загрязнений исследуемых образцов и камеры в количестве, обнаруживаемом использованными методами анализа. Таким образом, в данном случае взаимодействием GeO2 с материалом камеры можно обоснованно пренебречь.
Таблица 2.
Результаты РФлА образца GeO2 после высокотемпературного масс-спектрального эксперимента с использованием алундовой камеры Кнудсена
| Номер пробы | Содержание, мас. % | |
|---|---|---|
| Ge | Fe | |
| 1 | 99.98 | 0.02 |
| 2 | 99.96 | 0.04 |
| 3 | 99.98 | 0.02 |
| 4 | 99.98 | 0.02 |
| 5 | 99.98 | 0.02 |
| 6 | 99.97 | 0.03 |
| 7 | 99.98 | 0.02 |
| 8 | 99.98 | 0.02 |
| 9 | 99.97 | 0.03 |
| 10 | 99.96 | 0.04 |
| Среднее значение | 99.97 ± 0.01 | 0.03 ± 0.01 |
Навеску полученного нами чистого порошка GeO2(t) после отжига помещали в эффузионную камеру для исследования процессов парообразования GeO2. Эффузионный эксперимент состоял из нескольких стадий. На первой стадии исследовали температурные зависимости парциальных давлений (ионных токов масс-спектра) газовой фазы GeO2(t) в интервале 1250–1300 K. Затем температуру повышали до 1370 K и проводили изотермическую выдержку. На этой стадии происходило образование гексагональной кристаллической модификации. Стабилизация сигнала ионного тока свидетельствовала о завершении процесса полиморфного превращения. На третьей стадии исследовали температурные зависимости парциальных давлений компонентов пара над GeO2 гексагональной модификации. Таким образом, было получено двенадцать температурных зависимостей – шесть для тетрагональной и шесть для гексагональной модификации. Константу чувствительности прибора определяли по массе испарившейся навески за время всего эффузионного эксперимента. РФА остатков после эффузионного эксперимента показал наличие закаленной высокотемпературной гексагональной модификации GeO2 (рис. 2). Что согласуется с данными работ о полиморфизме GeO2.
В масс-спектре газовой фазы над GeO2(h) при Т = 1374 К и энергии ионизирующих электронов 75 эВ были обнаружены ионы Ge+ (0.3), GeO+ (1.0), GeO$_{2}^{ + }$ (0.001) и O$_{2}^{ + }$ (в скобках приведены относительные интенсивности ионных токов). Ионный ток GeO$_{2}^{ + }$ был зафиксирован только при наивысшей температуре измерений и отсутствовал в измеряемом масс-спектре при более низких температурах. Поскольку для оксидов не характерно отсутствие молекулярных ионов (образованных в результате прямой ионизации соответствующего молекулярного предшественника), в масс-спектре при наличии только осколочных ионов (образованных путем диссоциативной ионизации молекул) [17] считали, что весь ионный ток GeO+ обусловлен прямой ионизацией молекул GeO. Методом исчезающего ионного тока была определена энергия появления ионов Ge+ (14.4 ± 0.2 эВ) и GeO+ (10.2 ± 0.2 эВ), в качестве стандарта использовали ион Hg+ (10.4 ± 0.2 эВ). Полученная величина энергии появления иона Ge+ значительно превосходит энергию ионизации атома Ge (7.9 ± 0.1 эВ) [18], следовательно, ион Ge+ является осколочным и образуется в результате диссоциативной ионизации молекул GeO(г). Таким образом, была проведена расшифровка регистрируемых масс-спектров газовой фазы GeO2(h) и аналогично – для GeO2(t). В соответствии с этим газовая фаза над обеими модификациями GeO2(тв) представлена молекулами GeO, O2 и незначительным количеством GeO2.
Постоянство ионных токов при изотермической выдержке и отсутствие нелетучего остатка в предварительных экспериментах по полному изотермическому испарению GeO2(t) и GeO2(h) соответствовали конгруэнтному характеру парообразования оксида германия главным образом по реакции (1), что согласуется с данными работ [5–8].
(1)
${\text{Ge}}{{{\text{O}}}_{{{\text{2}}\left( {{\text{тв}}} \right)}}} = {\text{Ge}}{{{\text{O}}}_{{\left( {\text{г}} \right)}}} + 0.5{{{\text{O}}}_{{{\text{2}}\left( {\text{г}} \right)}}}$Парциальное давление GeO было рассчитано по формуле:
(2)
$p\left( {{\text{GeO}}} \right) = k(\gamma _{{{\text{Ge}}{{{\text{O}}}^{ + }}}}^{{ - 1}}{{I}_{{{\text{Ge}}{{{\text{O}}}^{ + }}}}} + \gamma _{{{\text{G}}{{{\text{e}}}^{ + }}}}^{{ - 1}}{{I}_{{{\text{G}}{{{\text{e}}}^{ + }}}}})T,$(3)
$({{p}_{{{\text{GeO}}}}}{\text{/}}\sqrt {{{M}_{{{\text{GeO}}}}}} ){\text{/}}({{p}_{{{{{\text{O}}}_{2}}}}}{\text{/}}\sqrt {{{M}_{{{{{\text{O}}}_{2}}}}}} ) = 2.$В табл. 3 представлены величины парциальных давлений компонентов в условиях эффузии и в минимуме общего давления.
Таблица 3.
Парциальные и общее давления компонентов газовой фазы над GeO2 в условиях эффузионного эксперимента и минимума общего давления
| Кристаллическая модификация | T, K | Условие сублимации | Давление p, Па | |||||
|---|---|---|---|---|---|---|---|---|
| Эксперимент | Рекомендованные значенияа | |||||||
| GeO | O2 | общее | GeO | O2 | общее | |||
| Тетрагональная | 1274 | Эффузия | 0.061 | 0.018 | 0.079 | 0.953 | 0.286 | 1.240 |
| Минимум | 0.051 | 0.026 | 0.077 | 0.804 | 0.402 | 1.206 | ||
| Гексагональная | 1334 | Эффузия | 0.365 | 0.110 | 0.475 | 5.703 | 1.714 | 7.417 |
| Минимум | 0.308 | 0.154 | 0.462 | 4.813 | 2.406 | 7.219 | ||
| Гексагональная | 1375 | Эффузия | 1.041 | 0.313 | 1.354 | 16.266 | 4.887 | 21.153 |
| Минимум | 0.879 | 0.439 | 1.318 | 13.726 | 6.863 | 20.589 | ||
а Парциальные давления вычислены на основании экспериментальных данных с использованием коэффициента испарения, определенного в работе [11].
В результате линейной аппроксимации и усреднения были получены уравнения температурных зависимостей парциальных давлений компонентов газовой фазы, равновесной с различными модификациями GeO2.
GeO2(t), 1250–1300 K:
GeO2(h), 1320–1370 K:
Энтальпии сублимации тетрагональной и гексагональной кристаллических модификаций GeO2 были найдены по 2-му и 3-му законам термодинамики (табл. 1, 4).
Таблица 4.
Пример расчета энтальпии реакции парообразования GeO2(t) по 3-му закону в температурной зависимости № 3
| T, K | $K_{p}^{^\circ }$ | $ - \Delta \frac{{G_{T}^{^\circ } - H_{{298}}^{^\circ }}}{T}$, Дж моль–1 K−1 | ${{\Delta }_{r}}H_{{298}}^{^\circ }$, Дж моль–1 |
|---|---|---|---|
| 1299.1 | 4.64 × 10−8 | 271.12 | 540.47 |
| 1289.1 | 2.98 × 10−8 | 271.20 | 541.19 |
| 1279.0 | 1.83 × 10−8 | 271.28 | 542.29 |
| 1268.9 | 1.12 × 10−8 | 271.36 | 543.33 |
| 1258.9 | 6.84 × 10−9 | 271.43 | 544.36 |
| 1253.9 | 5.38 × 10−9 | 271.47 | 544.76 |
| 1263.9 | 9.20 × 10−9 | 271.40 | 543.35 |
| 1274.0 | 1.42 × 10−8 | 271.32 | 542.91 |
| 1284.0 | 2.35 × 10−8 | 271.24 | 541.69 |
| 1294.1 | 3.54 × 10−8 | 271.16 | 541.38 |
| Среднее значение | 542.57 ± 1.01 | ||
Следует пояснить, что расчет по 3-му закону основывается на уравнении Вант-Гоффа для химического равновесия [9, 17]:
Экспериментально полученные температурные зависимости константы равновесия реакции (1) позволили выполнить расчет энтальпии реакции парообразования GeO2 по 2-му закону, в соответствии с уравнением:
Для пересчета найденных значений энтальпий к температуре 298 K были использованы справочные данные ТСИВ [9]. Существенное отличие полученных значений энтальпии реакции (1) с величинами, рассчитанными по данным базы ТСИВ (табл. 1), было интерпретировано нами как результат установления в камере не равновесного, а стационарного состояния, обусловленного низкой скоростью испарения GeO2. То есть, измеренные в экспериментах давления компонентов газовой фазы имели заниженные по сравнению с равновесными значения. Поэтому полученные данные были пересчитаны к равновесным условиям на основании уравнения Мотцфельда [19] и определенного в работе [11] коэффициента испарения α GeO2. При этом принимали α независимым от температуры и полагали относительную погрешность u(α) = 100%. Полученные значения парциальных давлений считали рекомендованными (табл. 3). Сравнение энтальпий реакции (1), рассчитанных на основании экспериментального и рекомендованного наборов давлений по 2-му и 3-му законам термодинамики, приведены в табл. 1. Следует отметить, что принятое в нашей работе приближение независимости α GeO2 от температуры приводит к сохранению наклонов линейных функций ln(Kp) от 1/Т, и, следовательно, применяемая коррекция давлений не сказывается на величинах энтальпии реакции (1), рассчитанных по 2-му закону термодинамики. При этом из данных табл. 1 видно, что энтальпии реакции (1), рассчитанные с использованием рекомендованных давлений по 3-му закону термодинамики, хорошо согласуются со справочными данными [9], что делает оправданной проведенную коррекцию давлений. Таким образом, только энтальпии, рассчитанные по 3-му закону термодинамики, были приняты рекомендованными в данной работе.
Энтальпия полиморфного превращения GeO2, рассчитанная по 2-му и 3-му законам термодинамики при 298 K, составила 35.1 ± 73.9 и 25.7 ± ± 20.1 кДж моль–1 (рекомендованное значение) соответственно. Рекомендованное значение энтальпии фазового перехода удовлетворительно согласуется со справочным значением (21.5 ± ± 1.7 кДж моль–1) [9].
На основании величин стандартной энтальпии реакции (1) были вычислены значения энтальпии образования GeO(г) (табл. 1). Полученные значения были объединены с данными из [4, 5, 7] и подвергнуты процедуре оценки грубых промахов по критерию Граббса [20]. В результате величины из работ [5] и [7] были исключены из выборки, и рассчитано рекомендованное среднее значение, которое удовлетворительно согласуется со справочными данными ТСИВ (табл. 1).
Достигнутое согласование энтальпий рассматриваемых реакций с величинами термодинамической базы ТСИВ в результате проведенного пересчета парциальных давлений компонентов газовой фазы GeO2 к равновесным условиям подчеркивает исключительную важность обеспечения насыщения пара в эффузионной камере. Главным недостатком примененного подхода является принятие независимости коэффициента испарения от температуры. На примере данной работы продемонстрирована настоятельная потребность в исследованиях скоростей парообразования и определения коэффициентов испарения для труднолетучих оксидов в широких температурных интервалах.
ЗАКЛЮЧЕНИЕ
Впервые в рамках одного высокотемпературного масс-спектрометрического эксперимента последовательно изучены низкотемпературная и высокотемпературная полиморфные модификации оксида германия. В результате проведенного исследования были определены состав газовой фазы и абсолютные значения парциальных давлений компонентов пара над тетрагональной и гексагональной кристаллическими модификациями GeO2. Рассчитаны равновесные парциальные давления с привлечением литературных данных по коэффициенту испарения GeO2. На основании полученной по 3-му закону термодинамики стандартной энтальпии парообразования GeO2 рассчитаны стандартная энтальпия полиморфного превращения GeO2 и стандартная энтальпия образования GeO(г). Найденные значения удовлетворительно согласуются с результатами некоторых экспериментальных работ и данными термодинамической базы ТСИВ.
Список литературы
Murad S.N.A., Baine P.T., McNeill D.W., Mitchell S.J.N., Armstrong B.M., Modreanu M., Hughes G., Chellap-pan R.K. // Solid-State Electron. 2012. V. 78. P. 136. https://doi.org/10.1016/j.sse.2012.05.048
Choudhury A., Dalal A., Dwivedi S.M.M.D., Ghosha A., Halder N., Das S., Mondal A. // Mater. Res. Bull. 2021. V. 142. P. 111397. https://doi.org/10.1016/j.materresbull.2021.111397
Micoulaut M., Cormier L., Henderson G.S. // J. Phys.: Condens. Matter. 2006. V. 18. № 45. P. R753. https://doi.org/10.1088/0953-8984/18/45/R01
Давыдов В.И. // ЖНХ. 1957. Т. 2. С. 1460.
Shimazaki E., Matsumoto N., Niwa K. // N. Bull. Chem. Sot. Jpn. 1957. V. 30. P. 969. https://doi.org/10.1246/bcsj.30.969
Sasamoto T., Kobayashi M., Sata T. Characterization of High Temperature Vapors and Gases. In: Hastie J.W. (Ed.) Proceedings of the 20th Materials Research Symposium Held at the National Bureau of Standards, September 18–22, 1978, Gaithersburg, Maryland. Issued October 1979. V. 1. P. 283.
Sasamoto T., Kobayashi M., Sata T. // Shitsuryo Bunseki. 1981. V. 29. № 3. P. 249. https://doi.org/10.5702/massspec.29.249
Drowart J., Degrève F., Verhaegen G., Colin R. // J. Chem. Soc. Faraday Trans. 1965. V. 61. P. 1072. https://doi.org/10.1039/TF9656101072
Глушко В.П., Гурвич Л.В., Бергман Г.А., Вейц И.В., Медведев В.А., Хачкурузов Г.А., Юнгман В.С. Термодинамические свойства индивидуальных веществ. Т. 2. Кн. 1, 2. М.: Наука, 1979.
Baret G., Madar R., Bernard C. // J. Electrochem. Soc. 1991. V. 138. № 9. P. 2830. https://doi.org/10.1149/1.2086066
Столярова В.Л., Амброк А.Г., Николаев Е.Н., Семенов Г.А. // Физика и химия стекла. 1977. Т. 3. № 6. С. 635.
Bielz T., Soisuwan S., Kaindl R., Tessadri R., Többens D.M., Klötzer B., Penner S. // J. Phys. Chem. C. 2011. V. 115. № 19. P. 9706. https://doi.org/10.1021/jp202457b
Kamitsos E.I., Yiannopoulos Y.D., Karakassides M.A., Chryssikos G.D., Jain H. // J. Phys. Chem. 1996. V. 100. № 28. P. 11755. https://doi.org/10.1021/jp960434+
Drowart J., Chatillon C., Hastie J., Bonnell D. // Pure Appl. Chem. 2005. V. 77. № 4. P. 683. https://doi.org/10.1351/pac200577040683
Roki F.Z., Chatillon C., Ohnet M.N., Jacquemain D. // J. Chem. Thermodynamics. 2008. V. 40. № 3. P. 401. https://doi.org/10.1016/j.jct.2007.09.013
Miller J.L. jr., McCormick G.R., Ampian S.G. // J. Am. Ceram. Soc. 1967. V. 50. № 5. P. 268. https://doi.org/10.1111/j.1151-2916.1967.tb15102.x
Сидоров Л.Н., Коробов М.В., Журавлева Л.В. Масс-спектральные термодинамические исследования. М.: Изд-во Моск. ун-та, 1985. 208 с.
Kessler T., Brück K., Baktash C., Beene J.R., Geppert Ch., Havener C.C., Krause H.F., Liu Y., Schultz D.R., Stracener D.W., Vane C.R., Wendt K. // J. Phys. B: At. Mol. Opt. Phys. 2007. V. 40. P. 4413. https://doi.org/10.1088/0953-4075/40/23/002
Евсеев А.М., Воронин Г.Ф. Термодинамика и структура жидких металлических сплавов. М.: Изд-во Моск. ун-та, 1966. 131 с.
Grubbs F.E., Beck G. // Technometrics. 1972. V. 14. № 4. P. 847. https://doi.org/10.2307/1267134
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах