Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 501, № 1, стр. 14-19
Синтез и кристаллическая структура комплексов железа (II) и кобальта (III) с гетарилгидразоном на основе о-дифенилфосфинобензальдегида и 1-гидразинофталазина
Л. Д. Попов 1, *, С. А. Бородкин 1, В. В. Ткачев 2, А. Н. Утенышев 2, И. Н. Щербаков 1, академик РАН С. М. Алдошин 2
1 Южный федеральный университет
344006 Ростов-на-Дону, Россия
2 Институт проблем химической физики Российской академии наук
142432 Черноголовка, Московская обл., Россия
* E-mail: ldpopov@mail.ru
Поступила в редакцию 21.09.2021
После доработки 15.11.2021
Принята к публикации 19.11.2021
Аннотация
Взаимодействием 1-фталазинилгидразона о-дифенилфосфинобензальдегида (HL) с перхлоратами Fe(II) и Co(II) получены комплексы разного состава и строения: [Fe(HL)2](ClO4)2 · Н2О (1) и [CoL2](ClO4) · Н2О (2), несмотря на то, что использовались соли с одинаковым анионом. Причем при комплексообразовании происходит окисление иона Со2+ до Co3+. Строение комплексов установлено при помощи ЯМР-спектроскопии в растворе и РСА в кристалле. Как показал РСА, ионы металлов-комлексообразователей имеют октаэдрическое строение. Соединение 2 образует две независимые молекулы в кристалле.
Гетарилгидразоны – продукты конденсации гетероциклических гидразинов и карбонильных соединений – являются популярными полифункциональными системами в современной бионеорганической медицинской, координационной, аналитической химии [1]. Они обладают разнообразной биологической активностью [2], высокой комплексообразующей способностью [3], сенсорными [4], электрохимическими свойствами [5] и т.д.
Гидралазин – гидрохлорид 1-гидразинофталазина – хорошо известен в качестве гипотензивного препарата, снижающего артериальное давление [6]. Гидразоны 1-гидразинофталазина также обладают выраженной биологической активностью [7] и способны образовывать моно- и полиядерные металлокомплексы [8–10]. В настоящей работе в качестве карбонильной компоненты для синтеза гидразона был выбран о-дифенилфосфинобензальдегид, производные которого с N-нуклеофилами образуют устойчивые комплексы, используемые в катализе [11]. Координационные соединения железа (II) и кобальта (II) обладают интересными магнитными свойствами и спин-кроссовером [12, 13]. В связи с этим цель работы заключалась в исследовании комплексообразующей способности продукта конденсации о-дифенилфосфинобензальдегида и 1-гидразинофталазина (HL) по отношению к ионам железа (II) и кобальта (II).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
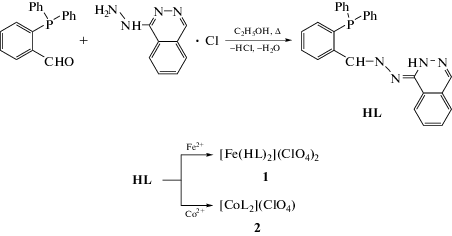
При взаимодействии о-дифенилфосфинобензальдегида с хлоргидратом 1-гидразинофталазина в этаноле при кипячении в присутствии ацетата натрия образуется гидразон (HL) [11] (схема 1).
Реакция гексагидратов перхлоратов железа (II) и кобальта (II) с HL в метаноле (схема 1) ведет к формированию комплексных соединений 1 и 2. В ИК-спектре комплекса 1, по сравнению со спектром лиганда, происходит небольшое смещение полосы поглощения валентных колебаний N–H-группы (приблизительно на 50 см−1 в высокочастотную область), что свидетельствует об образовании молекулярного комплекса. Наличие широкой высокоинтенсивной полосы поглощения в области 1050–1150 см−1 указывает на присутствие в комплексе 1 перхлорат-иона, а присутствие молекул воды подтверждается наличием широкой полосы поглощения в области ∼3500 см−1. ИК-спектр комплекса 2 аналогичен спектру комплекса 1, за исключением отсутствия полосы поглощения, соответствующей валентным колебаниям N−H-группы.
Образование молекулярного комплекса 1 подтверждается и данными 1Н ЯМР-спектроскопии: в спектре присутствует сигнал от NH-протона в области 13.66 м. д. (сигнал сдвинут на 1.74 м. д. в область слабого поля, по сравнению со спектром лиганда) в виде широкого синглета, что свидетельствует о его вовлечении в образование водородной связи. В 1Н ЯМР-спектре кобальтового комплекса 2 сигнал от NH-протона отсутствует, а узкие сигналы свидетельствуют об образовании низкоспинового комплекса Co в степени окисления 3+. Возможность исследовать комплексы 1 и 2 методом 1Н ЯМР‑спектроскопии свидетельствует об их диамагнетизме.
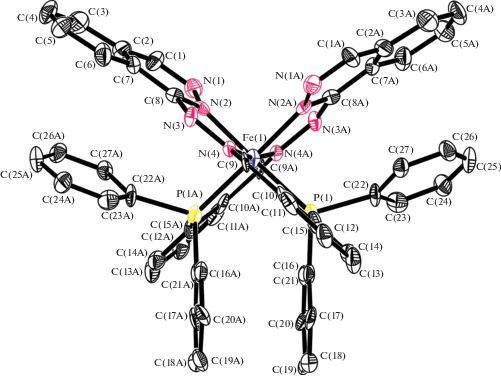
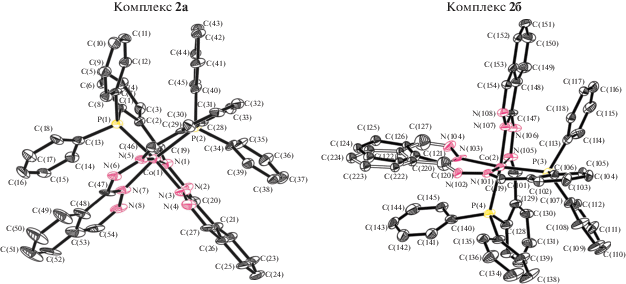
Строение комплексов 1 и 2 установлено на основании данных РСА. Общий вид комплексов железа и кобальта (две независимые молекулы) представлены на рис. 1 и 2 соответственно.
Рис. 2.
Общий вид двух независимых молекул комплекса 2: 2а и 2б (атомы водорода опущены для ясности). В комплексе 2а одно из бензольных колец разупорядочено (разупорядоченный фрагмент изображен прозрачными связями).
Ионы металлов железа и кобальта имеют октаэдрическое строение, представленное на рис. 3.
Рис. 3.
Октаэдрическое строение координационного полиэдра металла-комплексообразователя в 1 и двух независимых молекулах 2а,б.
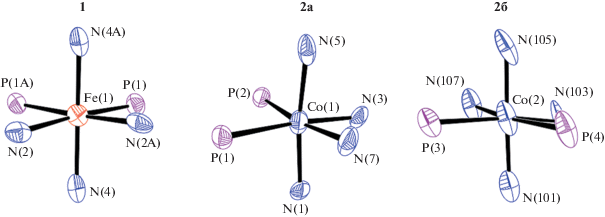
В структурах обоих комплексов присутствует π-стэкинговое взаимодействие ароматических колец с реализацией расстояний между ближайшими атомами углерода соседних колец в интервале расстояний 3.60–3.66 Å. Основные геометрические параметры координационных узлов 1 и 2 приведены в табл. 1.
Таблица 1.
Основные геометрические параметры координационных полиэдров металла-комплексообразователя для 1 и 2
| 1 | 2а | 2б | |||
|---|---|---|---|---|---|
| Связь | Длина связи, Å | Связь | Длина связи, Å | Связь | Длина связи, Å |
| Fe(1)−N(4) | 1.936(10) | Co(1)−N(5) | 1.906(6) | Co(2)−N(105) | 1.919(7) |
| Fe(1)−N(2) | 2.005(10) | Co(1)−N(1) | 1.913(6) | Co(2)−N(107) | 1.922(6) |
| Fe(1)−P(1) | 2.269(4) | Co(1)−N(3) | 1.914(6) | Co(2)–N(101) | 1.928(6) |
| Co(1)−N(7) | 1.930(6) | Co(2)−N(103) | 1.959(6) | ||
| Co(1)−P(1) | 2.2664(19) | Co(2)−P(4) | 2.278(2) | ||
| Co(1)−P(2) | 2.2839(19) | Co(2)−P(3) | 2.282(2) | ||
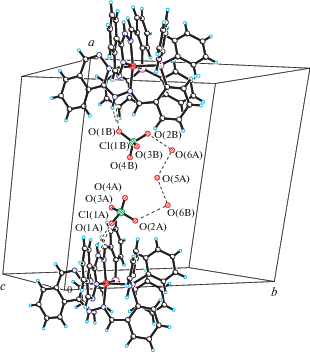
В кристаллической структуре комплекса 1 предполагаемые молекулы кристаллизационной воды возможно образуют сложную систему межмолекулярных связей типа O–H…O, представленных на рис. 4. При этом молекула воды O(5A)H2 участвует в образовании двух таких межмолекулярных водородных связей с двумя молекулами кристаллизационной воды O(6A)H2 и O(6В)H2. Расстояние между атомами O(5A)…O(6A) равно 2.507(8) Å. В свою очередь возможные молекулы кристаллизационной воды O(6A)H2 и O(6В)H2 участвуют в межмолекулярных водородных связях с атомами кислорода двух перхлоратных групп соответственно: O(2A)…O(6B) = 2.921(7) Å.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Комплекс 1. К кипящей суспензии 0.100 г (0.23 ммоль) HL [11] в 5 мл метанола приливали раствор 0.061 г (0.23 ммоль) гексагидрата перхлората железа (II) в 5 мл метанола. Полученный раствор темно-коричневого цвета кипятили 3 ч. Выпавший кристаллический продукт красного цвета отфильтровали, промыли метанолом и высушили в вакууме. Выход 0.070 г (54.0%). ИК-спектр, (ν, см–1): 3498 ш. с, 3284 ср, 1620 ср, 1577 с, 1539 ср, 1504 ср, 1481с, 1263 с, 1238 ср, 1172 ср, 1050–1150 ш. о.с, 998 с, 931 ср, 855 сл, 809 сл, 752 с, 698 с, 662 сл, 627 с, 602 ср, 532 ср, 503 сл. 1Н ЯМР (δ, м. д.): 13.66 (ш. с, 1H, NH), 9.74 (с, 1H, CH=N), 8.87 (с, 1H, Наром), 8.18–6.43 (м, 18Н). Найдено, %: С 57.30; Н 3.80; Cl 6.00; Fe 5.10; N 10.00; P 5.70. Вычислено для C54H44Cl2FeN8O9P2, %: С 57.01; Н 3.90; Cl 6.23; Fe 4.91; N 9.85; P 5.45.
Комплекс 2. К кипящей суспензии 0.100 г (0.23 ммоль) HL в 5 мл метанола приливали раствор 0.084 г (0.23 ммоль) гексагидрата перхлората кобальта (II) в 5 мл метанола. Полученный раствор темно-коричневого цвета кипятили 3 ч. Выпавший кристаллический продукт темно-зеленого цвета отфильтровали, промыли метанолом и высушили в вакууме. Выход 0.084 г (71.1%). ИК (ν, см–1): 3522 ш. с, 1625 ср, 1586 ср, 1552 ср, 1502 с, 1484 с, 1315 ср, 1257 с, 1234 ср, 1169 ср, 1050−1150 ш. о.с, 1002 с, 927 ср, 853 сл, 756 с, 700 с, 663 сл, 623 с, 599 ср, 534 с, 490 ср. 1Н ЯМР (δ, м. д.): 9.33 (с, 1H, CH=N), 8.26–6.62 (м, 19Н). Найдено, %: С 62.10; Н 4.00; Cl 3.50; Co 6.00; N 11.10; P 5.80. Вычислено для C54H42ClCoP2N8O5, %: С 62.41; Н 4.07; Cl 3.41; Co 5.67; N 10.78; P 5.96.
Параметры элементарных ячеек кристаллов и трехмерный набор интенсивностей для соединений 1 и 2 получены на автодифрактометре Enraf-Nonius CAD-4 (MoKα-излучение, графитовый монохроматор; Нидерланды). Структуры расшифрованы прямым методом и уточнены полноматричным методом наименьших квадратов относительно F2 по программе SHELXL-97 [14] в анизотропном приближении для неводородных атомов.
Положения атомов водорода молекулярных комплексов были рассчитаны геометрически и далее уточнялись по модели “наездника”. Атомы водорода молекул кристаллизационной воды не локализованы, и поэтому обсуждаются образование и геометрия предполагаемых водородных связей (табл. 2).
Таблица 2.
Основные кристаллографические данные и характеристики эксперимента для соединений 1 и 2
| Соединение | 1 | 2 | ||
|---|---|---|---|---|
| Формула | C27H21ClFe0.5N4O5P | C54H40ClCoN8O4.75P2 | ||
| Номер ССДС | 2090270 | 2090345 | ||
| Молекулярный вес | 575.82 | 1033.26 | ||
| Температура, K | 150 | 150 | ||
| Длина волны | 0.71073 | 0.71073 | ||
| Сингония, простр. гр. | Моноклинная, C 1 2/c 1 | Триклинная, P −1 | ||
| Параметры элементарной ячейки | a = 18.013(3) | α = 90 | a = 15.7266(8) | α = 70.488(4) |
| a, b, c (Å), | b = 18.358(3) | β = 107.96(2) | b = 17.2391(7) | γ = 79.025(4) |
| α, β, γ (град.) | с = 16.205(3) | γ = 90 | c = 19.2565(8) | β = 76.027(4) |
| V, Å3 | 5097.7(16) | 4740.8(4) | ||
| Z; dc, г см–3 | 8, 1.501 | 1, 1.450 | ||
| Коэффициент поглощения | 0.533 | 0.546 | ||
| F(000) | 2368 | 2134 | ||
| Форма кристалла; размер, мм | Призма; 0.25 × 0.21 × 0.15 | Призма; 0.22 × 0.17 × 0.14 | ||
| Область сканирования, град. | 2.96−26.07 | 2.83−26.07 | ||
| Интервалы индексов | −22 ≤ h ≤ 21, −22 ≤ k ≤ 18, −18 ≤ l ≤ 20 | −18 ≤ h ≤ 19, −21 ≤ k ≤ 21, –19 ≤ l ≤ 23 | ||
| Независимых отражений; I > 2σ(I) | 8585/4904 [R(int) = 0.1500] | 35215/18659 [R(int) = 0.0711] | ||
| Число уточняемых параметров | 4904/0/353 | 18659/6/1273 | ||
| GOOF | 1.035 | 1.042 | ||
| Финальный R-фактор | R1 = 0.1541, wR2 = 0.2912 | R1 = 0.0970, wR2 = 0.1935 | ||
| Остаточная электронная плотность (min/max), e Å−3 | 0.730/−0.599 | 1.079/−0.814 | ||
Кристаллические структуры депонированы в Кембриджской Базе Структурных Данных, № CCDC 2090270 (1), 2090345 (2) и эти данные могут быть свободно получены по запросу на интернет-сайте: www.ccdc.cam.ac.uk/data_request/cif.
Элементный анализ выполнен на приборе Perkin–Elmer 240C (США).
Спектры ЯМР зарегистрированы на спектрометрах Bruker Avance 300 и 600 (рабочие частоты по ядрам 1Н – 300.13 МГц и 600.22 МГц; Германия). Значения химических сдвигов (δ, м. д.) определяли относительно остаточного сигнала растворителя дейтерированного ДМСО (1H 2.50 м. д.).
ИК-спектры регистрировали на приборе Varian Scimitar 1000 FT-IR (США) в вазелиновом масле в области 400–4000 см–1.
Таким образом, путем взаимодействия гетарилгидразона HL с перхлоратами железа (II) и кобальта (II) были получены диамагнитные соединения молекулярного (1) и внутрикомплексного (2) типов с октаэдрическим строением хелатного узла. В процессе образования комплекса 2 происходит окисление иона Co2+, скорее всего, за счет лигандной системы.
Список литературы
Shakdofa M.M.E., Shtaiwi M.H., Morsy N., Abdel-Rassel T.M.A. // Main Group Chem. 2014. V. 13. P. 87−218. https://doi.org/10.3233/MGC-140133
Suvarapu L.N., Seo Y.K., Baek S.O., Ammireddy V.R. // E-J. Chem. 2012. V. 3. № 9. P. 1288−1304. https://doi.org/10.1155/2012/534617
Попов Л.Д., Морозов А.Н., Щербаков И.Н., Туполо-ва Ю.П., Луков В.В., Коган В.А. // Усп. хим. 2009. Т. 78. № 7. С. 697−713. https://doi.org/10.1070/RC2009v078n07ABEH003890
Su X., Aprahamian I. // Chem. Soc. Rev. 2014. V. 43. № 6. P. 1963−1981. https://doi.org/10.1039/C3CS60385G
Lygaitis R., Getautis V., Grazulevicius J.V. // Chem. Soc. Rev. 2008. V. 37. № 4. P. 770−788. https://doi.org/10.1039/B702406C
Brunton L.L., Lazo J.S., Parker K. Goodman and Gilmans. The Pharmacological basis of therapeutics. New York, 2005. P. 860−862.
Hollo B., Magyari J., Živković-Radovanović V., Vuč-ković G., Tomić Z.D., Szilágyi I.M., Pokol G., Szécsé-nyi K.M. // Polyhedron. 2014. V. 80. P. 142−150. https://doi.org/10.1016/j.poly.2014.03.007
Попов Л.Д., Левченков С.И., Щербаков И.Н., Александров Г.Г., Старикова З.А., Луков В.В., Коган В.А. // ЖCХ. 2015. Т. 56. № 1. С. 109−114. https://doi.org/10.1134/S002247661501014X
Линко Р.В., Сокол В.И., Полянская Н.А., Рябов М.А., Страшнов П.В., Давыдов В.В., Сергиенко В.С. // ЖНХ. 2014. Т. 59. № 1. С. 28−36. https://doi.org/10.1134/S0036023614010094
Бурлов А.С., Власенко В.Г., Чальцев Б.В., Кощиенко Ю.В., Левченков С.И. // Коорд. химия. 2021. Т. 47. № 7. С. 391−423. https://doi.org/10.1134/S1070328421070010
Milenković M., Shcherbakov I.N., Popov L.D., Levchenkov S.I., Borodkin S.A., Alexandrov G.G. // Polyhedron. 2017. V. 121. P. 278−284. https://doi.org/10.1016/j.poly.2016.10.020
Pavlov A.A., Denisov G.L., Kiskin M.A., Nelyubina Yu.V., Novikov V.V. // Inorg. Chem. 2017. V. 56. № 24. P. 14759−14762. https://doi.org/10.1021/acs.inorgchem.7b02649
Tupolova Y.P., Shcherbakov I.N., Korchagin D.V., Tkachev V.V., Lebedev V.E., Popov L.D., Zakharov K.V., Vasiliev A.N., Palii A.V., Aldoshin S.M. // J. Phys. Chem. C. 2020. V. 124. № 47. P. 25957−25966. https://doi.org/10.1021/acs.jpcc.0c07552
Sheldrick G. // Acta Cryst. Sect. A. 2008. V. 64. P. 112−122. https://doi.org/10.1107/S0108767307043930
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах