Доклады Российской академии наук. Химия, науки о материалах , 2022, T. 506, № 1, стр. 20-28
Синтез 1-замещенных 3H-нафто[1,2,3-de]хинолин-2,7-дионов
С. А. Черненко 1, А. Л. Шацаускас 2, А. С. Костюченко 2, А. С. Фисюк 1, *
1 ФГАОУ ВО “Омский государственный технический университет”
644050 Омск, Россия
2 ФГАОУ ВО “Омский государственный университет
им. Ф.М. Достоевского”
644077 Омск, Россия
* E-mail: fisyuk@chemomsu.ru
Поступила в редакцию 30.06.2022
После доработки 19.10.2022
Принята к публикации 27.10.2022
- EDN: UIMZMQ
- DOI: 10.31857/S2686953522700145
Аннотация
Разработан способ получения 1-тозил-3H-нафто[1,2,3-de]хинолин-2,7-дионов, основанный на реакции N-(9,10-антрахинон-1-ил)хлорацетамида с p-толуолсульфинатом натрия. Установлено, что нуклеофильное замещение тозильной группы на азотистые и кислородные нуклеофилы протекает в мягких условиях. Реакцией этих соединений с аминами, фенолом, гидроксидом натрия, азидом натрия получены соответствующие 1‑замещенные 3Н-нафто[1,2,3-de]хинолин-2,7-дионы.
Ализарин и его производные являются структурной основой для большого количества красителей, пигментов и аналитических реагентов [1, 2]. К числу таких соединений относятся 1-амино-3H-нафто[1,2,3-de]хинолин-2,7-дионы, использующиеся как люминесцентные хемосенсоры для определения фторид- и ацетат-анионов [3], катионов Hg2+ [4], Ni2+ [5], Cu2+ [5, 6], а также флуоресцентных пигментов для окрашивания полимеров [7]. В их ряду найдены вещества, обладающие противовирусной активностью [8], являющиеся ингибиторами киназы 1, регулирующей сигнал апоптоза (ASK1) [9]. В структуру 1-амино-3H-нафто[1,2,3-de]хинолин-2,7-диона встроен фрагмент 3‑аминопиридин-2(1Н)-она, производные которого используются как красители в иммуноферментном анализе [10], для гистохимического окрашивания тканей [11], в синтезе более сложных соединений [12, 13], проявляют антиоксидантную активность [10].
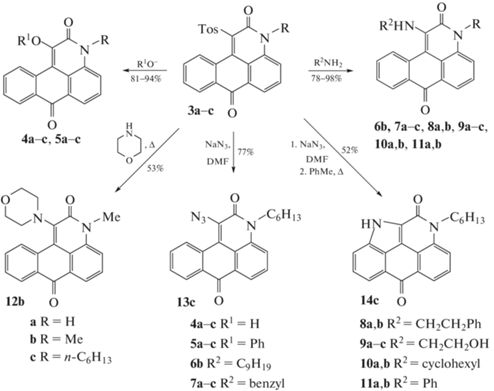
Для получения 3H-нафто[1,2,3-de]хинолин-2,7-дионов хорошо зарекомендовали себя два подхода: первый из них (а) основан на реакции Кэмпса [14–19], второй (б) – на нуклеофильном замещении галогена, нитрогруппы или сульфогруппы в положении 1 (схема 1) [3, 20–22]. Как правило, такие реакции протекают при длительном нагревании с невысокими выходами.
Замещение галогена на тозильную группу в соединениях 1a–c ранее не исследовалось. Мы изучили взаимодействие N-(9,10-антрахинон-1-ил)хлорацетамидов 1a–c c p-толуолсульфинатом натрия при нагревании в ДМФА. Оказалось, что промежуточно образующиеся тозилацетамиды 2а–с в условиях реакции подвергаются циклизации в ранее неизвестные сульфоны – 1‑тозил-3H-нафто[1,2,3-de]хинолин-2,7-дионы 3а–с, с выходами 80–92% (схема 2). Аналогично протекает взаимодействие p-толуолсульфината натрия с N-(3-оксоалкенил)хлорацетамидами [23, 24].
Связь C–S в сульфонах, как правило, устойчива к действию нуклеофилов. Однако, в нашем случае, замещение тозильной группы на гидроксил, азидогруппу или амин в соединениях 3a–c протекает очень легко (схема 3).
Большинство 1-замещенных 3Н-нафто[1,2,3-de]хинолин-2,7-дионов образуются при комнатной температуре. Реакция сульфона 3с с NaN3 заканчивается через час при пониженной температуре (0–5°C) с образованием азида 13с, который при нагревании в толуоле превращается в 9-гексил-1,9-дигидробензо[3, 4]изоиндоло[1,7,6-cde]хинолин-5,10-дион 14с (схема 3). В то время как замещение хлора, нитро- или сульфогруппы, как правило, требует нагревания [20–22, 25] (схема 1). Несколько труднее, при нагревании, протекает реакция соединений 3a–c с анилином, морфолином и фенолом (схема 3). Строение всех синтезированных соединений подтверждено данными элементного анализа, ИК- и ЯМР-спектроскопии (табл. 2, 3).
Таблица 1.
Условия реакции, температура плавления и выходы соединений 3–14
| Продукт | Реагенты | Растворитель, (мл) | Т, °C | Время, ч | Выход, % | Тпл., °C | |
|---|---|---|---|---|---|---|---|
| Найдено | Литературные данные | ||||||
| 3a | ДМФА (30) | 35 | 13 | 80 | >250 | – | |
| 3b | MeC6H4SO2Na | ДМФА (15) | 120 | 1 | 92 | >250 | – |
| 3c | ДМФА (35) | 90 | 2 | 85 | 234–236 | – | |
| 4a | ДМСО (1.5) | 16 | 82 | >250 | – | ||
| 4b | NaOH | ДМФА (1.5) | 25 | 5 | 81 | >250 | 299–300 [20] |
| 4c | ДМСО (1.5) | 16 | 89 | 184–186 | – | ||
| 5a | C6H5OH, K2CO3 (1 : 1) | 15 | 89 | >250 | 196–198 [16] | ||
| 5b | ДМСО (1.5) | 60 | 11 | 94 | >250 | – | |
| 5c | 10 | 90 | >250 | – | |||
| 6b | n-C9H19NH2 | 20–25 | 16 | 78 | 87–88 | – | |
| 7a | BnNH2 | 20–25 | 16 | 86 | >250 | 280–283 [15] | |
| 7b | 20–25 | 16 | 96 | 209–211 | – | ||
| 7c | 20–25 | 48 | 97 | 110–111 | – | ||
| 8a | PhCH2CH2NH2 | 20–25 | 16 | 93 | 225–226 | – | |
| 8b | 20–25 | 16 | 97 | 203–205 | – | ||
| 9a | HOCH2CH2NH2 | 20–25 | 16 | 79 | >250 | – | |
| 9b | 20–25 | 16 | 94 | 196–198 | – | ||
| 9c | 20–25 | 72 | 98 | 109–110 | – | ||
| 10a | С6Н11NН2 · · 0.5Н2СО3 | ДМСО (1.5) | 20–25 | 48 | 74 | >250 | 275–276 [22] |
| 10b | 20–25 | 48 | 83 | 179–181 | 176–178 [22] | ||
| 11a | PhNH2 | 95 | 20 | 68 | >250 | 279–280 [22] | |
| 11b | 95 | 13 | 75 | >250 | 281–281.5 [22] | ||
| 12b | O(CH2CH2)2NH | 85 | 7 | 53 | 195–197 | – | |
| 13c | NaN3 | ДМФА (1.5) | 0–5 | 1 | 77 | 118–120 | – |
| 14c | 52 | >250 | – | ||||
Таблица 2.
Данные ИК-спектроскопии и элементного анализа соединений 3–14
| Соединение | Волновое число, см–1 | Элементный анализ | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| C=O | NC=O | OH, (N3) | Найдено, % | Брутто-формула | Вычислено, % | |||||
| C | H | N | C | H | N | |||||
| 3a | 1648 | – | 68.88 | 3.73 | 3.45 | C23H15NO4S | 68.82 | 3.77 | 3.49 | |
| 3b | 1640 | 1662 | – | 69.45 | 4.07 | 3.33 | C24H17NO4S | 69.38 | 4.12 | 3.37 |
| 3c | 1643 | 1673 | – | 71.66 | 5.57 | 2.29 | C29H27NO4S | 71.73 | 5.60 | 2.28 |
| 4a | 1646 | 1666 | 3290 | 72.88 | 3.46 | 5.35 | C16H9NO3 | 73.00 | 3.45 | 5.32 |
| 4b | 1624 | 1655 | 3294 | 73.72 | 3.98 | 5.02 | C17H11NO3 | 73.64 | 4.00 | 5.05 |
| 4c | 1625 | 1650 | 3215 | 76.14 | 6.06 | 4.05 | C22H21NO3 | 76.06 | 6.09 | 4.03 |
| 5a | 1651 | 1657 | – | 77.98 | 3.84 | 4.15 | C22H13NO3 | 77.87 | 3.86 | 4.13 |
| 5b | 1656 | – | 78.07 | 4.31 | 3.94 | C23H15NO3 | 78.17 | 4.28 | 3.96 | |
| 5c | 1644 | 1657 | – | 79.50 | 5.91 | 3.32 | C28H25NO3 | 79.41 | 5.95 | 3.31 |
| 6b | 1627 | 1645 | – | 77.51 | 7.55 | 6.93 | C26H30N2O2 | 77.58 | 7.51 | 6.96 |
| 7a | 1648 | – | 78.29 | 4.60 | 7.93 | C23H16N2O2 | 78.38 | 4.58 | 7.95 | |
| 7b | 1631 | 1643 | – | 78.78 | 4.94 | 7.68 | C24H18N2O2 | 78.67 | 4.95 | 7.65 |
| 7c | 1622 | 1644 | – | 79.67 | 6.49 | 6.39 | C29H28N2O2 | 79.79 | 6.46 | 6.42 |
| 8a | 1649 | 1655 | – | 78.80 | 4.94 | 7.63 | C24H18N2O2 | 78.67 | 4.95 | 7.65 |
| 8b | 1634 | 1642 | – | 79.04 | 5.32 | 7.32 | C25H20N2O2 | 78.93 | 5.30 | 7.36 |
| 9a | 1638 | 1658 | 3316 | 70.49 | 4.59 | 9.20 | C18H14N2O3 | 70.58 | 4.61 | 9.15 |
| 9b | 1633 | 3314 | 71.14 | 5.05 | 8.78 | C19H16N2O3 | 71.26 | 5.00 | 8.74 | |
| 9c | 1645 | 3335 | 73.94 | 6.74 | 7.13 | C24H26N2O3 | 73.82 | 6.71 | 7.17 | |
| 10a | 1647 | – | 76.60 | 5.87 | 8.16 | C22H20N2O2 | 76.72 | 5.85 | 8.13 | |
| 10b | 1632 | 1646 | – | 77.19 | 6.21 | 7.80 | C23H22N2O2 | 77.07 | 6.19 | 7.82 |
| 11a | 1658 | – | 78.21 | 4.18 | 8.22 | C22H14N2O2 | 78.09 | 4.17 | 8.28 | |
| 11b | 1642 | – | 78.47 | 4.61 | 7.90 | C23H16N2O2 | 78.39 | 4.58 | 7.95 | |
| 12b | 1644 | – | 72.69 | 5.27 | 8.13 | C21H18N2O3 | 72.82 | 5.24 | 8.09 | |
| 13c | 1644 | 1656 | (2114) | 71.07 | 5.39 | 15.00 | C22H20N4O2 | 70.95 | 5.41 | 15.04 |
| 14c | 1631 | 1650 | – | 76.83 | 5.87 | 8.08 | C22H20N2O2 | 76.72 | 5.85 | 8.13 |
Таблица 3.
Данные ЯМР-спектроскопии соединений 3–14: химические сдвиги (δ, м. д.) и константы спин-спинового взаимодействия (J, Гц) в растворе CDCl3 или ДМСО-d6
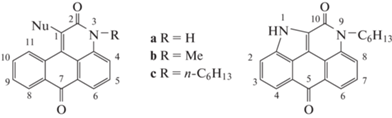 |
|||
|---|---|---|---|
| Соед. | 1Н ЯМР | 13С ЯМР | Р-ритель |
| 3a | 2.35 (с, 3H, CH3), 7.28 (д, 2H, 3J 7.70, MeC6H4), 7.56 (д, 1H, 3J 7.83, H-4), 7.73 (д, 2H, 3J 7.70, MeC6H4), 7.79–7.87 (м, 3H, H-5,10,9), 8.00 (д, 1H, 3J 7.04, H-6), 8.21 (м, 1H. H-11), 8.41 (м, 1H, H-8), 12.38 (c, 1H, CONH) | 21.0, 116.6, 120.9, 122.4, 126.6, 128.3, 128.5, 128.8, 131.2, 131.3, 131.7, 131.8, 132.7, 133.0, 134.8, 137.9, 138.6, 143.7, 144.7, 157.3, 182.7 | (CD3)2SO |
| 3b | 2.37 (с, 3H, CH3C6H4SO2), 3.55 (c, 3H, CH3), 7.30 (2H, д, 3J 7.92, MeC6H4SO2), 7.77 (д, 2H, 3J 7.92, MeC6H4), 7.82–7.95 (м, 4H, H-5,4,10,9), 8.12 (д, 1H, H-6), 8.24 (м, 1H, H-11), 8.46 (м, 1H, H-8) | 21.1, 29.9, 117.8, 120.8, 122.6, 126.5, 128.3, 128.6, 129.0, 131.0, 131.3, 131.6, 131.8, 132.8, 133.1, 134.8, 138.7, 138.8, 143.7, 156.8, 182.4 | |
| 3c | 0.79 (т, 3H, 3J 6.46, CH3C5H10), 1.05–1.13 (м, 6H, CH3C5H10), 1.35–1.42 (м, 2H, CH3C5H10), 2.32 (c, 3H, CH3), 4.12 (т, 2H, 3J 6.94, CH3C5H10), 7.26 (д, 2H, 3J 8.22, MeC6H4SO2), 7.71 (д, 2H, 3J 8.22, MeC6H4SO2), 7.84–7.94 (м, 4H, H-5,4,10,9), 8.06 (д, 1H, 3J 7.04, H-6), 8.18–8.20 (м, 1H, H-11), 8.37–8.39 (м, 1H, H-8) | 13.9, 21.0, 21.8, 25.4, 27.1, 30.9, 41.9, 117.8, 120.5, 122.6, 126.5, 128.3, 128.8, 128.9, 130.8, 131.2, 131.5, 131.9, 132.8, 133.1, 134.8, 137.8, 138.6, 143.3, 143.6, 156.7, 182.2 | |
| 4a | 3.59 (уш. c, 1H, OH), 7.59–7.68 (м, 3H, H-5,4,9), 7.83–7.87 (м, 1H, H-10), 8.13 (д, 1H, 3J 7.04, H-6), 8.38 (д, 1H, 3J 7.43, H-11), 9.22 (д, 1H, 3J 8.02, H-8), 12.46 (уш. c, 1H, CONH) | 109.6, 118.7, 119.9, 121.9, 126.4, 127.0, 126.9, 128.2, 128.9, 130.3, 131.9, 133.2, 133.6, 147.6, 157.9, 181.4 | |
| 4b | 3.09 (уш. c, 1H, OH), 3.87 (c, 3H, CH3), 7.64–7.74 (м, 2H, H-5,4), 7.85–7.92 (м, 2H, H-9,10), 7.80–7.96 (м, 2H, H-10,11), 8.24 (д, 1H, 3J 7.48, H-6), 8.40 (д, 1H, 3J 7.70, H-11), 9.22 (д, 1H, 3J 8.14, H-8) | 30.2, 108.7, 119.2, 119.3, 122.2, 126.5, 126.7, 127.21, 128.1, 128.9, 130.0, 133.1, 133.2, 133.3, 146.34, 157.78, 181.8 | |
| 4c | 0.92 (м, 3H, CH3C5H10), 1.31–1.43(м, 4H, CH3C5H10); 1.46–1.53(м, 2H, CH3C5H10), 1.78–1.86(м, 2H, CH3C5H10), 4.39 (д, 2H, 3J 7.73, CH3C5H10), 7.57–7.64 (м, 3H, H-5,4,9), 7.74–7.78 (м, 1H, H-10), 8.31–8.33 (д. д, 1H, 3J 5.87, 4J 2.35, H-6), 8.46 (д, 1H, 3J 7.83, H‑14), 8.87 (уш. с, 1H, OH), 9.05 (д, 1H, 3J 8.22, H-8) | 13.9, 22.5, 26.6, 27.7, 31.4, 44.2, 110.1, 118.8, 120.2, 124.0, 127.2, 127.7, 128.8, 128.9, 129.6, 130.8, 132.2, 133.3, 133.6, 144.4, 158.7, 182.4 | CDCl3 |
| 5a | 7.07–7.08 (м, 3H, C6H5), 7.31–7.34 (м, 2H, C6H5), 7.66–7.76 (м, 4H, H-4,5,9,10), 8.08 (д, 1H, 3J 7.24, H-6), 8.33 (д, 1H, 3J 7.24, H-11), 8.79(д, 1H, 3J 8.02, H-8), 12.56 (c, 1H, CONH) | 115.6, 117.0, 120.7, 122.08, 122.8, 125.3, 127.7, 127.8, 129.0, 129.6, 129.7, 130.6, 131.3, 132.0, 134.3, 135.5, 143.9, 155.9, 157.0, 181.5 | (CD3)2SO |
| 5b | 3.75 (с, 1H, CH3), 7.05–7.10 (м, 3H, C6H5), 7.30–7.36 (м, 2H, C6H5), 7.67–7.97 (м, 4H, H-4,5,9,10), 8.21–8.24 (м, 1H, H-6), 8.37 (дд, 1H, 3J 7.83, 4J 1.57, H‑11), 8.84 (дд, 1H, 3J 8.22, 4J 2.93, H-8) | 29.9, 115.4, 117.3, 119.6, 121.9, 122.3, 123.8, 127.1, 127.9, 128.7, 129.1, 129.2, 130.0, 130.9, 131.5, 133.6, 136.3, 142.8, 155.7, 156.4, 181.2 | |
| 5c | 0.89 (т, 3H, 3J–6.91, CH3C5H10), 1.27–1.38 (м, 4H, CH3C5H10), 1.41–1.48 (м, 2H, CH3C5H10), 1.75–1.83 (м, 2H, CH3C5H10), 4.37 (т, 2H, 3J 7.81, CH3C5H10), 7.06–7.13 (м, 3H, C6H5), 7.32–7.36 (м, 2H, C6H5), 7.61–7.80 (м, 4H, H-4,5,9,10), 8.39 (д, 1H, 3J 7.43, H-6), 8.52 (дд, 1H, 3J 7.53, 4J 1.66, H-11), 8.98 (д, 1H, 3J 8.02, H-8) | 13.9, 22.5, 26.6, 27.7, 31.4, 43.5, 115.9, 118.7, 119.0, 123.3, 125.0, 128.1, 129.4, 129.7, 129.8, 130.3, 131.6, 132.4, 134.2, 135.7, 143.7, 156.2, 157.4, 182.5 | CDCl3 |
| 6b | 0.84 (т, 3H, 3J 6.94, CH3C8H16), 1.17–1.24 (м, 12H, CH3C8H16), 1.51–1.58 (м, 2H, CH3C8H16), 2.96–3.01 (м, 2H, CH3C8H16), 3.86 (c, 3H, CH3), 6.22 (т, 1H, 3J 5.38, NH), 7.45–7.59 (м, 3H, H-4,5,9), 7.69–7.73 (м, 1H, H-10), 8.03 (д, 1H, 3J 8.02, H-6), 8.29 (дд, 1H, 3J 7.24, 4J 1.17, H-11), 8.41(дд, 1H, 3J 7.92, 4J 1.08, H-8) | 14.0, 22.5, 26.6, 29.1, 29.1, 29.3, 30.6, 30.7, 31.7, 49.4, 107.8, 117.8, 121.6, 123.0, 125.5, 127.3, 127.8, 128.0, 131.5, 132.0, 133.2, 134.5, 139.0, 160.7, 183.2 | CDCl3 |
| 7a | 4.28 (д, 2H, 3J 6.26, CH2), 6.99–7.19 (м, 5H, C6H5, NH), 7.08–7.19 (м, 3H, C6H5), 7.09 (т, 1H, 3J 6.36, NH), 7.51–7.62 (м, 3H, H-4,5,9), 7.85–7.89 (м, 1H, H-9), 8.01–8.03(дд, 1H, 3J 7.53, 4J 1.27, H-6), 8.15 (д, 1H, 3J 7.63, H-11), 8.28 (дд, 1H, 3J 7.92, 4J 1.27, H-8); 12.41 (c, 1H, CONH) | 51.3, 108.3, 119.3, 119.9, 121.5, 125.7, 126.7, 126.8, 127.3, 127.4, 127.5, 127.8, 128.3, 130.9, 131.8, 132.5, 134.2, 138.6, 139.0, 160.0, 181.9 | (CD3)2SO |
| 7b | 3.77 (c, 3H, CH3), 4.06 (д, 2H, CH2), 6.45 (т, 1H, 3J 5.67, NH), 7.03–7.05 (м, 2H, C6H5), 7.10–7.18 (м, 3H, C6H5), 7.41–7.49 (м, 3H, H-4,5,9), 7.62–7.66 (м, 1H, H-10), 8.10 (д, 1H, 3J 8.02, H-6), 8.19 (дд, 1H, 3J 6.85, 4J 1.96, H-11), 8.33 (дд, 1H, 3J 8.02, 4J 1.37, H-8) | 30.73, 53.10, 109.07, 117.91, 121.32, 123.01, 125.88, 127.44, 127.5, 127.6, 127.7, 127.9, 128.1, 128.3, 128.7, 131.6, 132.3, 133.4, 134.4, 138.07, 138.5, 160.6, 183.1 | |
| 7c | 0.91 (т, 3H, 3J 6.65, CH3C5H10), 1.36–1.37 (м, 4H, CH3C5H10), 1.47–1.51 (м, 2H, CH3C5H10), 1.79–1.86 (м, 2H, CH3C5H10), 4.19 (уш. c, 2H, CH2C6H5), 4.43 (т, 2H, 3J 7.53, CH3C5H10), 6.58 (уш. с, 1H, NH), 7.15–7.17 (м, 2H, C6H5), 7.21–7.29 (м, 3H, C6H5), 7.52–7.60 (м, 3H, H-4,5,9), 7.75 (т, 1H 3J 7.43, H-10), 8.26 (д, 1H, 3J 8.02, H-6), 8.32 (д, 1H, 3J 6.06, H-11), 8.45 (д, 1H, 3J 7.63, H-8) | 14.0, 22.5, 26.7, 27.7, 31.5, 43.7, 53.1, 109.2, 118.0, 121.6, 123.0, 125.9, 127.4, 127.7, 127.7, 128.0, 128.4, 128.7, 131.7, 132.3, 132.5, 134.5, 138.1, 138.6, 160.2, 183.3 | CDCl3 |
| 8a | 2.82 (т, 2H, 3J 6.75, C6H5CH2CH2NH), 3.35 (м, 2H, C6H5CH2CH2NH), 6.17 (т, 1H, 3J 6.06, NH), 7.10–7.15 (м, 3H, C6H5), 7.19–7.22 (м, 2H, C6H5), 7.50–7.63 (м, 3H, H-4,5,9), 7.67–7.72 (м, 1H, H-10), 8.08 (д, 1H, 3J 8.02, H-6), 8.30 (дд, 1H, 3J 7.34, 4J 1.27, H-11), 8.42 (дд, 1H, 3J 7.92, 4J 1.27, H-8), 12.42 (c, 1H, CONH) | 37.0, 49.8, 111.3, 119.9, 120.6, 123.3, 126.0, 126.5, 127.6, 127.7, 127.8, 127.9, 128.5, 128.8, 131.3, 131.8, 132.3, 134.0, 138.0, 138.6, 161.8, 183.0 | |
| 8b | 2.79 (т, 2H, 3J 6.93, C6H5CH2CH2NH), 3.31–3.36 (м, 2H, C6H5CH2CH2NH), 3.85 (c, 3H, CH3), 6.32 (т, 1H, 3J 5.92, NH), 7.03–7.10 (м, 3H, C6H5), 7.15–7.19 (м, 2H, C6H5), 7.49–7.53 (м, 1H, H-9), 7.55–7.57 (м, 2H, H‑4,5), 7.67–7.71 (м, 1H, H-10), 8.10 (дд, 1H, 3J 8.12, 4J 0.51, H-6), 8.31 (м, 1H, H-11), 8.42 (дд, 1H, 3J 7.92, 4J 1.27, H-8) | 30.6, 37.1, 50.1, 108.7, 117.8, 121.4, 123.0, 125.7, 126.4, 127.4, 127.5, 127.7, 128.0, 128.4, 128.7, 131.5, 132.2, 133.4, 134.4, 138.0, 138.7, 160.7, 183.2 | |
| 9a | 3.05–3.06 (м, 2H, NHCH2CH2OH), 3.46–3.47 (м, 2H, NHCH2CH2OH), 4.83 (т, 1H, 3J 4.60, OH), 6.92 (т, 1H 3J 5.38, NH), 7.51–7.62 (м, 3H, H-4,9,10), 7.84 (м, 1H, H-5), 8.01 (д, 1H, 3J 8.02, H-6), 8.05 (д, 1H, 3J 7.43, H-11), 8.28 (д, 1H, 3J 7.82, H-8), 12.42 (c, 1H, CONH) | 51.2, 60.0, 106.6, 119.2, 120.3, 121.5, 125.4, 126.7, 126.7, 127.1, 127.7, 130.8, 131.7, 132.3, 134.2, 140.3, 159.9, 181.9 | (CD3)2SO |
| 9b | 3.02–3.03 (м, 2H, NHCH2CH2OH), 3.43–3.47 (м, 2H, NHCH2CH2OH), 3.81 (c, 3H, CH3), 4.80 (т, 1H, 3J 5.18, OH), 6.99 (т, 1H, 3J 5.48, NH), 7.53–7.61 (м, 2H, H-9,10), 7.81–7.85 (м, 2H, H-4,5), 7.95 (дд, 1H, 3J 7.83, H-6), 8.11 (дд, 1H, 3J 7.63, 4J 0.98, H-11), 8.26 (дд, 1H, 3J 7.82, 4J 1.17, H-8) | 30.5, 51.2, 59.9, 105.4, 118.8, 121.1, 121.9, 125.4, 126.5, 126.7, 127.1, 127.7, 130.5, 132.4, 133.0, 134.1, 139.5, 159.6, 181.9 | |
| 9c | 0.84 (т, 3H, 3J 6.85, CH3C5H10), 1.24–1.33 (м, 4H, CH3C5H10), 1.38–1.41 (м, 2H, CH3C5H10), 1.65–1.72 (м, 2H, CH3C5H10), 3.02 (уш. с, 2H, NHCH2CH2OH), 3.43–3.47 (м, 2H, NHCH2CH2OH), 4.39 (т, 2H, 3J 7.53, CH3C5H10), 4.82 (т, 1H, 3J 4.70, OH), 7.00 (уш. с, 1H, NH), 7.53–7.57 (м, 1H, H-9), 7.59–7.63 (м, 1H, H-10), 7.81–7.87 (м, 2H, H-4,5), 7.97 (д, 1H, 3J 8.02, H-6), 8.13 (д, 1H, 3J 7.63, H-11), 8.26 (д, 1H, 3J 8.02, H-8) | 13.9, 22.0, 26.0, 27.2, 30.9, 42.8, 51.2, 59.9, 105.5, 118.8, 121.3, 121.9, 125.5, 126.5, 127.1, 127.1, 127.7, 130.5, 132.0, 132.4, 134.2, 139.4, 159.3, 182.0 | |
| 10a | 0.99–1.81 (м, 10H, C6H11), 3.28 (м, 1H, C6H11), 5.97 (д, 1H, 3J 10.55, NH), 7.51–7.60 (м, 2H, H‑9,5), 7.68–7.72 (м, 2H, H-4,10), 8.30 (дд, 1H, 3J 7.63, 4J 0.98, H-6), 8.35 (д, 3J 8.02, 1H, H-11) 8.40 (дд, 1H, 3J 8.02, 4J 1.37, H-8), 12.34 (уш. c, 1H, CONH) | 24.7, 25.5, 33.5, 55.5, 112.6, 120.0, 120.5, 123.4, 126.2, 127.5, 127.7, 127.9, 128.1, 131.4, 131.8, 132.1, 134.3, 137.6, 162.3, 183.1 | CDCl3 |
| 10b | 0.94–1.89 (м, 10H, C6H11), 3.31–3.40 (м, 1H, C6H11), 3.86 (c, CH3), 6.13 (д, 1H, 3J 10.17, NH), 7.49–7.60 (м, 3H, H-4,5,9), 7.68 (м, 1H, H-10), 8.30 (д, 1H, 3J 7.04, H-6), 8.35 (д, 1H, 3J 8.35, H‑11), 8.42 (д, 1H, 3J 7.82, H-8) | 24.6, 25.5, 30.8, 33.3, 55.2, 110.0, 117.9, 121.3, 123.0, 125.8, 127.3, 127.6, 127.7, 128.1, 131.5, 132.0, 133.5, 134.6, 137.5, 161.1, 183.2 | |
| 11a | 6.75–6.84 (м, 3H, C6H5), 7.00 (м, 2H, C6H5), 7.28–7.31 (м, 1H, H-9), 7.39–7.42 (м, 1H, H-5), 7.60–7.67 (м, 2H, H-10,4), 7.82 (д, 1H, 3J 8.22, H-6), 8.06 (д, 1H, 3J 7.24, H-11), 8.19 (д, 1H, 3J 7.83, H-8), 8.97 (c, 1H, NH), 12.58 (c, 1H, CONH) | 112.9, 118.0, 119.4, 119.8, 121.8, 122.0, 126.5, 126.9, 127.3, 127.8, 128.1, 128.5, 130.6, 131.6, 132.0, 132.8, 132.9, 140.5, 160.1, 182.2 | (CD3)2SO |
| 11b | 3.88 (c, 3H, CH3), 6.77 (т, 1H, 3J 7.34, C6H5), 6.83–6.85 (м, 2H, C6H5), 7.01 (м, 2H, C6H5), 7.29–7.33 (м, 1H, H-9), 7.39–7.43 (м, 1H, H-10), 7.71–7.75 (м, 1H, H-5), 7.84 (д, 1H, 3J 8.22, H‑4), 7.94 (д, 1H, 3J 8.02, H-6), 8.15–8.23 (м., 2H, H-8,11), 9.06 (c, 1H, NH) | 30.6, 111.5, 118.1, 119.5, 120.1, 122.1, 122.1, 126.3, 126.9, 127.7, 128.1, 128.5, 128.6, 130.2, 131.1, 132.1, 132.7, 134.2, 140.5, 159.9, 182.3 | |
| 12b | 3.28–3.36 (м, 4H, O(CH2CH2)2N), 3.70–3.95 (м, 7H, O(CH2CH2)2NH, CH3), 7.43–7.67 (м, 3H, H-5,4,9); 7.67–7.87 (м, 2H, H-6,10), 8.19 (дд, 1H, 3J 5.58, 4J 1.86, H-11), 8.36 (д, 1H, 3J 7.63, H-8) | 30.2, 52.3, 67.4, 117.7, 118.2, 122.1, 122.4, 127.0, 127.2, 127.5, 128.3, 128.5, 131.5, 132.6, 134.1, 135.4, 139.3, 162.4, 183.3 | CDCl3 |
| 13c | 0.93 (т, 3H, 3J 6.95, CH3C5H10), 1.32–1.44 (м, 4H, CH3C5H10), 1.48–1.56 (м, 2H, CH3C5H10), 1.78–1.86 (м, 2H, CH3C5H10), 4.35 (т, 3J–8.02, 2H, CH3C5H10), 7.59–7.69 (м, 3H, H-4,5,9), 7.75–7.79 (м, 1H, H-10), 8.28 (дд, 1H, 3J 7.43, 4J 0.98, H-6), 8.46 (дд, 1H, 3J 7.83, 4J 1.37, H-11), 9.38 (д, 1H, 3J 8.22, H-8) | 14.0, 22.6, 26.7, 27.6, 31.5, 44.2, 118.9, 119.2, 120.1, 123.6, 128.0, 128.7, 129.0, 129.9, 130.4, 131.3, 132.6, 133.4, 134.5, 158.2, 182.3 | |
| 14c | 0.87–0.88 (м, 3H, CH3C5H10), 1.28–1.45 (м, 6H, CH3C5H10), 1.72–1.75 (м, 2H, CH3C5H10), 4.37 (м, 2H, CH3C5H10), 7.63–7.95 (м, 6H, H-2,3,4,6,7,8) | 13.1, 21.4, 25.5, 27.7, 30.5, 41.7, 116.1, 116.2, 118.2, 118.6, 119.5, 121.4, 123.4, 125.2, 126.9, 127.3, 128.2, 130.1, 136.2, 137.8, 155.0, 183.0 | (CD3)2SO |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ИК-спектры записаны на спектрометре Infralum FT-801 (Россия) в таблетках KBr.
Спектры 1H и 13C ЯМР записаны на спектрометре Bruker AVANCE Instrument (Германия) на частотах 400 и 100 МГц для ядер 1H и 13C соответственно. Все спектры 13C ЯМР записаны в режиме J-модуляции.
Элементный анализ проведен на приборе Carlo Erba 1106 CHN (Италия). Температуры плавления всех твердых веществ определены на приборе Reach devices RD-MP (США). Протекание реакции и чистоту полученных продуктов контролировали при помощи метода тонкослойной хроматографии (ТСХ) на пластинах Sorbfil UV-254, которые проявляли УФ-светом (254, 365 нм). Все реагенты и растворители имеют аналитическую чистоту (Sigma-Aldrich Chemical Co).
N-(9,10-антрахинон-1-ил)хлорацетамиды 1a–c получены по ранее описанной методике [15].
Общая методика получения соединений 1-тозил-3H-нафто[1,2,3-de]хинолин-2,7-дионов 3a–c. Раствор 13.0 ммоль N-(9,10-антрахинон-1-ил)хлорацетамида 1a–c, 4.633 г (26.0 ммоль) p-толуолосульфината натрия, 0.166 г (1 ммоль) KI перемешивали при нагревании в течение времени, указанного в табл. 1, реакционную смесь выливали в воду, осадок отфильтровывали, промывали водой, горячим этилацетатом, а затем сушили. Получены чистые продукты 3a–c.
Общая методика получения соединений 4a–c, 5a–c, 10a,b, 13с. Раствор 0.25 ммоль сульфона 3a–c и 0.5 ммоль соответствующего реагента перемешивали в растворителе при указанных в табл. 1 условиях. В случае соединений 5a–c, в реакционную смесь добавляли 69 мг (0.5 ммоль) поташа. По окончании реакции массу выливали в воду, образующийся осадок отфильтровывали, промывали водой. Полученные соединения очищали колоночной хроматографией на силикагеле 5b,c, 10b, 13с (элюент CHCl3), 10a (элюент EtOH : : CHCl3 = 1 : 20), труднорастворимые продукты 4a–c, 5a промывали горячим этилацетатом и высушивали.
Общая методика получения соединений 6b, 7a–c, 8a,b, 9a–c, 11a,b, 12b. Смесь 0.25 ммоль сульфона 3a–c и 1.5 мл амина перемешивали при условиях, указанных в табл. 1. По окончании реакции массу выливали в 2M раствор HCl, выпавшие осадки 7–12 отфильтровывали, промывали водой, сушили на фильтре. Соединение 6b экстрагировали из водного раствора этилацетатом (3 × 10 мл), экстракт промывали раствором соды, а затем водой. Раствор продукта в этилацетате упаривали досуха. Соединения 6b, 11b, 12a,b дополнительно очищали колоночной хроматографией на силикагеле: 6b (элюент AcOEt : C6H6 = 1 : 8), 11a (элюент AcOEt : : CCl4 = 1 : 2), 11b (элюент CHCl3), 12b (элюент AcOEt : CHCl3 = 1 : 10)
Получение 9-гексил-1,9-дигидробензо[3,4]изо-индол[1,7,6-cde]хинолин-5,10-диона 14с. Из 121 мг (0.25 ммоль) соединения 3с и 17 мг (0.26 ммоль) NaN3 получали азид 13с, который без очистки колоночной хроматографией помещали в колбу, содержащую 15 мл толуола и кипятили 1 ч. Осадок отфильтровывали. Получено 45 мг (выход 52%) соединения 14с.
ЗАКЛЮЧЕНИЕ
Таким образом, нами разработан способ получения ранее неизвестных 1‑тозил-3H-нафто[1,2,3-de]хинолин-2,7-дионов, основанный на реакции N-(9,10-антрахинон-1-ил)хлорацетамида с p-толуолсульфинатом натрия. Реакцией этих соединений с аминами, фенолом, гидроксидом натрия, азидом натрия получены 1-замещенные 3Н-нафто[1,2,3-de]хинолин-2,7-дионы в мягких условиях.
Список литературы
Bien H.-S., Stawitz J., Wunderlich K. // Anthraquinone Dyes and Intermediates. Ullmann’s Encycl. Ind. Chem. 2000. V. 3. P. 514–578. https://doi.org/10.1002/14356007.a02_355
Venkataraman K., Iyer V.N. // Chem. Syn. Dyes. 1971. V. 5. P. 131–240. https://doi.org/10.1016/b978-0-12-717005-3.50010-3
Kumar S., Luxami V., Kumar A. // Org. Lett. 2008. V. 10. № 24. P. 5549–5552. https://doi.org/10.1021/ol802352j
Kumar A., Kumar S. // Tetrahedron Lett. 2012 V. 53. № 16. P. 2030–2034. https://doi.org/10.1016/j.tetlet.2012.01.134
Kumar A., Chae P.S., Kumar S.A. // Dyes Pigm. 2020. V. 174. P. 108092. https://doi.org/10.1016/j.dyepig.2019.108092
Kumar A., Vanita V., Walia A., Kumar S. // Sens. Actuators, B. 2013. V. 177. P. 904–912. https://doi.org/10.1016/j.snb.2012.11.093
Красовицкий Б.М., Болотин Б.М. // Органические люминофоры. Л.: Химия, 1976. 344 с.
Johnson M.R., Kang M.-C., Nemazany A.G., Rice K.C. // Benzanthrone compounds and antiviral uses thereof. WO1998039287. 1998.
Volynets G.P., Chekanov M.O., Synyugin A.R., Golub A.G., Kukharenko O.P., Bdzhola V.G., Yarmoluk S.M. // J. Med. Chem. 2011. V. 54. № 8. P. 2680–2686. https://doi.org/10.1021/jm200117h
Shatsauskas A., Shatalin Y., Shubina V., Zablodtskii Y., Chernenko S., Samsonenko A., Kostyuchenko A., Fisyuk A. // Dyes Pigm. 2021. V. 187. № 109072. https://doi.org/10.1016/j.dyepig.2020.109072
Shatsauskas A.L., Shatalin Y.V., Shubina V.S., Chernenko S.A., Kostyuchenko A.S., Fisyuk A.S. // Dyes Pigm. 2022. V. 204. P. 110388. https://doi.org/10.1016/j.dyepig.2022.110388
Kulakov I.V., Shatsauskas A.L., Matsukevich M.V., Palamarchuk I.V., Seilkhanov T.M., Gatilov Y.V., Fisyuk A.S. // Synthesis. 2017. V. 49. № 16. P. 3700–3709. https://doi.org/10.1055/s-0036-1590470
Shatsauskas A.L., Abramov A.A., Chernenko S.A., Kostyuchenko A.S., Fisyuk A.S. // Synthesis. 2020. V. 52. № 2. P. 227–238. https://doi.org/10.1055/s-0039-1690231
Фисюк А.С., Костюченко А.С., Гончаров Д.С. // ЖОрХ. 2020. V. 56. № 11. P. 1649–1679. https://doi.org/10.31857/S0514749220110014
Соколова М.С., Лаврикова Т.И., Горностаев Л.М. // ЖОрХ. 2007. Т. 43. № 4. С. 627–628. https://doi.org/10.1134/S1070428007040252
Etukala J.R., Yadav J.S. // Heteroat. Chem. 2008. V. 19. № 2. P. 221–227. https://doi.org/10.1002/hc.20399
Фисюк А.С., Кулаков И.В., Гончаров Д.С., Никити-на О.С., Богза Ю.П., Шацаускас А.Л. // ХГС. 2014, № 2. С. 241–249. https://doi.org/10.1007/s10593-014-1464-9
Fissyuk A.S., Vorontsova M.A., Temnikov D.V. // Tetrahedron Lett. 1996. V. 37. P. 5203–5206. https://doi.org/10.1016/0040-4039(96)01051-9
Fisyuk A.S., Poendaev N.V. // Molecules. 2002. V. 7. № 2. P. 124–128. https://doi.org/10.3390/70200124
Казанков М.В., Уфимцев В.Н. // ХГС. 1966. № 2. С. 315–316. https://doi.org/10.1021/jo01182a016
Allen F.H., Wilson C.V. // J. Org. Chem. 1945. V. 10. № 6. P. 594–602. https://doi.org/10.1021/jo01182a016
Садченко Л.С., Гудзенко В.И. // ЖОрХ. 1976 Т. 7. № 5. С. 1106–1109.
Гончаров Д.С., Костюченко А.С., Фисюк А.С. // ХГС. 2009. Т. 45. № 7. С. 1005–1007. https://doi.org/10.1007/s10593-009-0358-8
Гончаров Д.С., Кулаков И.В., Фисюк А.С. // ХГС. 2017. Т. 53. № 12. С. 1335–1339. https://doi.org/10.1007/s10593-018-2215-0
Красовицкий Б.М., Афанасиади Л.М. // Препаративная химия органических люминофоров. Х.: Фолио, 1997. 205 с.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах