Доклады Российской академии наук. Науки о жизни, 2020, T. 490, № 1, стр. 24-26
ХЕМОГЕНЕТИЧЕСКАЯ АКТИВАЦИЯ ГЛУТАМАТЕРГИЧЕСКИХ НЕЙРОНОВ КОРЫ ЮВЕНИЛЬНЫХ КРЫСЯТ СНИЖАЕТ ТРЕВОЖНОСТЬ
Член-корреспондент РАН Н. Н. Дыгало 1, 2, *, Д. А. Ланшаков 1, Н. П. Комышева 1, У. С. Дрозд 1, 2, Е. В. Шабурова 1, 2, Е. В. Сухарева 1, 2, Г. Т. Шишкина 1
1 Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской Академии наук
Новосибирск, Россия
2 Новосибирский национальный исследовательский государственный университет
Новосибирск, Россия
* E-mail: dygalo@bionet.nsc.ru
Поступила в редакцию 10.10.2019
После доработки 10.10.2019
Принята к публикации 10.10.2019
Аннотация
С помощью хемогенетической активации глутаматергических нейронов префронтальной коры ювенильных крысят впервые установлено, что активация этих нейронов ослабляет проявления психоэмоциональной тревожности в ювенильный период онтогенеза. Этот результат свидетельствует о возможности целенаправленного управления активностью нейронов начиная с ранних этапов формирования головного мозга.
Возможности исследования и управления функциями мозга, в том числе и выявления участия конкретных нейронов и их ансамблей в регуляции психоэмоционального состояния, качественно расширились методами постгеномной нейробиологии. Один из таких методов – хемогенетика [1] – позволяет селективно изменять активность необходимых исследователю нейронов. Метод основан на экспрессии в желаемом типе нервных клеток новых для организма белков-рецепторов, воспринимающих необычную для организма химическую молекулу лиганда, связывающуюся с этим рецептором. При поступлении к клетке сигнала, воспринимаемого её новым рецептором, в зависимости от молекулярных особенностей рецептора частота разрядов нейрона повышается или, наоборот, снижается, что позволяет исследовать функции этих нейронов и выяснять возможность коррекции регулируемых ими систем и поведения. Так, недавно повышением с помощью этого подхода активности глутаматергических нейронов коры удалось улучшить психоэмоциональное состояние взрослых мышей [2]. Вместе с тем выполняют ли эти нейроны подобную функцию у ювенильных животных, нейронные сети психоэмоциональной регуляции которых ещё находятся в стадии формирования [3], остается неясным. Интерес к этому вопросу обусловлен критическими для последующей функции центральной нервной системы процессами формирования мозга [4], а также пиком начала проявления тревожных расстройств у людей [5] в ювенильный – подростковый период онтогенеза. В связи с этим целью работы явилось выяснение участия глутаматергических нейронов префронтальной коры в регуляции проявлений тревожности ювенильных животных путём хемогенетического управления их активностью в этот период онтогенеза.
Хемогенетический (Gq), активирующий нейрон, и контрольный (Egfp) AAVвекторы собирали на основе приобретенных в депозитарии Addgene (США) плазмид (pAAV-CaMKIIa-hM3D(Gq)-mCherry и pAAV-CaMKIIa-Egfp соответственно), как это описано ранее [6]. Экспрессия обоих векторов управляется специфичным для глутаматергических нейронов промотором CaMKIIa. В экспериментах использовали крыс линии Вистар с соблюдением правил гуманного обращения с экспериментальными животными (приказ № 755 Министерства здравоохранения СССР от 12 августа 1977 г.). Двухдневным крысятам стереотаксически под холодовым наркозом в префронтальную кору каждого полушария вводили по 109 AAV частиц в объёме 1 мкл со скоростью 0.3 мкл/мин. Дополнительную контрольную группу составляли интактные животные. Группы из восьми крысят мужского пола вскармливались самками до 22-дневного возраста. Далее животных содержали по четыре особи в клетке в течение восьми дней до истечения в сумме четырёх недель от введения AAV в мозг, времени, необходимого для наработки белков, кодируемых вектором в трансфицированных клетках [6].
В ювенильном возрасте (1 месяц) животным с неонатальным введением в кору вектора Gq, кодирующего хемогенетический дизайнерский рецептор, активируемый исключительно дизайнерским препаратом DREADD (Designer Receptor Exclusively Activated by Designer Drugs), или контрольного вектора с последовательностью, кодирующей лишь флуоресцентный белок (Egfp), внутрибрюшинно вводили синтетический активирующий лиганд этого DREADD – Clozapine-N-oxide (CNO, Tocris, Англия) в дозе 3 мг/кг в объёме 0.5 мг/мл. Животным интактной группы (Интакт.) вводили эквивалентный объём физиологического раствора. Через 30 мин после введения препаратов животных помещали в центр светлой камеры тестовой установки, состоящей из двух камер (30 × 30 × 30 см каждая): одна – освещённая белая, а другая – тёмная чёрная, совмещённых по боковой грани, в центре которой имеется прилегающее к полу полуовальное отверстие, позволяющее животному свободно переходить из камеры в камеру. В течение 5 мин теста видеорегистрировали поведение животных.
Последующим анализом видеозаписей тестов эксперты, не знакомые с воздействиями, примененными к животным, определяли число переходов крысят между камерами, а также продолжительность их нахождения в светлой камере, воспринимаемой животными как угрожающая обстановка, степень избегания которой является общепринятым показателем проявления тревожности [7]. После завершения теста животных в состоянии глубокого наркоза транскардиально перфузировали, выделяли головной мозг и приготавливали срезы для выявления в нейронах префронтальной коры экспрессии векторов по флуоресценции содержащихся в их составе светящихся белков, как описано ранее [8].
Микрофотография, представленная на рис. 1, является первым свидетельством возможности получения заметного уровня экспрессии в коре ювенильных крысят хемогенетического рецептора после введения AAV вектора, кодирующего DREADD, в мозг неонатальных животных.
Рис. 1.
Репрезентативная микрофотография экспрессии хемогенетического AAV вектора (pAAV-CaMKIIa-hM3D(Gq)-mCherry – чёрная зернистость) в основной области его распространения (штриховой овал) в префронтальной коре правого полушария – а, б – межполушарное пространство, в – левое полушарие, в которое также вводили этот AAV вектор.
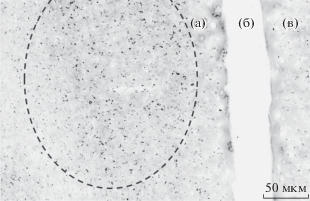
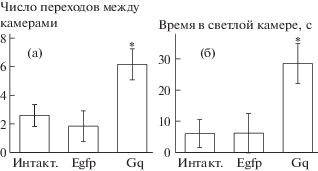
Достигнутый уровень экспрессии DREADD оказался достаточным для обусловленного хемогенетической активацией глутаматергических нейронов префронтальной коры снижения тревожности ювенильных животных. У крысят группы Gq, экспрессирующих DREADDs, активирующие глутаматергические нейроны их префронтальной коры после внутрибрюшинного введения CNO, число переходов между камерами (рис. 2а, F(2, 21) = 4.259; p < 0.028), свидетельствующее о большем числе выходов в опасную в восприятии животных светлую камеру, а также продолжительность нахождения в этой камере (рис. 2б, F(2, 21) = 4.098; p < 0.031) были значительно выше по сравнению с обеими контрольными группами. Животные с неонатальным введением в мозг AAV вектора, кодирующего лишь флуоресцентный белок Egfp, и получавшие перед тестом внутрибрюшинные инъекции CNO не различались по обоим показателям тревожности от интактных крысят, которым вместо CNO вводили физиологический раствор. Следовательно, ни введение вектора в мозг, ни лиганд DREADD сами по себе на поведение животных не влияли.
Рис. 2.
Поведенческие проявления ослабления психоэмоциональной тревожности в тесте светлая/темная камера в результате хемогенетической активации глутаматергических нейронов префронтальной коры ювенильных крыс. а – число переходов между камерами, б – время нахождения в светлой камере. Интакт. – + физиол. раствор; Egfp + CNO; Gq – DREADD + CNO. * p < 0.05 с группами, не экспрессирующими DREADD.
Формирование, извлечение, модификация и стирание связанных со страхом воспоминаний регулируются сетью переднего мозга в составе префронтальной коры, миндалины и гиппокампа. Эти регионы претерпевают в подростковом возрасте серьёзные онтогенетические изменения структур и функций. Клинические наблюдения свидетельствуют, что нервные процессы, лежащие в основе подавления чувства страха, временно, но серьезно ослаблены в подростковом возрасте [5]. Результаты данной работы свидетельствуют о “нормальной”, такой же, как и у взрослых животных [2] функции глутаматергических нейронов префронтальной коры ювенильных крысят в регуляции тревожности. Очевидно, причины возрастных проявлений этого психоэмоционального состояния могут определяться онтогенетическими особенностями функций миндалины и гиппокампа. Кроме этого, отсутствие видимых негативных эффектов введения AAV векторов в неонатальный мозг так же, как и показанная безопасность доставки AAV в мозг взрослых людей [9], позволяет надеяться на уже обсуждаемые [10] возможности применения хемогенетики в клинике.
В целом результаты работы свидетельствуют, что активность глутаматергических нейронов префронтальной коры способна снижать проявления тревожности в ювенильный период еще до завершения онтогенетического формирования нейронной сети психоэмоциональной регуляции.
Список литературы
Sternson S.M., Roth B.L. Chemogenetic Tools to Interrogate Brain Fnctions // Annu. Rev. Neurosci. 2014. V. 37. P. 387–407. https://doi.org/10.1146/annurev-neuro-071013-014048
Yun S., et al. Stimulation of Entorhinal Cortex-Dentate Gyrus Circuitry is Antidepressive // Nat. Med. 2018. V. 24. P. 658–666. https://doi.org/10.1038/s41591-018-0002-1
Selleck R.A., et al. Limited Prefrontal Cortical Regulation over the Basolateral Amygdala in Adolescent Rats // Sci. rep. 2018. V. 8. 17 171. https://doi.org/10.1038/s41598-018-35649-0
Spear L.P. The Adolescent Brain and Age-Related Behavioral Manifestations // Neurosci. Biobehav. Rev. 2000. V. 24. P. 417–463. https://doi.org/10.1016/S0149-7634(00)00014-2
Zimmermann K.S., Richardson R., Baker K.D. Maturational Changes in Prefrontal and Amygdala Circuits in Adolescence: Implications for Understanding Fear Inhibition during a Vulnerable Period of Development // Brain sci. 2019. V. 9(3). pii: E65. https://doi.org/10.3390/brainsci9030065
Lanshakov D.A., Drozd U.S., Dygalo N.N. Optogenetic Stimulation Increases Level of Antiapoptotic Protein Bcl-xL in Neurons // Biochemistry (Moscow). 2017. V. 82. P. 340–344. https://doi.org/10.1134/S0006297917030129
Bourin M., Hascoët M. The mouse light/dark box test // Eur. J. Pharmacol. 2003. V. 463(1-3). P. 55-65. https://doi.org/10.1016/s0014-2999(03)01274-3
Lanshakov D.A., Sukhareva E.V., Kalinina T.S., Dygalo N.N. Dexamethasone-Induced Acute Excitotoxic Cell Death in the Developing bBain // Neurobiol. dis. 2016. V. 91. P. 1–9. https://doi.org/10.1016/j.nbd.2016.02.009
Chtarto A., et al. A Next Step in Adeno-Associated Virus-Mediated Gene Therapy for neurological Diseases: Regulation and Targeting // Br. J. Clin. Pharmacol. 2013. V. 76(2). P. 217-232. https://doi.org/10.1111/bcp.12065
Lieb A., Weston M., Kullmann D.M. Designer Receptor Technology for the Treatment of Epilepsy // EBioMedicine. 2019. V. 43. P. 641–649. https://doi.org/10.1016/j.ebiom.2019.04.059
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


