Доклады Российской академии наук. Науки о жизни, 2020, T. 491, № 1, стр. 199-203
НЕЙРОЗАЩИТНАЯ И АНТИОКСИДАНТНАЯ АКТИВНОСТЬ АРАХИДОНОИЛХОЛИНА, ЕГО БИСКВАТЕРНИЗОВАННЫХ АНАЛОГОВ И ДРУГИХ АЦИЛХОЛИНОВ
М. Г. Акимов 1, *, **, П. В. Дудина 1, Е. В. Фомина-Агеева 1, Н. М. Грецкая 1, А. А. Босая 1, Е. В. Рудакова 2, Г. Ф. Махаева 2, Г. О. Кагарлицкий 3, С. А. Еремин 3, член-корреспондент РАН В. И. Цетлин 1, В. В. Безуглов 1
1 Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
2 Институт физиологически активных веществ Российской академии Наук
Черноголовка, Россия
3 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
* E-mail: akimovmike@gmail.com
** E-mail: akimovmike@yandex.ru
Поступила в редакцию 27.12.2019
После доработки 14.02.2020
Принята к публикации 14.02.2020
Аннотация
Изучена антиоксидантная активность и нейрозащитное действие в модели H2O2-индуцированной токсичности холиновых эфиров арахидоновой (AA-CHOL), докозагексаеновой (DHA-CHOL), линолевой (Ln-CHOL) и олеиновой (Ol-CHOL) жирных кислот, а также арахидоноилдихолина (AA-diCHOL) и О-арахидоноил- бистетрамиетиламиноизопропанола (ABTAP). AA-CHOL, DHA-CHOL и Ln-CHOL обеспечивали повышение выживаемости клеток на 20%. AA-CHOL, AA-diCHOL, Ol-CHOL и ABTAP проявляли радикал-связывающую активность в АБТС-тесте, близкую к активности стандартного антиоксиданта Тролокса.
Холиновые эфиры длинноцепочечных полиненасыщенных жирных кислот представляют собой семейство эндогенных липидов. До недавнего времени in vivo были обнаружены только производные полностью насыщенных кислот с длиной остатка до 16 атомов углерода, включительно (пальмитоилхолин) [1]. Возможность биосинтеза данных соединений обеспечивается низкой избирательностью холин ацетилтрансферазы в отношении остатка жирной кислоты в составе ацил-КоА [2]. Известная биологическая активность ацилхолинов проявляется преимущественно посредством мускариновых и никотиновых ацетилхолиновых рецепторов, причем по сравнению с ацетилхолином длинноцепочечные ацилхолины активируют мускариновые рецепторы слабее, а никотиновые – сильнее [1].
В ходе метаболомных исследований последних лет в человеческих плазме крови и стенках сосудов были обнаружены новые представители ацилхолинов – производные докозагексаеновой, арахидоновой, олеиновой, линолевой и линоленовой жирной кислот [3, 4]. Данных о биологической активности этих веществ нет, однако показано, что их уровень положительно коррелировал с развитием патологий сердечно-сосудистой системы и риском развития отека легких [4].
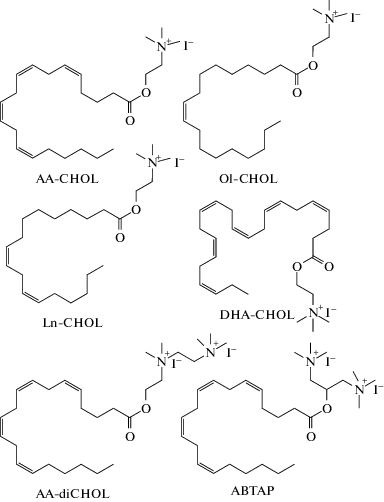
Известно, что избыточный уровень генерации различных активных форм кислорода, в том числе индуцируемый H2O2, сопровождает и является одним из патологических факторов сердечно-сосудистой патологии [5]. При этом активация мускариновых ацетилхолиновых рецепторов является одним из механизмов защиты клеток от окислительного стресса, вызванного H2O2 [6]. Мы предположили, что ненасыщенные ацилхолины могут служить эндогенными средствами защиты клеток от активных форм кислорода. Цель работы – проверить наличие антиоксидантной активности длинноцепочечных ненасыщенных холинамидов арахидоновой (AA-CHOL), олеиновой (Ol-CHOL), докозагексаеновой (DHA-CHOL) и линолевой (Ln-CHOL) кислот, а также их аналогов, содержащих две четвертичные триметиламонийные группы: арахидоноилдихолина (AA-diCHOL, N1-(2-(((5Z,8Z,11Z,14Z)-икоза-5,8,11,14-тетраеноил)окси)этил)-N1,N1,N2,N2,N2-пентаметилэтан-1,2-диаминиум иодид) и О-арахидоноил бистриметиламино-изо-пропанола (ABTAP, 2-(((5Z,8Z,11Z,14Z)-икоза-5,8,11,14-тетраеноил)окси)-N1,N1,N1,N3,N3,N3-гексаметилпропан-1,3-диаминиум иодид) (Схема), и способность этих веществ защищать клетки от окислительного стресса, индуцированного H2O2.
В качестве модели была выбрана распространенная в таких исследованиях линия человеческой нейробластомы SH-SY5Y [7].
Исследуемые ацилхолины и их аналоги синтезировали по ранее разработанным нами методикам [8]. Продукты очищали колоночной хроматографией на силикагеле. Чистоту финального продукта оценивали с помощью микроколоночной обращенно-фазовой ВЭЖХ, структуру подтверждали с помощью 1H-ЯМР и масс-спектрометрии ESI. Все соединения, использованные в экспериментах, имели чистоту не менее 97%.
Схема. Структуры исследованных соединений.
Клетки человеческой нейробластомы SH-SY5Y (ATCC CRL-2266) культивировали в комбинированной питательной среде DMEM с добавлением 1% заменимых аминокислот, 4 мМ L-глутамина, 10% эмбриональной телячьей сыворотки (FBS), 100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 2.5 мкг/мл амфотерицина B при 37°С и 5% CO2. Контаминацию питательной среды и сыворотки микотоксинами (зеараленоном, дезоксиниваленолом, афлатоксином В1, охратоксином А, Т2-токсином) контролировали с помощью экспериментальных автоматического анализатора и тест-систем для хемилюминесцентной детекции перечисленных примесей, разработанных совместно МГУ им. М.В. Ломоносова и ООО “ХЕМА” с участием средств Минобрнауки России. Далее клетки пересевали с помощью раствора Версена и раствора трипсина с ЭДТА. Плотность клеток накануне экспериментов была 15 000 на лунку 96-луночного планшета. Инкубацию с тестируемыми соединениями проводили в течение суток. Вещества растворяли в равном объеме свежей среды и добавляли в среду культивирования. Стоковые растворы веществ готовили в диметилсульфоксиде, финальная концентрация растворителя не превышала 0.5%. Для оценки жизнеспособности клеток использовали MTT-тест. Каждый эксперимент повторяли три раза.
Антирадикальную активность соединений определяли по их способности связывать модельный АБТС•+-радикал в соответствии с методом [9] с незначительными модификациями. Статистический анализ проводили с помощью программы GraphPad Prizm 6.0. Для статистической оценки различий использовали дисперсионный анализ и критерий Фишера, различия считали достоверными при p ≤ 0.05. Десятичный логарифм разделения октанол-вода рассчитывали с помощью пакета Perkin-Elmer ChemBioDraw 13.0.
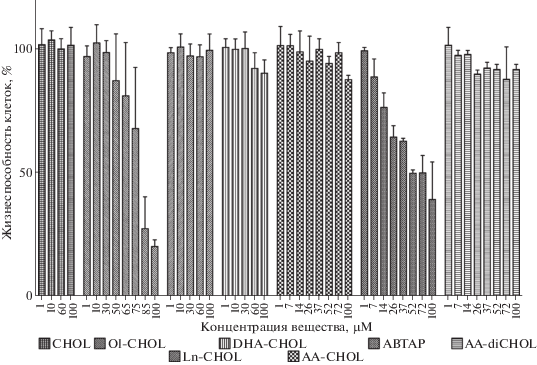
На первом этапе работы мы определили цитотоксичность исследуемых соединений, что позволило оптимизировать диапазон тестируемых концентраций (рис. 1). Свободный холин (CHOL), Ln-CHOL и AA-diCHOL были практически нетоксичны вплоть до концентрации 100 мкМ. DHA-CHOL и AA-CHOL проявляли слабую токсичность, вызывая гибель порядка 10% клеток при концентрации 100 μM. Наиболее выраженной токсичностью обладали Ol-CHOL и ABTAP, для которых EC50 составили 78 ± 4 и 60 ± 5 мкМ соответственно.
Рис. 1.
Цитотоксическое действие холиновых эфиров на культуру клеток SH-SY5Y. Здесь и на рис. 2 M ± SD, n = 5 экспериментов.
В дальнейших опытах для соединений с EC50 ≤ ≤ 100 μМ использовали концентрации, не превышающие полученное значение EC50.
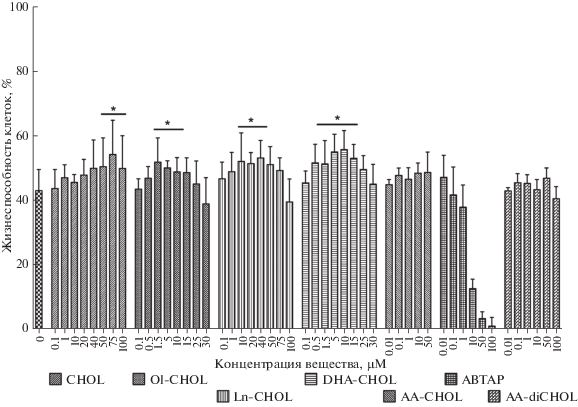
В опытах по защите клеток от токсического действия H2O2 активными оказались только холиновые производные олеиновой, линолевой и докозагексаеновой кислот, а также свободный холин (рис. 2). Максимальный прирост жизнеспособности клеток составил 20%. По параметру минимальной концентрации, необходимой для максимального эффекта, вещества можно выстроить в следующий ряд: Ol-CHOL ≈ Ln-CHOL < < DHA-CHOL ≪ CHOL.
Рис. 2.
Защита холиновыми эфирами клеток SH-SY5Y от токсического действия H2O2 (1000 мкМ) при одновременном добавлении. *p < 0.05 при сравнении с контролем с H2O2 без веществ.
Далее, мы проверили антирадикальную активность соединений. Как видно из таблицы 1, все эфиры холинов проявляли высокую АБТС•+- связывающую активность. При этом активность AA-diCHOL несколько превышала активность стандартного антиоксиданта Тролокса (TEAC = 1.2), активность ABTAP была на уровне Тролокса (TEAC = 1.03), а AA-CHOL и Ol-CHOL немного уступали Тролоксу: TEAC = 0.85 и 0.83 соответственно.
Таблица 1.
АБТС•+-связывающая активность соединений. TEAC – (trolox equivalent antioxidant capacity) антиоксидантная способность, выраженная в тролокс-эквивалентах, как отношение тангенсов углов наклона для зависимостей снижения концентрации АБТС•+-радикала от концентрации исследуемого соединения и Тролокса. Среднее ± SEM, n = 3 эксперимента
| Соединение | Антирадикальная активность | |
|---|---|---|
| TEAC | IC50, μM | |
| AA-CHOL | 0.85 ± 0.012 | 22.1 ± 1.9 |
| AA-DMAE | 0.11 ± 0.012 | n.d. |
| AA-diCHOL (EtOH) | 1.2 ± 0.058 | 15.6 ± 1.5 |
| ABTAP (EtOH) | 1.03 ± 0.035 | 19.0 ± 1.4 |
| Ol-CHOL (DMSO) | 0.83 ± 0.015 | 22.7 ± 2.2 |
| Арахидоновая к-та (EtOH) | 0.13 ± 0.012 | n.d. |
| NaI (DMSO) | 0.19 ± 0.01 | n.d. |
| Trolox | 1.0 | 20.1 ± 1.6 |
| Аскорбиновая кислота | 0.98 ± 0.015 | 21.8 ± 1.8 |
| Холин хлорид | 0 | n.d. |
Свободная арахидоновая кислота, холин, а также предшественник арахидоноилхолина арахидоноил-диметиламиноэтанол не проявляли активности в тесте АБТС или были малоактивны. Также мы показали, что в этом тесте иодид натрия был малоактивен, т.е. иодид-ион вносит незначительный вклад в реакцию ацилхолинов с ABTS-радикалом. Таким образом, для проявления радикал-связывающей активности необходимо наличие четвертичного азота в холиновом остатке молекулы арахидоноилцилхолина.
Прямых данных об антиоксидантной активности холина в литературе нет, однако, при добавлении свободного холина в пищу зафиксировано снижение уровня активных форм кислорода у мышей в модели аллергических заболеваний [10]. В литературе также имеются сведения о том, что диметилглицин (“предшественник” холина без третичного азота) способен проявлять антиоксидантную активность, хотя и при очень значительных концентрациях порядка 20–80 мг/мл [11]. Можно сделать вывод, что включение в молекулу длинного остатка жирной кислоты усиливает антиоксидантную активность холина.
Защитное действие исследованных соединений в модели H2O2-индуцированной токсичности не коррелировало с их радикал-связывающей способностью. Этот противоречивый на первый взгляд результат может быть объяснён тем, что при умеренных концентрациях H2O2 ее цитотоксичность реализуется не за счет формирования активных форм кислорода, а через снижение концентрации NAD(P)H, что ведет к открытию неселективного катионного канала на плазмалемме и дополнительно может запускать Na+/Ca2+ обменник, что в сумме вызывает токсическую перегрузку клетки кальцием [12, 13]. В литературе имеются данные о том, что активация мускариновых ацетилхолиновых рецепторов может приводить к выбросу кальция из клетки [14]; можно предположить, что именно это лежит в основе защитного действия ацилхолинов.
Таким образом, в работе впервые была обнаружена способность длинноцепочечных ненасыщенных ацилхолинов эффективно связывать свободные радикалы и повышать жизнеспособность клеток в условиях токсического действия H2O2. Эти свойства хорошо согласуются с нашей начальной гипотезой о том, что такие молекулы могут синтезироваться в клетке в ответ на окислительный стресс как компоненты защиты. Однако, для окончательного ее подтверждения нужны дополнительные исследования в условиях in vivo.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Работа выполнена при финансовой поддержке Минобрнауки России, уникальный идентификатор проекта RFMEFI60417X0198.
Список литературы
Hunt R., de Mortemer Taveau R. The Effects of a Number of Derivatives of Choline and Analogous Compounds on the Blood-pressure. 1911. US Government Printing Office.
Rossier J. Acetyl coenzyme A and coenzyme A analogues. Their effects on rat brain choline acetyltransferase // Biochem. J. 1977. V. 165. № 2. P. 321–326.
Zarei I., Oppel C.R., Borresen C.E., Brown J.R., Ryan P.E. Modulation of plasma and urine metabolome in colorectal cancer survivors consuming rice bran // Integr. Food, Nutr. Metab. 2019. Open Access Text Pvt, Ltd. V. 6. № 3.
Vorkas P.A., Isaac G., Anwar M.A., Davies A.H., Want E.J., Nicholson J.K., Holmes E. Untargeted UPLC-MS profiling pipeline to expand tissue metabolome coverage: application to cardiovascular disease // Anal. Chem. 2015. V. 87. № 8. P. 4184–4193.
Byon C.H., Heath J.M., Chen Y. Redox signaling in cardiovascular pathophysiology: A focus on hydrogen peroxide and vascular smooth muscle cells // Redox Biol. 2016. Elsevier B.V. V. 9. P. 244–253.
Liu Y., Sun H.-L., Wu H., Gao Y.-H., Li H.-L., Yang B.-F. Protective effect of M3 receptor on H2O2-induced apoptosis of rat myocardial cells in vitro // Yao Xue Xue Bao. 2004. V. 39. № 11. P. 887–891.
Kovalevich J., Langford D. Considerations for the use of SH-SY5Y neuroblastoma cells in neurobiology // Methods Mol. Biol. 2013. V. 1078. P. 9–21.
Bezuglov V.V., Zinchenko G.N., Nikitina L.A., Buznikov G.A. Arachidonoylcholine and O-arachidonoyldimethylaminoethanol as new cholinergic substances // Rus. J. Bioorg. Chem. 2001. V. 207. P. 200–203.
Re R., Pellegrini N., Proteggente A., Pannala A., Yang M., Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay // Free Radic. Biol. Med. 1999. V. 26. № 9–10. P. 1231–1237.
Mehta A.K., Arora N., Gaur S.N., Singh B.P. Choline supplementation reduces oxidative stress in mouse model of allergic airway disease // Eur. J. Clin. Invest. 2009. V. 39. № 10. P. 934–941.
Bai K., Xu W., Zhang J., Kou T., Niu Y., Wan X., Zhang L., Wang C., Wang T. Assessment of Free Radical Scavenging Activity of Dimethylglycine Sodium Salt and Its Role in Providing Protection against Lipopolysaccharide-Induced Oxidative Stress in Mice // PLoS One / Ed. by Mukhopadhyay P. 2016. V. 11. № 5. P. e0155393.
Jussofie A., Kirsch M., De Groot H. Ca2+-dependent cytotoxicity of H2O2 in L929 cells: The role of H2O2-induced Na+-influx // Free Radic. Biol. Med. 1998. V. 25. № 6. P. 712–719.
Herson P.S., Lee K., Pinnock R.D., Hughes J., Ashford M.L. Hydrogen peroxide induces intracellular calcium overload by activation of a non-selective cation channel in an insulin-secreting cell line // J. Biol. Chem. 1999. V. 274. № 2. P. 833–841.
Carroll R.C., Peralta E.G. The m3 muscarinic acetylcholine receptor differentially regulates calcium influx and release through modulation of monovalent cation channels. // EMBO J. 1998. V. 17. № 11. P. 3036–3044.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни