Доклады Российской академии наук. Науки о жизни, 2020, T. 491, № 1, стр. 204-207
О ВОЗМОЖНОМ ПУТИ УВЕЛИЧЕНИЯ ЭФФЕКТИВНОСТИ ФОТОСИНТЕЗА
В. А. Соколов *
Институт молекулярной и клеточной биологии Сибирского отделения Российской академии наук
Новосибирск, Россия
* E-mail: sokolov@mcb.nsc.ru
Поступила в редакцию 12.12.2019
После доработки 12.12.2019
Принята к публикации 12.12.2019
Аннотация
В работе кратко изложена эволюция ключевого фермента фотосинтеза – РуБисКО. До возникновения реакции усвоения углекислоты путем фотосинтеза, этот белок был задействован в цепи обмена метионина. Возможно, по этой причине катализируемая им реакция карбоксилирования протекает крайне медленно. Кроме карбоксилирования РуБисКО одновременно может окислять рибулезобисфосфат, являющийся субстратом к которому присоединяется фиксируемый СО2. Это, в свою очередь, также снижает эффективность фотосинтеза. В связи с этим в литературе обсуждаются различные варианты повышения продуктивности растений за счет создания новых форм РуБисКО, или принципиально иных путей усвоения углекислоты. В данной работе изложено предложение по модификации карбоксилирующей реакции, позволяющей избежать реакцию фотодыхания и таким образом повысить эффективность фотосинтеза.
По хронологическим оценкам первые прокариоты появились на земле около 4 млрд лет назад. Сотни миллионов лет метаболические системы живых организмов формировались на основе фиксации СО2 за счет энергии хемосинтеза [1]. К моменту освоения световой энергии для превращения СО2 в углеводы около 3 млрд лет назад, они обладали широкой сетью метаболических путей, в которую его необходимо было встроить. Для осуществления ключевой реакции фиксации СО2, был рекрутирован фермент катализировавший енолирование 2,3-дикето-5-метилтиопентилфосфата (ДК-МТП-1-Ф), возможно, участвовавший в восстановлении углекислоты у метаногенных бактерий [2, 3]. Но эти функции энзима были открыты позже, нежели присоединение углекислоты к рибулезобисфосфату (РБФ) при фотосинтезе. Поэтому фермент получил название – рибулезо-1,5-бисфосфаткарбоксилаза/оксигеназа или принятое сокращение – РуБисКО. К настоящему моменту выявлено несколько типов этого энзима и РуБисКО подобных белков (РПБ) [4–6]. Второе название – оксигеназа связано с тем, что кроме ассимиляции углекислоты, этот энзим проводит окисление субстрата, т.е. процесс обратный ассимиляции СО2, что значительно снижает продуктивность растений [7]. При этом скорость реакции карбоксилирования необычайно низка – от 2 до 8 актов катализа в секунду [8]. Хотя более чем за 3 млрд лет эволюции фотосинтеза был создан значительный аппарат, организующий работу РуБисКО [9]. Поэтому необходимый уровень фиксации углекислоты поддерживается за счет большого числа молекул этого фермента – до 50% растворимого белка в листьях. Поскольку продуктивность растений прямо зависит от эффективности усвоения СО2, предпринимаются попытки ее повышения [10, 11], или даже освоения принципиально иного пути фиксации СО2 [12]. При этом значительное внимание уделяется изучению возможного совершенствования кинетических свойств РуБисКО при осуществлении реакции карбоксилирования [8]. Однако, несмотря на широчайший фронт исследований – гены РуБисКО и РПБ к настоящему времени секвенированы более чем у 2000 организмов – мы не имеем законченной картины функционирования этого фермента. И наибольшая проблема связана с реализацией окисления РБФ [8].
Последовательность реакций осуществляемых РуБисКО представлена на рис. 1а. Карбоксилирование РБФ осуществляется в пять этапов (таутомеризация, карбоксилирование, гидратирование, разрыв связи, стереоспецифическое протонирование (СП)). В результате чего образуются две молекулы 3-фосфорноглицериновой кислоты (3ФГК), которые далее могут быть использованы как для ресинтеза РБФ, так и для синтеза фруктозо-6-фосфата и глюкозы в конечной стадии цикла Бенсона–Бассема–Кальвина. В случае оксигеназной реакции образуется одна молекула 3ФГК и одна молекула 2-фосфогликолата (2ФГ). 3ФГК может быть использована, как и получаемая при карбоксилировании, а 2ФГ требует специальной утилизации, поскольку токсичен для хлоропластов [13]. Здесь необходимо подчеркнуть, что в живых системах реакции, катализируемые с использованием енолятных и енаминобразующих переходных форм, не всегда сопровождаются окислением субстрата. Поэтому фотодыхание не может рассматриваться как неизбежное следствие механизма таутомеризации. Встает вопрос – почему оно реализуется у РуБисКО? Ничего определенного по этому поводу пока неизвестно. Возможно, это результат компромисса между химическими и метаболическими императивами и лишь дальнейшие исследования смогут пролить свет на эту проблему [8]. В целом механизм функционирования РуБисКО довольно сложен, и включает, по меньшей мере, три промежуточных и четыре переходных состояния с жесткими стереохимическими ограничениями [14]. При этом несколько важных деталей каталитического процесса остаются неясными. Во-первых, последовательность динамики протонов. Во-вторых, происхождение оксигеназной реакции [8]. В-третьих, причины низкой скорости карбоксилирования и склонность РуБисКО к полифункциональности [6, 8].
Рис. 1.
Схема реакций осуществляемых РуБисКО у фотосинтезирующих организмов (а) и РуБисКО подобными белками у Bacillus subtilis в цепи обмена метионина (б). ГК-МТП-1-Ф – 2-гидрокси-3-кето-5-метилтиопентил-1-фостат. Адаптирован из [13].
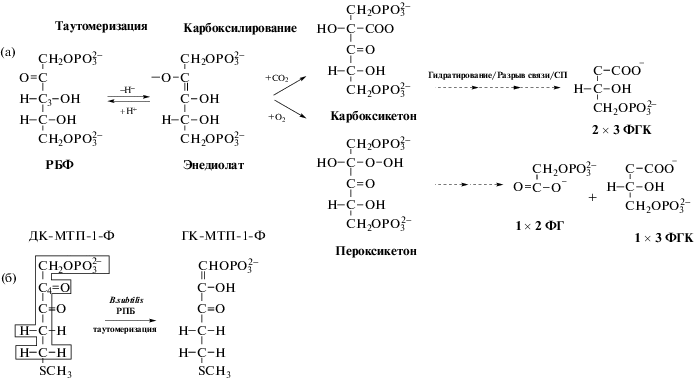
Обратим внимание на замечательный факт, что двойные связи, образуемые при таутомеризации под контролем РПБ (эволюционно более ранней функции будущей РуБисКО) у ДК-МТП-1-Ф (B. subtilis) и под контролем РуБисКО у РБФ при фотосинтезе, являются разнонаправленными (рис. 1а, 1б). В первом случае она устанавливается между 1 и 2 атомами углерода, а во втором – между 2 и 3. Почему реализуется столь разные сценарии енолизации остается не ясным. При этом у некоторых живых форм фермент осуществляет реакции с обоими субстратами (ДК-МТП-1-Ф и РБФ) [6, 13].
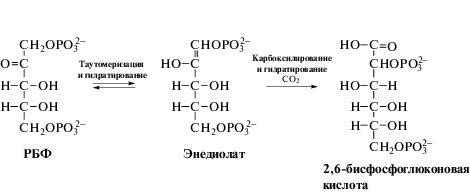
На этом основании, наше предложение состоит в том, чтобы принципиально изменить механизм протекания реакции карбоксилирования РБФ (рис. 2). С этой целью необходимо добиться установки двойной связи между 1 и 2 атомами углерода при енолировании РБФ, как это осуществляется у ДК-МТП-1-Ф (B. subtilis). Далее необходимо провести присоединение СО2 к первому атому углерода и образование шестиатомной 2,6-бисфосфоглюконовой кислоты с последующим восстановлением ее до фруктозы или глюкозы. Таким образом, можно избежать фотодыхания и интенсифицировать выход продуктов фотосинтеза. Для оценки реальности создания такого метаболического пути необходимо проведение квантовомеханических расчетов, которые должны показать возможность экспериментального решения данной задачи. Но, не исключено, что какие-либо простейшие фотоавтотрофы используют именно такой путь, поскольку наши знания о механизмах фотосинтеза крайне ограничены.
Список литературы
Berg I.A., Kockelkorn D., Ramos W.H., et al. // Nature Rev. Microbiology. 2010. V. 8. P. 447–460.
Ashida H., Danchin A., Yokota A. // Res Microbiol. 2005. V. 156. № 5–6. P. 611–618.
Ashida H., Mizohata E., Yokota A. // Biochemical Society Transactions. 2018. P. 1–7.
Tabita F.R., Satagopan S., Hanson T.E., et al. // J. Exp. Bot. 2008. V. 59. P. 1515–1524.
Erb T.J., Evans B.S., Cho K., et al. // Nature chemical biology. 2012. V. l. № 8. P. 926–932.
Dey S., North J.A., Sriram J., et al. // J. Biol. Chem. 2015. V. 290. № 52. P. 30658–30668.
Ort D.R., Merchant S.S., Alric J., et al. // PNAS. 2015. V. 112. № 28. P. 8529–8536.
Bathellier C., Tcherkez G., Lorimer G.H., Farquhar G.D. // Plant Cell Environ. 2018. V. 41. P. 705–716.
Bracher A., Whitney S.M., Hartl F.U., Hayer-Hartl M. // Review of Plant Biology. 2017. V. 68. P. 29–60.
Zhu X.G., Long S.P., Ort D.R. // Annu. Rev. Plant Biol. 2010. V. 61. P. 235–261.
Weber A.P.M., Bar-Even A. // Plant Physiology. 2019. V. 179. P. 803–812.
Bar-Even A., Noor E., Lewis N.E., Milo R. // Proc. Natl. Acad. Sci. USA. 2010. V. 107. P. 8889–8894.
Erb T.J., Zarzycki J. // Current Opinion in Biotechnology. 2018. V. 49. P. 100–107.
Cleland W.W., Andrews T.J., Gutteridge S., et al. // Chemical Reviews. 1998. V. 98. P. 549–562.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни