Доклады Российской академии наук. Науки о жизни, 2020, T. 491, № 1, стр. 194-198
БЛОКАТОРЫ НИКОТИНОВЫХ ХОЛИНОРЕЦЕПТОРОВ ТОРМОЗЯТ ОПУХОЛЕВЫЙ РОСТ И УСИЛИВАЮТ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ СПЛЕНОЦИТОВ МЫШЕЙ
Т. И. Терпинская 1, А. В. Осипов 2, *, Т. В. Балашевич 1, Т. Л. Янченко 1, Е. А. Тамашенок 1, член-корреспондент РАН В. И. Цетлин 2, Ю. Н. Уткин 2
1 Институт физиологии Национальной академии наук Беларуси
Минск, Республика Беларусь
2 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
* E-mail: osipov-av@ya.ru
Поступила в редакцию 16.10.2019
После доработки 16.10.2019
Принята к публикации 16.10.2019
Аннотация
Нами показано, что блокада никотиновых холинорецепторов α6, α3β2, α9α10 и α7 подтипов способствует замедлению опухолевого роста in vivo, а также усилению цитотоксической активности спленоцитов мышей-опухоленосителей и некоторому снижению жизнеспособности клеток карциномы Эрлиха in vitro. Эти данные свидетельствуют о том, что никотиновые ацетилхолиновые рецепторы участвуют в онкогенезе, снижая выживаемость опухолевых клеток, в том числе, через модуляцию противоопухолевого иммунитета.
Участие нейронных рецепторов в физиологических процессах, не связанных с передачей нервного сигнала, в последние годы привлекает повышенное внимание. В области изучения онкогенеза особый интерес вызывают никотиновые ацетилхолиновые рецепторы (н-АХР).
Про-онкогенный эффект курения в значительной мере связывают с активацией н-АХР никотином и его производными, что способствует выживаемости и пролиферации опухолевых клеток [1, 2].
К настоящему времени установлено, что н-АХР на иммунных клетках участвуют в регуляции воспаления, способствуя снижению синтеза провоспалительных цитокинов [3]. Учитывая, что цитокины участвуют в реализации иммунных реакций, вызывает интерес роль н-АХР в тех из них, которые ассоциированы с воспалением. На сегодняшний день этот вопрос недостаточно изучен и необходимую информацию можно получить, целенаправленно ингибируя определенные подтипы этих рецепторов с помощью высокоспецифичных блокаторов н-АХР – α-конотоксинов яда морских улиток и α-нейротоксинов яда змей.
Ранее на мышиной модели при исследовании морфологических изменений в опухолевой ткани, вызываемых α-конотоксинами, мы заметили замедление роста опухоли [4]. В представленной работе мы показываем влияние блокаторов различных подтипов н-АХР на рост карциномы Эрлиха (КЭ) и выживаемость мышей in vivo, а также влияние этих блокаторов на выживаемость опухолевых клеток и на цитотоксическую активность спленоцитов in vitro. Конотоксины MII, PnIA, RgIA и ArIB11L16D − селективные блокаторы α6, α3β2, α9α10 и α7 н-АХР [5], соответственно, – были получены методом пептидного синтеза [6].
Опыты проводили на мышах линии Af/WySnMv, поддерживаемой в виварии Института физиологии НАН Беларуси, и на опухоли асцитной КЭ.
В экспериментах in vivo мышам вводили подкожно 6 млн клеток КЭ. В опытных сериях животные получали α-конотоксины в дозе 1 нмоль/кг 5 раз в неделю в течение 4-х недель, в контрольных – 0.9% хлорид натрия. Регистрировали объем опухоли, как в работе [7], и выживаемость мышей в течение 200 суток.
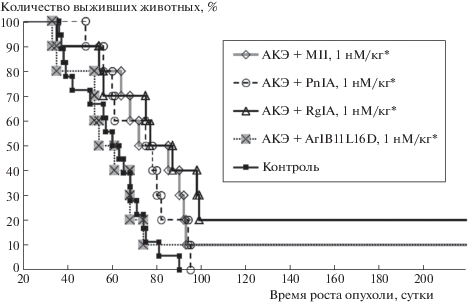
In vivo все использованные блокаторы н-АХР способствовали торможению роста опухоли, достигающему 57–69% к окончанию курса инъекций (рис. 1). После завершения инъекций замедление роста опухоли наблюдали в течение последующих 14 суток, и в опытных сериях наблюдалось увеличение выживаемости опухоленосителей (рис. 2), наблюдаемое в той или иной мере для всех блокаторов разной специфичности. Интересно, что конотоксин ArIB11L16D, блокатор α7 н-АХР, сильнее других задерживал развитие КЭ, но слабо влиял на выживаемость опухоленосителей.
Рис. 1.
Влияние блокаторов н-АХР на рост карциномы Эрлиха (КЭ) у мышей, приведены значения медианы [25÷75 перцентили]; * Р < 0.05 при сравнении с контролем (согласно тесту “Anova, over-parameterized model”).

Рис. 2.
Влияние блокаторов н-АХР на выживаемость мышей – носителей карциномы Эрлиха; * Р < 0.05 при сравнении с контролем (согласно критерию Кокса–Монтеля).
Описываемый эффект блокаторов н-АХР может быть обусловлен как влиянием на н-АХР в клетках опухоли, так и на н-АХР в клетках иммунной системы. Мы изучили влияние α-конотоксинов in vitro на выживаемость клеток КЭ и на цитотоксическую активность спленоцитов в отношении этих клеток. Поскольку α-конотоксин ArIB11L16D, блокатор α7 н-АХР, замедлял рост опухоли, но практически не влиял на выживае-мость мышей, наряду с α-конотоксинами был использован еще один блокатор α7 н-АХР – нейротоксин из яда таиландской кобры α-кобратоксин.
Для экспериментов in vitro клетки КЭ получали стерильно из брюшной полости мышей через 8–10 суток после внутрибрюшинной прививки опухоли, культивировали в среде DMEM 5523 (Sigma) c добавлением 10%-ной эмбриональной телячей сыворотки (HyClone) и антибиотиков (пенициллин, стрептомицин, амфотерицин В, Sigma).
Клеточную суспензию вносили в лунки 96-луночного планшета, добавляли вышеперечисленные блокаторы н-АХР в конечной дозе 1 нМ и помещали планшеты с клетками в СО2-инкубатор при 37°С и 5% СО2. Через 24 и 48 ч клетки окрашивали пропидий йодидом (Sigma) для определения жизнеспособности, а пролиферативную активность оценивали, подсчитывая концентрацию клеток в пробах с использованием референсных флуоросфер FLOW-COUNT™ (Beckman Coulter).
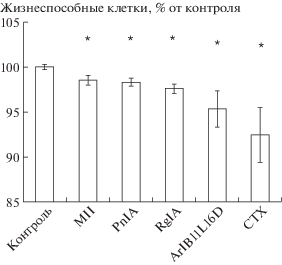
In vitro за 24 ч α-конотоксины на 1.5–4.7% снижали жизнеспособность клеток КЭ, α-кобротоксин – на 7.6%, рис. 3.
Рис. 3.
Влияние блокаторов н-АХР на жизнеспособность клеток карциномы Эрлиха in vitro, 24 ч культивирования, Xср ± Sx, n = 25 (объединены данные 5-и экспериментов, в каждом из которых n = 5); * p < 0.05 при сравнении с контролем (согласно критерию Манна–Уитни). CTX – α-кобратоксин.
Пролиферация клеток была снижена на 7.9% (р < 0.05 согласно критерию Манна–Уитни) только при действии конотоксина MII (данные не представлены).
Через 48 ч отличий от контроля в жизнеспособности и пролиферации клеток не зарегистрировано (данные не представлены).
Цитотоксическую активность спленоцитов определяли по модифицированному методу, описанному в работе [8]. Кратко: селезенку мышей-опухоленосителей раздавливали на капроновой сетке в стерильных условиях, лизировали эритроциты с помощью раствора хлорида аммония, отмывали клетки в растворе Хенкса. Спленоциты окрашивали красителем Carboxyfluorescein succinimidyl ester (CFSE, Thermo Fisher Scientific), а клетки-мишени КЭ – красителем CellTraceViolet (CTV, Thermo Fisher Scientific), и смешивали их в соотношении 2:1. Добавляли блокаторы н-АХР в конечной дозе 1 нМ. Инкубировали при 37°С и 5% СО2 в течение трех часов. Окрашивали 7-аминоактиномицином D (7-ААD, Sigma) и добавляли флуоросферы FLOW-COUNT™ для подсчета концентрации живых клеток-мишеней (клеток с маркерами CTV+, CFSE–, 7-AAD–). Клеточные пробы анализировали на проточном цитофлуориметре BD FACS Canto II, Becton Dickinson с программным обеспечением Diva 7.0.
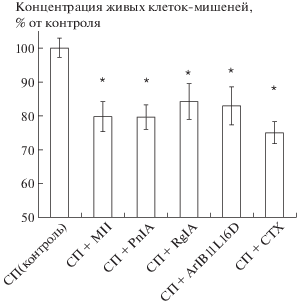
Цитотоксический тест показал, что при совместной инкубации спленоцитов и опухолевых клеток-мишеней происходила гибель последних и снижение концентрации их на 32%, р < 0.05 согласно критерию Манна–Уитни (данные не представлены).
Конотоксины и α-кобратоксин усиливали цитотоксическую активность спленоцитов еще на 16–25%, рис. 4. Полученные нами результаты не показали принципиальных отличий в эффектах блокаторов различных подтипов н-АХР.
Рис. 4.
Влияние блокаторов н-АХР на цитотоксическую активность спленоцитов (СП) носителей карциномы Эрлиха; Xср ± Sx, n = 16 (объединены данные 4-х независимых экспериментов, n = 4 в каждом эксперименте); * p < 0.05 при сравнении с контролем согласно критерию Манна–Уитни. СП – спленоциты.
Результаты наших экспериментов продемонстрировали, что блокада н-АХР привела к торможению роста карциномы Эрлиха in vivo.
In vitro блокаторы н-АХР оказывали слабое действие на жизнеспособность опухолевых клеток и, за исключением конотоксина MII, не оказывали влияния на их пролиферацию. Возможно, это обусловлено низкой дозой примененных нами блокаторов н-АХР, которые в таких дозах оказывают скорее регуляторное, чем цитотоксическое действие. Эти дозы сопоставимы с концентрацией ацетилхолина, эндогенного агониста н-АХР, в плазме разных видов млекопитающих в диапазоне 0.15–13.4 рмоль/мл [9]. Очевидно, блокаторы н-АХР в сходных дозах будут скорее изменять функции клеток или вызывать краткосрочные эффекты, чем оказывать выраженное и продолжительное цитотоксическое действие.
Как показывает рис. 4, ингибирование н-АХР способствовало усилению противоопухолевой активности спленоцитов мышей-опухоленосителей. Спленоциты, выделенные по указанной выше или сходной методике, включают в себя различные клеточные популяции лимфоидного и миелоидного ряда [10]. Среди них гибель опухолевых клеток могут вызывать натуральные киллеры, цитотоксические Т-лимфоциты, нейтрофилы, макрофаги.
Известно, что н-АХР на клетках иммунной системы участвуют в регуляции воспаления. Особая роль в этом отводится α7 н-АХР, активность которого способствует снижению синтеза ФНО-α, интерферона-γ, интерлейкина-2, интерлейкина-6 клетками селезенки и макрофагами мышей [9]. Эти цитокины индуцируют поляризацию макрофагов и нейтрофилов к М1-типу и N1-типу, соответственно, стимулируют их цитотоксическую активность, а также поддерживают развитие адаптивного противоопухолевого ответа [11, 12]. Исходя из этого, можно предполагать, что ингибирование н-АХР усиливает цитотоксическую активность спленоцитов мышей, препятствуя противовоспалительному действию н-АХР и способствуя усилению противоопухолевого иммунитета.
Таким образом, блокада всех вышеперечисленных н-АХР приводит к торможению роста подкожно привитой КЭ у мышей. В опытах in vitro использованные блокаторы н-АХР оказывают на опухолевые клетки лишь слабый цитотоксический эффект, однако, способствуют усилению цитотоксической активности спленоцитов опухоленосителей.
Эти данные свидетельствуют о том, что никотиновые холинорецепторы оказывают влияние на выживаемость опухолевых клеток, в том числе, через противоопухолевый иммунитет.
БЛАГОДАРНОСТИ
Авторы выражают благодарность к.х.н. М.Н. Жмаку за синтез конотоксинов.
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект 18-54-00031) и Белорусского республиканского фонда фундаментальных исследований (проект М18Р-104).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Исследования с использованием экспериментальных животных были одобрены комитетом по биоэтике Института физиологии НАН Беларуси, протокол № 1 от 31.01.2019 г.
Список литературы
Chen J., Cheuk I.W.Y., Shin V.Y., et al. // Surg. Oncol. 2019. V. 31. P. 46–53.
Friedman J.R., Richbart S.D., Merritt J.C., et al. // Pharmacol. Ther. 2019. V. 194. P. 222–254.
Pavlov V.A., Chavan S.S., Tracey K.J. // Annu. Rev. Immunol. 2018. V. 36. P. 783–812.
Терпинская Т.И., Осипов А.В., Кузнецова Т.Е., и др. // ДАН. 2015. Т. 463. № 3. С. 230–233.
Dutertre S., Nicke A., Tsetlin V.I. // Neuropharmacology. 2017. V. 127. P. 196–223.
Жмак М.Н., Кашеверов И.Е., Уткин Ю.Н., и др. // Биоорг. химия. 2001. Т. 27. № 2. С. 83–88.
Осипов А.В., Терпинская Т.И., Улащик В.С., и др. // Доклады академии наук. 2013. Т. 451. № 4. С. 462–463.
Zhang X., Rao A., Sette P., et al. // Neuro Oncol. 2016. V. 18. № 10. P. 1402–1412.
Kawashima K., Fujii T., Moriwaki Y., et al. // Int. Immunopharmacol. 2015. V. 29. № 1. P. 127–134.
Hensel J.A., Khattar V., Ashton R., et al. // Lab. Invest. 2019. V. 99. № 1. P. 93–106.
Shao S., Risch E., Burner D., et al. // Int. Immunopharmacol. 2017. V. 47. P. 159–165.
Castro F., Cardoso A.P., Gonçalves R.M., et al. // Front Immunol. 2018. V. 4. № 9:847. P. 1–19.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


