Доклады Российской академии наук. Науки о жизни, 2020, T. 491, № 1, стр. 151-154
ЖЕЛАТИН И КРАХМАЛ: ЧТО ЛУЧШЕ СТАБИЛИЗИРУЕТ АКТИВНОСТЬ ФЕРМЕНТОВ?
Е. Н. Есимбекова 1, 2, *, А. Е. Говорун 2, В. И. Лоншакова-Мукина 2, В. А. Кратасюк 1, 2
1 Институт биофизики Сибирского отделения Российской академии наук
Красноярск, Россия
2 Сибирский федеральный университет
Красноярск, Россия
* E-mail: esimbekova@yandex.ru
Поступила в редакцию 30.11.2019
После доработки 30.11.2019
Принята к публикации 30.11.2019
Аннотация
Рассмотрены закономерности функционирования ряда ферментов в вязком окружении, созданном природными полимерами крахмалом и желатином. На основе анализа кинетических кривых термоинактивации предложены механизмы термоинактивации ферментов в вязком микроокружении. На примере бутирилхолинэстэразы, НАД(Ф)H:ФМН-оксидоредуктазы и биферментной системы светящихся бактерий НАД(Ф)H:ФМН-оксидоредуктаза + люцифераза найдены условия, в которых крахмал и желатин оказывают стабилизирующий эффект на активность ферментов при хранении и воздействии различных физических и химических факторов среды. Значительное усиление стабилизирующего эффекта достигается исключением воды при высушивании иммобилизованных в полимерные гели крахмала и желатина ферментных препаратов.
Невысокая стабильность белковых макромолекул ферментов ограничивает область их практического применения. В связи с этим поиск возможных путей повышения стабильности ферментов является важной задачей. При этом принимаются во внимание два различных аспекта проблемы: термодинамическая (или конформационная) стабильность и кинетическая (или долговременная) стабильность. Одним из способов повышения стабильности ферментов является добавление стабилизаторов [1]. Универсальным методом, применяемым для повышения как термодинамической, так и кинетической стабильности является иммобилизация. При этом для стабилизации разных ферментов необходимо подбирать свое уникальное микроокружение. В последние годы стали популярны исследования стабилизации белковых макромолекул в условиях “молекулярного краудинга”, то есть в условиях исключенного объема окружающей свободной воды [2–4]. Стабилизация белковых молекул при иммобилизации в полимерные гели и помещении в среды с повышенной вязкостью достигается именно благодаря вышеупомянутому эффекту [5]. К настоящему времени достаточно хорошо изучены физико-химические и структурные свойства гелей и вязких растворов природных биополимеров: желатина и крахмала [6, 7]. Кроме того, существуют подтверждения благоприятного воздействия микроокружения, создаваемого данными биополимерами, на молекулы ферментов [8–10].
В работе на примере ферментов бутирилхолинэстэразы (BChE), НАД(Ф)H:ФМН-оксидоредуктазы (Red) и биферментной системы светящихся бактерий НАД(Ф)H:ФМН-оксидоредуктаза и люцифераза (Red + Luc) изучены особенности функционирования ферментов при помещении в вязкие растворы и гели природных биополимеров крахмала и желатина. Показано, что крахмал и желатин при некоторых условиях способны оказывать стабилизирующий эффект на функционирование ферментов при хранении и воздействии различных физических и химических факторов среды. Полученные результаты важны для разработки высокостабильных ферментных препаратов для применения в биологических анализах, в частности, биотестирования природных, сточных вод и водных растворов.
В работе использовали следующие реактивы: ФМН (“Serva”, Германия), НАДН (“Gerbu”, Германия), тетрадеканаль (“Merck”, Германия), S-бутирилтиохолин йодид и 5-5'-дитиобис (2-нитробензойную кислоту) (“Sigma”, Германия); лиофилизированные препараты НАД(Ф)Н:ФМН-оксидоредуктазы (КФ 1.5.1.29) из Vibrio fischeri, биферментной системы НАД(Ф)Н:ФМН-оксидоредуктазы и люциферазы (КФ 1.14.14.3) из рекомбинантного штамма E. coli (производства лаборатории нанобиотехнологии и биолюминесценции Института биофизики СО РАН, Красноярск), бутирилхолинэстэразы из лошадиной сыворотки (“Sigma”, Германия).
Активность Red определяли спектрофотометрическим методом по скорости расходования НАДH [11]. Активность биферментной системы Red + Luc определяли по величине максимальной интенсивности свечения Iмакс, выраженной в относительных единицах [10]. Активность BChE определяли, как скорость гидролиза субстрата S-бутирилтиохолина йодида в растворе, содержащем 5-5'-дитиобис(2-нитробензойную кислоту) [12].
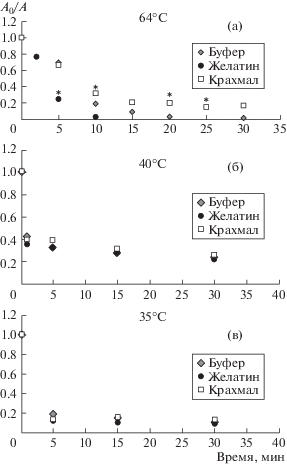
Были получены кинетические зависимости остаточной активности ферментов (А/А0) при инкубации ферментов от 0 до 30 мин в 0.05 М калий-фосфатном буферном растворе без добавок, а также в буферных растворах крахмала и желатина различной температуры (рис. 1). Видно, что раствор крахмала оказывает больший стабилизирующий эффект на BChE по сравнению с желатиновым раствором. Так, например, в крахмальном окружении при температуре 64°С остаточная активность BChE сохраняется в течение 30 мин, а в желатиновом окружении в течение 10 мин (рис. 1а). В то же время остаточная активность Red и Red + Luc при выдерживании ферментов в вязких растворах крахмала и желатина различной температуры не отличается от таковой в буферном растворе (рис. 1б, 1в).
Рис. 1.
Зависимости остаточной активности ферментов от времени выдерживания в буферном растворе без добавок и с добавлением крахмала и желатина: а) BChE (концентрации желатина и крахмала составляют 1.4% и 3% соответственно), б) Red (концентрации желатина и крахмала составляют 1 и 2% соответственно), в) Red + Luc. (концентрации желатина и крахмала составляют 0.5 и 2% соответственно). *p < 0.05 по сравнению с остаточной активностью в буфере.
На основании полученных экспериментальных данных были построены кинетические кривые термоинактивации ферментов в буферном растворе и вязких растворах крахмала и желатина. Все полученные зависимости в координатах уравнения первого порядка имеют вид кривых с “изломом”, что характерно для диссоциативного механизма термоинактивации олигомерных ферментов [13]. Начальные отрезки кинетических кривых соответствуют процессу диссоциации фермента на субъединицы (“быстрая инактивация”), а вторые линейные участки – процессу денатурации отдельных субъединиц (“медленная инактивация”). На рис. 2 в качестве примера приведены кинетические кривые термоинактивации BChE в растворах желатина и крахмала при различных температурах. Для Red и биферментной системы Red + Luc получены сходные зависимости.
Рис. 2.
Кинетические зависимости термоинактивации BChE в 1.4%-м растворе желатина (а) и 3%-м растворе крахмала (б) при различных температурах.
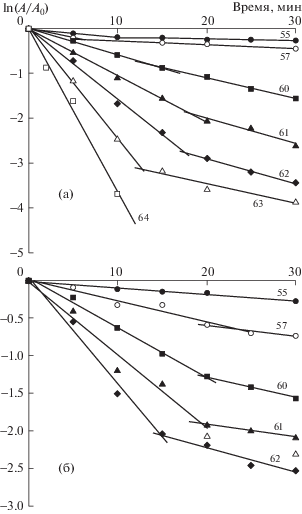
Из кинетических зависимостей термоинактивации ферментов были рассчитаны эффективные константы скорости термоинактивации k1 и k2 для “быстрой” и “медленной” стадий инактивации ферментов, соответственно, представляющие собой тангенс угла наклона кривых термоинактивации. В таблице 1 для примера приведены значения k1 и k2, полученные при анализе кривых термоинактивации BChE. Видно, что стабилизирующий эффект крахмала выражается замедлением как первой, так и второй стадий инактивации фермента. Для Red и Red + Luc не выявлено достоверных различий между значениями k1 и k2 для ферментов, функционирующих в буфере и растворах крахмала или желатина.
Таблица 1.
Эффективные константы скоростей первой (k1, мин–1) и второй (k2, мин–1) стадий температурной инактивации BChE в буферном растворе без добавок (контроль) и с добавлением желатина и крахмала при разных температурах (M ± m, n = 3)
| T, °C | Буфер | Желатин 1.4% | Крахмал 3% | |||
|---|---|---|---|---|---|---|
| k1 ⋅ 103 | k2 ⋅ 103 | k1 ⋅ 103 | k2 ⋅ 103 | k1 ⋅ 103 | k2 ⋅ 103 | |
| 55 | 47 ± 2 | 19 ± 1 | 19.5 ± 1.6* | 3.8 ± 0.6* | 12 ± 2* | 11.0 ± 1.4* |
| 57 | 58 ± 2 | 32 ± 3 | 38 ± 2* | 9.0 ± 0.8* | 24 ± 3* | 7.7 ± 1.3* |
| 60 | 53 ± 3 | 53 ± 4 | 49 ± 5 | 46 ± 7 | 67 ± 9* | 28 ± 3* |
| 61 | 114 ± 5 | 48 ± 5 | 104 ± 5 | 56 ± 5 | 98 ± 8* | 17 ± 2* |
| 62 | 185 ± 18 | 47 ± 20 | 158 ± 11 | 110 ± 8* | 142 ± 18* | 33 ± 3 |
| 64 | 174 ± 25 | 92 ± 7 | 456 ± 50* | – | 111 ± 9* | 21 ± 2* |
Таким образом, среди изученных ферментных систем повышение термодинамической стабильности при воздействии высоких температур (>60°C) наблюдали только для BChE в растворе крахмала.
Сравнение полученных результатов с литературными данными указывает на то, что термодинамическая и кинетическая стабильность ферментов может быть расширена введением дополнительной процедуры высушивания ферментов при их иммобилизации в гели крахмала и желатина. Так, в работе [14] показано, что высушивание биферментной системы Red + Luc, иммобилизованной в гели крахмала и желатина, существенно повышает ее устойчивость к химическим и физическим факторам среды: наблюдается расширение рН-оптимума в кислую и щелочную области, сохраняется высокая активность ферментов при увеличении концентраций солей, повышается термостабильность. Показана высокая стабильность ферментных препаратов, представляющих собой высушенные крахмальные или желатиновые диски, в процессе хранения: активность препаратов BChE, представляющих собой высушенные крахмальные диски, сохранялась более 300 суток [12], а активность препаратов Red + Luc в виде желатиновых дисков – не менее двух лет [10].
Таким образом, с целью достижения термодинамической и кинетической стабильности ферментов более предпочтительным является использование в качестве стабилизирующей добавки крахмала. Исходя из совокупности представленных результатов и литературных данных можно сделать вывод, что ключевым фактором стабилизации ферментов путем включения в полимерные гели крахмала и желатина является исключение воды при высушивании иммобилизованных ферментных препаратов. Полученные результаты являются основой для получения высокоактивных и стабильных ферментных препаратов для биологических анализов.
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
Исследование выполнено при финансовой поддержке РФФИ, Правительства Красноярского края, Красноярского краевого фонда науки в рамках научных проектов № 18–44–243010 “Стабилизация биферментной системы светящихся бактерий NADH:FMN-оксидоредуктаза + люцифераза путем помещения в гели и вязкие растворы биополимеров с целью усовершенствования реагента, используемого для оценки уровня загрязнения окружающей среды” и № 18–44–242003 “Конструирование ферментативного реагента для биолюминесцентного анализа: механизмы увеличения чувствительности и точности”.
Список литературы
Lonshakova-Mukina V., Esimbekova E., Kratasyuk V. // Sensors and Actuators B-Chemical. 2015. V. 213. P. 244–247.
Cheung M.S., Klimov D., Thirumalai D. // Proceedings of the National Academy of Sciences of the United States of America. 2005. V. 102. P. 4753–4758.
Stagg L., Zhang S.Q., Cheung M.S., et al. // Proceedings of the National Academy of Sciences of the United States of America. 2007. V. 104. P. 18976–18981.
Makowski L., Rodi D.J., Mandava S., et al. // J. Mol. Biol. 2008. V. 375. № 2. P. 529–546.
Ragoonanan V., Aksan A. // Transfusion Medicine and Hemotherapy. 2007. V. 34. P. 246–252.
Djabourov M. // Contemporary Physics. 1988. V. 29. № 3. P. 273–297.
Copeland L., Blazek J., Salman H., et al. // Food Hydrocolloids. 2009. V. 23. P. 1527–1534.
Munjal N., Sawhney S.K. // Enzyme and Microbial Technology. 2002. V. 30. № 5. P. 613–619.
Hoffmann I., Silva V.D., Nascimento M.G. // Journal of Brazilian Chemical Society. 2011. V. 22. № 8. P. 1559–1567.
Bezrukikh A., Esimbekova E., Nemtseva E., et al. // Analytical and Bioanalytical Chemistry. 2014. V. 406. № 23. P. 5743–5747.
Говорун А.Е., Есимбекова Е.Н., Кратасюк В.А. // ДАН. 2019. Т. 486. № 4. С. 500–503.
Лоншакова-Мукина В.И., Есимбекова Е.Н., Кратасюк В.А. // ДАН. 2018. Т. 479. № 4. С. 460–463.
Полторак О.М., Чухрай Е.С. // Итоги науки и техники. Сер. Биотехнология. 1986. Т. 5. С. 50–86.
Есимбекова Е.Н., Торгашина И.Г., Кратасюк В.А. // Биохимия. 2009. Т. 74. № 6. С. 853–859.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


