Доклады Российской академии наук. Науки о жизни, 2020, T. 491, № 1, стр. 137-140
МУЛЬТИФУНКЦИОНАЛЬНЫЕ КОМПЛЕКСЫ НА ОСНОВЕ НАНОЧАСТИЦ С АНТИСТОКСОВОЙ ФОТОЛЮМИНЕСЦЕНЦИЕЙ ДЛЯ ТЕРАНОСТИКИ HER2‑ПОЛОЖИТЕЛЬНЫХ ОПУХОЛЕЙ
Е. Л. Гурьев 1, А. С. Смышляева 1, Н. Ю. Шилягина 1, С. Шанвар 1, А. Б. Костюк 1, А. А. Шульга 2, Е. В. Коновалова 2, А. В. Звягин 1, 2, 3, академик РАН С. М. Деев 2, 3, *, академик РАН Р. В. Петров 2
1 Нижегородский государственный университет
им. Н.И. Лобачевского
Нижний Новгород, Россия
2 Институт биоорганической химии им. акад.
М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
3 Первый Московский государственный медицинский университет имени И.М. Сеченова Минздрава России
Москва, Россия
* E-mail: biomem@mail.ru
Поступила в редакцию 23.12.2019
После доработки 23.12.2019
Принята к публикации 23.12.2019
Аннотация
Перспективной стратегией в области разработки персонализированных подходов к лечению онкологических заболеваний представляется объединение диагностических и терапевтических функций в одном агенте. Возможность связать диагностику и терапию появилась с развитием нанобиотехнологий и реализовалась в концепции «тераностики». На сегодняшний день в рамках тераностики получен ряд перспективных агентов на основе наноматериалов, способных к диагностике, адресному терапевтическому воздействию и мониторингу ответа опухолевых клеток. В работе получен новый тип тераностических комплексов на основе антистоксовых нанофосфоров, покрытых полиэтиленгликолем и функционализированных рекомбинантным таргетным токсином DARPin-LoPE. Показано селективное связывание комплексов с клетками аденокарциномы молочной железы человека, гиперэкспрессирующих рецептор HER2, и специфическая токсичность в их отношении.
Разработка персонализированных подходов к лечению в настоящее время рассматривается как одна из основных и необходимых тенденций в терапии онкологических заболеваний. Перспективной стратегией в данном направлении представляется объединение диагностических и терапевтических функций в одном агенте [1, 2]. Такие возможности появились с развитием нанобиотехнологий и реализовались в концепции “тераностики” [3], подразумевающей создание агентов, способных к диагностике, адресному терапевтическому воздействию и мониторингу ответа опухолевых клеток.
Среди наноматериалов для задач тераностики широко используются фотолюминесцентные наночастицы, в частности антистоксовые нанофосфоры (НАФ). НАФ представляют собой нанокристаллы из неорганической матрицы, легированной ионами редкоземельных металлов из группы лантаноидов и обладают способностью к ап-конверсии света, т.е. преобразуют низкоэнергетические фотоны в фотоны более высокой энергии [4]. Фотолюминесценция (ФЛ) НАФ возбуждается низкоинтенсивным излучением в инфракрасном (ИК) диапазоне, глубоко проникающем в биоткани, в то время как максимумы эмиссии находятся в видимой и ИК-области, что позволяет эффективно регистрировать целевой ФЛ сигнал при минимальной автофлуоресценции ткани и рассеянии возбуждающего излучения [5]. Благодаря уникальным оптическим свойствам и химической стабильности НАФ активно используются для визуализации опухолевых клеток и других структур в организме [6] и служат платформой для сборки тераностических комплексов путем присоединения к ним направляющих и токсических модулей [7].
Разнообразие токсических модулей, обеспечивающих терапевтический эффект комплексов, представлено низкомолекулярными химическими агентами, белковыми токсинами, фотосенсибилизаторами, радиопрепаратами и другими [7, 8]. Особый интерес вызывают рекомбинантные таргетные токсины, объединяющие направляющий и терапевтический агент в единой полипептидной цепи [9], которые обладают не только терапевтическим действием, но и способностью специфично взаимодействовать с рецептором-мишенью на поверхности опухолевых клеток.
В данной работе нами получен новый тип тераностических комплексов на основе НАФ, покрытых полиэтиленгликолем (ПЭГ) и функционализированных рекомбинантным таргетным токсином DARPin-LoPE [10], специфичным к клинически значимому онкомаркеру HER2 [11]. Показано селективное связывание комплексов с клетками аденокарциномы молочной железы человека, гиперэкспрессирующими рецептор HER2, и специфическая токсичность в их отношении.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основой комплексов служили НАФ структуры ядро/оболочка NaY0.794Yb0.2Tm0.006F4/NaYF4 (рис. 1а), синтезированные методом сольватотермического разложения. Для легирования матрицы NaYF4 использовали ионы иттербия (Yb3+) и тулия (Tm3+). В результате были получены НАФ с максимумами эмиссии ФЛ в синей (474 нм) и ИК областях (801 нм). Наибольшая интенсивность ФЛ в ИК области спектра дает возможность эффективного применения данных НАФ для биомедицинского оптического имиджинга, позволяя с высокой чувствительностью зарегистрировать целевой сигнал ФЛ через слой биоткани толщиной до сантиметра.
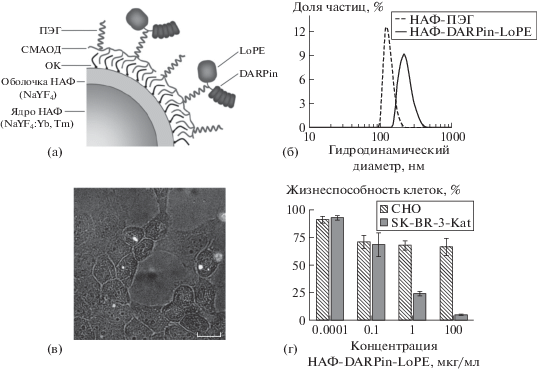
Рис. 1.
Свойства тераностических комплексов НАФ-DARPin-LoPE. а – структура комплексов. ОК – олеиновая кислота; б – гидродинамический диаметр НАФ-ПЭГ и НАФ-DARPin-LoPE; в, г – взаимодействие опухолевых клеток SK-BR-3-Kat, гиперэкспрессирующих рецептор HER2 (в) и клеток CHO, не экспрессирующих рецептор HER2, с комплексами НАФ-DARPin-LoPE. Наложение просветного изображения и ФЛ сигнала в диапазоне 420–840 нм при возбуждении на 980 нм. Масштабный отрезок 20 мкм; д – зависимость жизнеспособности клеток СНО (HER2-) и SK-BR-3-Kat (HER2+) от концентрации в среде комплексов НАФ-DARPin-LoPE. Время инкубации 96 ч.
Полученные НАФ были покрыты амфифильной полимерной оболочкой из сополимера малеинового ангидрида с 1-октадеценом (СМАОД), что придало им растворимость в водной среде и биосовместимость. Для увеличения коллоидной стабильности НАФ были покрыты дополнительной оболочкой из диглицидилового эфира ПЭГ (ПЭГ–ДГЭ). Покрытие ПЭГ значительно увеличивает длительность их циркуляции в крови, предотвращает ферментную деградацию в организме и позволяет избежать иммунной реакции [12].
Путем присоединения молекул ПЭГ-ДГЭ к карбоксильным группам СМАОД были получены НАФ, покрытые уплотненной оболочкой из СМАОД и ПЭГ (НАФ–ПЭГ). Гидродинамический диаметр НАФ–СМАОД, составил 177 ± 7 нм; после присоединения ПЭГ–ДГЭ гидродинамический диаметр снизился до 128 ± 17 нм (рис. 1б), что позволяет рассчитывать на эффективную доставку НАФ-ПЭГ в опухоль по пассивному пути.
Функция адресности и терапевтический эффект комплексов реализовывались посредством присоединения к НАФ рекомбинантного белка DARPin-LoPE [10] на основе адресного модуля неиммуноглобулиновой природы DARPin (альтернативный каркасный белок на основе анкирина), “узнающего” рецептор HER2, и фрагмента экзотоксина А Pseudomonas aeruginosa. Низкая иммуногенность эффекторного модуля LoPE позволяет рассчитывать на проведение повторных курсов лечения препаратами на его основе. Таргетный токсин DARPin-LoPE демонстрирует высокую эффективность в отношении HER2-гиперэкспрессирующих клеток рака молочной железы как in vitro, вызывая их гибель путем индукции апоптоза, так и in vivo [13].
К аминогруппам таргетного токсина DARPin–LoPE присоединяли гетеробифункциональный дериват полиэтленгликоля (SH–ПЭГ–NH2) с помощью линкера N-сукцинимидил 4-(p-малеимидофенил)-бутирата (SMPB), ПЭГ-модифицированный белок DARPin–LoPE конъюгировали с НАФ–СМАОД с использованием линкеров нулевой длины 1-этил-3-(3-диметиламинопропил) карбодиимида (EDC) и N-гидроксисульфо-сукцинимида (sulfo-NHS) [14]. В результате были получены комплексы НАФ-DARPin-LoPE со средним диаметром частиц 222 ± 37 нм (рис. 1б), при этом количество белка, приходящегося на 1 частицу, составило ∼150 молекул.
Для исследования специфичности комплексов использовали культуру клеток аденокарциномы молочной железы человека SK-BR-3-Kat, гиперэкспрессирующих рецептор HER2. Наличие на поверхности клеток SK-BR-3-Kat рецептора HER2 было подтверждено окрашиванием HER2-специфичными моноклональными антителами, конъюгированными с флуоресцентным красителем (Herceptin-FITC). В качестве контрольных (без экспрессии HER2) использовали клетки яичника китайского хомячка СНО. Для предотвращения интернализации клетки инкубировали в присутствии ненаправленных частиц НАФ-ПЭГ и комплексов при 4°С в течение 1 ч. Специфичность маркирования клеток анализировали с использованием системы широкопольной флуоресцентной микроскопии, оптимизированной для регистрации антистоксовой ФЛ. На микрофотографиях клеток SK-BR-3-Kat, инкубированных с комплексами НАФ-DARPin-LoPE видно селективное накопление частиц на клетках (рис. 1в). В случае клеток CHO накопление частиц было выражено гораздо слабее, частицы располагаются хаотично (рис. 1г). При инкубации ненаправленных частиц НАФ-ПЭГ с обоими типами клеток, специфичного накопления частиц на клетках также не наблюдалось. Данные микроскопии позволяют сделать вывод о специфическом связывании комплексов НАФ-DARPin-LoPE с поверхностью клеток, гиперэкспрессирующих рецептор HER2.
В исследовании цитотоксичности методом МТТ-теста было показано, что комплексы НАФ-DARPin-LoPE значительно снижают жизнеспособность клеток SK-BR-3-Kat, гиперэкспрессирующих рецептор HER2 (рис. 1г); IC50 составила 0.4 мкг/мл. В отношении HER2-негативных клеток CHO значимого цитотоксического эффекта не наблюдали до концентраций комплексов 200 мкг/мл. Ненаправленные НАФ-ПЭГ в тех же концентрациях не оказывали влияния на жизнеспособность клеток SK-BR-3-Kat и CHO. Значительное снижение жизнеспособности HER2-положительных клеток в присутствии комплексов НАФ-DARPin-LoPE обусловлено селективным действием таргетного токсина DARPin-LoPE, вызывающего элиминацию опухолевых клеток за счет блокирования биосинтеза белка [13].
Полученные комплексы на основе НАФ, покрытых ПЭГ и функционализированных рекомбинантным таргетным токсином DARPin-LoPE, потенциально могут быть использованы для решения задач диагностики и терапии HER2 положительных опухолей. Предложенная технология сборки комплексов позволит создавать тераностические агенты с различным набором визуализирующих и терапевтических модулей, в том числе используя эффект сочетанного воздействия на опухоль. Избирательная доставка в опухоль может быть обеспечена путем пассивного накопления благодаря эффекту “усиленного накопления и удержания” (EPR-эффект) [15], обусловленного особенностями дезорганизованного сосудистого русла опухоли, и активного нацеливания комплексов за счет адресных молекул. Представленные результаты свидетельствуют о высоком потенциале разработанных комплексов для задач тераностики онкологических заболеваний.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Работа поддержана федеральной целевой программой Министерства образования и науки РФ “Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы” (cоглашение № RFMEFI58418X0033).
Список литературы
Deyev S.M., Lebedenko E.N. // Mol. Biol. 2017. V. 51. № 6. P. 788–803.
Kim H., Kwak G., Kim K., et al. // Biomaterials. 2019. V. 213. P. 119207.
Singh R. // 3 Biotech. 2019. V. 9. № 11. P. 415.
Heer S., Kömpe K., Güdel H.U., et al. // Adv. Mater. 2004. V. 16. P. 2102–2105.
Chen J., Zhao J.X. // Sensors. 2012. V. 12. P. 2414–2435.
Nguyen P.D., Son S.J., Min J. // J. Nanosci. Nanotechnol. 2014. V. 14. № 1. P. 157–174.
Guryev E.L., Volodina N.O., Shilyagina N.Y., et al. // Proc. Natl. Acad. Sci. USA. 2018. V. 115. № 39. P. 9690–9695.
Frankel A.E., Woo J.H., Neville D.M. Immunotoxins. In: Oldham R.K., Dillman R.O., editors. Principles of Cancer Biotherapy. Dordrecht: Springer; 2009. P. 407–449.
Shapira A., Benhar I. // Toxins. 2010. V. 11. P. 2519–2583.
Прошкина Г.М., Киселева Д.В., Шилова О.Н. и дp. // Молекулярная биология. 2017. Т. 51. № 6. С. 997–1007.
Ménard S., Casalini P., Campiglio M., et al. // Cell. Mol. Life Sci. 2004. V. 61. № 23. P. 2965–2978.
Andreani T., de Souza A.L., Kiill C.P., et al. // Int. J. Pharm. 2014. V. 473. № 1–2. P. 627–635.
Sokolova E.A., Shilova O.N., Kiseleva D.V., et al. // Int. J. Mol. Sci. 2019. V. 20. № 10. P. 2399.
Hermanson G., editor. Bioconjugate Techniques. 2nd Edition. Rockford: Academic Press; 2008.
Maeda H. // J. Control Release. 2012. V. 164. № 2. P. 138–144.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


