Доклады Российской академии наук. Науки о жизни, 2020, T. 491, № 1, стр. 184-188
АТИПИЧНЫЕ АЦЕТИЛХОЛИНОВЫЕ РЕЦЕПТОРЫ НА НЕЙРОНАХ ВИНОГРАДНОЙ УЛИТКИ
А. С. Пивоваров 1, Т. А. Палихова 1, Г. М. Николаев 1, А. Н. Великанов 1, Н. А. Васильева 1, И. Е. Кашеверов 2, Ю. Н. Уткин 2, *, член корреспондент РАН В. И. Цетлин 2
1 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
2 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
* E-mail: utkin@mx.ibch.ru
Поступила в редакцию 13.11.2019
После доработки 13.11.2019
Принята к публикации 13.11.2019
Аннотация
Методом электрофизиологии исследовано влияние лигандов никотиновых холинорецепторов (НХР) на деполяризацию, индуцированную ацетилхолином в нейронах улитки Helix lucorum. Обнаружено, что α-конотоксин PnIA[R9,L10], селективный антагонист α7 НХР, и α-кобратоксин (антагонист α7 и мышечных НХР) подавляли деполяризацию нейронов. Флуоресцентная микроскопия показала окрашивание нейронов флуоресцентно меченным α-бунгаротоксином, снижавшееся предварительной обработкой α-кобратоксином. Индуцированная деполяризация подавлялись также α-конотоксином RgIA, селективным ингибитором α9 НХР. В отличие от НХР Lymnaea stagnalis, слабо чувствительных к антагонистам мышечных НХР нейротоксину II и α-конотоксину GI, рецепторы H. lucorum наиболее эффективно ингибировались этими антагонистами. Полученные результаты, а также обнаруженная ранее чувствительность исследованных в данной работе рецепторов к лигандам мускариновых рецепторов свидетельствуют о необычном атипичном фармакологическом профиле НХР H. lucorum.
Холинергическая передача представляет собой один из древних механизмов межклеточной сигнализации. Ключевые ферменты синтеза ацетилхолина обнаружены у самых низших организмов – архей и грибов [1], а никотиновые холинорецепторы обнаружены у плоских и круглых червей, эволюционно двух самых ранних многоклеточных групп. Холинорецепторы включают две основные группы – никотиновые (НХР) и мускариновые (МХР) рецепторы. НХР – это лиганд-управляемый ионный канал, который открывается при активации рецептора ацетилхолином или никотином. НХР состоят из 5 субъединиц, образующих пору, и включают два основных типа – нейронные и мышечные [2, 3], локализованные в нервной системе или в мышцах соответственно. МХР относятся к метаботропным G-белок-зависимым рецепторам. Мускарин является агонистом МХР и его связывание с рецептором приводит к активации G-белка, что вызывает в итоге изменение концентрации ионов K+ в клетке за счет модуляции калиевого тока М-типа [4].
Большая часть данных о НХР и МХР получена в исследованиях на позвоночных. Сведения о холинорецепторах организмов, находящихся на более низких ступенях эволюции, не столь многочисленны. Нами исследован фармакологический профиль НХР, расположенных на соме идентифицированных нейронов улитки Helix lucorum. Ранее было показано, что НХР идентифицированных нейронов улитки H. aspersa являются хлор-проводящими ионными каналами [5]. Исследование холинорецепторов на соме нейронов ЛПа3, ППа3 и ППа4 H. lucorum выявило их чувствительность к лигандам как никотиновых, так и мускариновых рецепторов [6, 7], однако вопрос о подтипах НХР нейронов улиток оставался открытым.
Методом электрофизиологии нами исследована способность α-кобратоксина (СТХ) кобры Naja kaouthia, нейротоксина II (НТ II) кобры N. oxiana, α-конотоксинов PnIA[R9,L10], GI и RgIA, являющихся антагонистами различных подтипов НХР, а также агониста НХР эпибатидина изменять величину деполяризации нейронов, вызванной локальным подведением ацетилхолина (АХ) к соме нейрона (АХ-деполяризацию). СТХ является эффективным антагонистом НХР мышечного и нейронного α7 типа, а НТ II и GI селективно блокируют НХР мышечного типа; PnIA[R9,L10] и RgIA – блокаторы НХР α7 и α9/α10 типа соответственно [8]. Эпибадитин представляет собой агонист гетеромерных нейронных НХР, однако является антагонистом нейронного α9α10 НХР [9].
Эксперименты, проведенные по методике [7], выявили способность всех указанных выше соединений подавлять обратимо амплитуду АХ-деполяризации нейронов (табл. 1). Наибольшей ингибирующей активностью обладает PnIA[R9,L10], избирательный антагонист НХР α7 типа.
Таблица 1.
Влияние нейротоксинов на амплитуду АХ-деполяризации нейронов. Представлены концентрации лигандов, вызывавших снижение амплитуды на 55–85%
| Нейротоксин | Амплитуда АХ-деполяризации при указанной концентрации токсина, % от контроля* | ||||
|---|---|---|---|---|---|
| 50 нМ | 100 нМ | 500 нМ | 1 мкМ | 10 мкМ | |
| СТХ | 42.60 ± 8.16** n = 4 |
||||
| Конотоксин PnIA[R9,L10] | 43.77 ± 8.77 n = 4 |
45.98 ± 6.77 n = 6 |
|||
| НТ II | 44.83 ± 5.46 n = 2 |
40.13 ± 6.34 n = 5 |
|||
| Эпибатидин | 41.00 ± 15.57 n = 1 |
13.67 ± 1.86 n = 1 |
|||
| α-конотоксин GI | 36.67 ± 9.67 n = 4 |
||||
| α-конотоксин RgIA | 28.25 ± 9.21 n = 5 |
||||
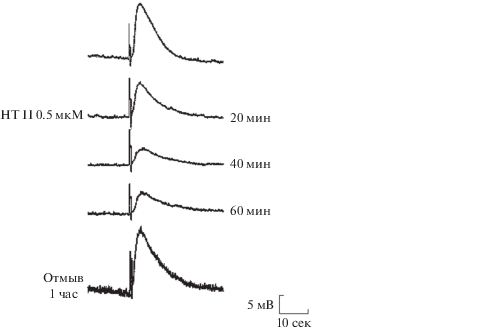
Затем следует НТ II (рис. 1), избирательный антагонист НХР мышечного подтипа, далее – RgIA (блокирует НХР α9/α10 подтипа) и GI (блокирует только мышечный НХР). Наименее активен СТХ, ингибирующий НХР как мышечного, так и α7 подтипа. По чувствительности к нейротоксинам рецепторы H. lucorum существенно отличаются от НХР моллюска Lymnaea stagnalis, фармакологически подобных α7 НХР млекопитающих, но являющихся Сl- каналами. НХР L. stagnalis различаются по чувствительности к α-конотоксинам, а их активность значительно сильнее ингибируется СТХ, а не НТ II [10]. СТХ достаточно легко диссоциировал с НХР нейронов H. lucorum, хотя диссоциация этого токсина с α7 НХР млекопитающих протекает значительно медленнее [11].
Рис. 1.
Действие НТ II (0.5 мкM) на деполяризацию нейрона ЛПа3, вызванную локальным подведением ацетилхолина к соме. АХ подавали с интервалом в 5 мин. Цифры справа от записей – время после введения нейротоксина в проточную камеру с препаратом. Калибровки: амплитуды потенциала – 5 мВ, времени – 10 с.
Эпибатидин в концентрации 1 мкМ вызывал кратковременную деполяризацию нейрона, что согласуется с данными об активации этим соединением α7 НХР позвоночных (EC50 1–2 мкМ) [12]. Однако, после воздействия эпибатидина вслед за кратковременной деполяризацией наблюдали подавление амплитуды АХ-деполяризации.
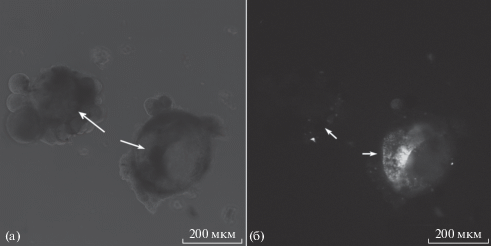
Из представленных результатов следует, что НХР нейронов H. lucorum по чувствительности к лигандам различных типов НХР отличаются от рецепторов позвоночных, т.е. не обладают избирательной чувствительностью к лигандам одного из подтипов. Поскольку ранее была выявлена чувствительность нейронов улитки к α-бунгаротоксину (БТХ) [6], для локализации НХР на соме нейрона использовали БТХ, меченный флуоресцентными красителем CF™405S, (БТХ-А-405, Biotium). Изображения изолированных нейронов до и после инкубации с БТХ-А-405 получали с использованием конфокального микроскопа (Olympus PV10i, Япония) и анализировали, применяя программу ImageJ. В серии экспериментов (n = 4) изолированные нейроны инкубировали 20 мин с БТХ-А-405 (100 нМ). Для определения неспецифического мечения часть нейронов перед добавлением БТХ-А-405 инкубировали 20 мин с СТХ (10 мкМ). Инкубация с БТХ-А-405 приводит к окрашиванию поверхности нейронов, которое на 57.0 ± 13.5% (n = 4) подавляется СТХ (рис. 2), что свидетельствует о специфическом связывании БТХ с НХР нейронов.
Рис. 2.
Изображения двух изолированных командных нейронов виноградной улитки, полученные с использованием сканирующего лазерного конфокального микроскопа (Olympus PV10i, Япония). Для возбуждения флуоресценции образцы облучали лазером с длиной волны 405 нм, используя 10% мощности, что практически исключает автофлуоресценцию. а – изображения двух нейронов (обозначены разными стрелками) в режиме “фазовый контраст” без фармакологического воздействия. б – после окрашивания бунгаротоксином БТХ-А-405. Нейрон в левом верхнем углу изображения перед добавлением флуоресцентно меченного БТХ инкубировали с СТХ; нейрон в нижнем правом углу не подвергался фармакологической обработке до добавления БТХ-А-405. Показан типичный результат серии экспериментов.
Таким образом, полученные результаты, наряду с ранее опубликованными данными, свидетельствуют о том, что:
1) НХР нейронов улитки имеют сайты связывания никотиновых и мускариновых лигандов;
2) НХР нейронов улитки обладают чувствительностью к лигандам НХР мышечного и нейронного подтипов;
3) Активация холинорецептора открывает ионный канал для аниона Cl–.
Ранее обнаруженная чувствительность НХР виноградной улитки к БТХ [6] могла бы указывать на присутствие рецепторов мышечного и α7 типов. Однако известно, что достаточно широко распространены и α9 НХР [13], которые тоже ингибируются БТХ. Полученные в настоящей работе данные с использованием набора антагонистов указывают на чувствительность нейронов H. lucorum к лигандам всех вышеперечисленных подтипов НХР. Из всего семейства НХР, только α9 подтип, чувствительный к α-конотоксину RgIA, способен связывать лиганды мускариновых рецепторов, которые его ингибируют [9]. Обнаруженные нами разнонаправленные эффекты эпибатидина, потенцирующего, а затем и подавляющего АХ-деполяризацию, объясняют чувствительность к α-конотоксину RgIA. Эпибатидин является агонистом практически всех известных типов НХР, но антагонистом α9 НХР.
Полученные нами результаты о неселективности НХР H. lucorum, а также обнаруженная ранее чувствительность ионотропных холинорецепторов нейронов виноградной улитки к лигандам никотиновых и мускариновых рецепторов [6, 7], свидетельствуют о необычном атипичном фармакологическом профиле НХР нейронов H. lucorum. Подобная неселективность по отношению к никотиновым и мускариновым лигандам была обнаружена ранее у НХР нематоды Ascaris suum [14] и медоносной пчелы Apis mellifera [15], организмов, стоящих на более низких ступенях эволюции, чем позвоночные. Это может указывать на эволюционные изменения, направленные на появление селективности и повышение специализации холинорецепторов в процессе эволюции.
Список литературы
Kawashima K., Misawa H., Moriwaki Y., et al. Ubiquitous expression of acetylcholine and its biological functions in life forms without nervous systems // Life Sci. 2007. V. 80. № 24. P. 2206–2209. https://doi.org/10.1016/j.lfs.2007.01.059
Papke R.L. Merging old and new perspectives on nicotinic acetylcholine receptors // Biochem. Pharmacol. 2014. V. 89. № 1. P. 1–11. https://doi.org/10.1016/j.bcp.2014.01.029
Zoli M., Pucci S., Vilella A., et al. Neuronal and Extraneuronal Nicotinic Acetylcholine Receptors // Curr. Neuropharmacol. 2018. V. 16. № 4. P. 338–349. https://doi.org/10.2174/1570159X15666170912110450
Kanemoto Y., Ishibashi H., Doi A., et al. An electrophysiological study of muscarinic and nicotinic receptors of rat paratracheal ganglion neurons and their inhibition by Z-338 // Br. J. Pharmacol. 2002. V. 135. № 6. P. 1403–1414. https://doi.org/10.1038/sj.bjp.0704610
Finkel A.S. A cholinergic chloride conductance in neurons of Helix aspersa // J. Physiol. 1983. V. 344. P. 119–135. https://doi.org/10.1113/jphysiol.1983.sp014928
Пивоваров А.С., Дроздова Е.И. Идентификация холинорецепторов на соме нейронов ППа3 и ЛПа3 виноградной улитки // Нейрофизиология. 1992. Т. 24. № 1. С. 77–86.
Пивоваров А.С., Саганелидзе Г.Н. Идентификация никотиновых и мускариновых холинорецепторов сомы нейрона ППа4 виноградной улитки // Нейрофизиология. 1988. Т. 20. № 2. С. 203–212.
Dutertre S., Nicke A., Tsetlin V.I. Nicotinic acetylcholine receptor inhibitors derived from snake and snail venoms // Neuropharmacology. 2017. V. 127. P. 196–223. https://doi.org/10.1016/j.neuropharm.2017.06.011
Verbitsky M., Rothlin C.V., Katz E., et al. Mixed nicotinic-muscarinic properties of the alpha9 nicotinic cholinergic receptor // Neuropharmacology. 2000. V. 39. № 13. P. 2515–2524. https://doi.org/10.1016/s0028-3908(00)00124-611044723
Vulfius C.A., Krasts I.V., Utkin Y.N., et al. Nicotinic receptors in Lymnaea stagnalis neurons are blocked by alpha-neurotoxins from cobra venoms. // Neurosci. Lett. 2001. V. 309. № 3. P. 189–192. https://doi.org/10.1016/s0304-3940(01)02081-x
Utkin Y.N., Kukhtina V.V., Kryukova E.V., et al. “Weak toxin” from Naja kaouthia is a nontoxic antagonist of alpha 7 and muscle-type nicotinic acetylcholine receptors // J. Biol. Chem. 2001. V. 276. № 19. P. 15810–15815. https://doi.org/10.1074/jbc.M100788200
Gerzanich V., Peng X., Wang F., et al. Comparative pharmacology of epibatidine: a potent agonist for neuronal nicotinic acetylcholine receptors // Mol. Pharmacol. 1995. V. 48. № 4. P. 774–782.
Hone A.J., Servent D., McIntosh J.M. α9-containing nicotinic acetylcholine receptors and the modulation of pain // Br. J. Pharmacol. 2018. V. 175. № 11. P. 1915–1927. https://doi.org/10.1111/bph.13931
Colquhoun L., Holden-Dye L., Walker R.J. The pharmacology of cholinoceptors on the somatic muscle cells of the parasitic nematode Ascaris suum // J. Exp. Biol. 1991. V. 158. P. 509–530.
Wüstenberg D.G., Grünewald B. Pharmacology of the neuronal nicotinic acetylcholine receptor of cultured Kenyon cells of the honeybee, Apis mellifera // J. Comp. Physiol. A: Neuroethol. Sens. Neural Behav. Physiol. 2004. V. 190. № 10. P. 807–821. https://doi.org/10.1007/s00359-004-0530-7
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


