Доклады Российской академии наук. Науки о жизни, 2020, T. 491, № 1, стр. 189-193
КИНЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ В МОЗГЕ ЧЕЛОВЕКА. ПРОТОННАЯ БЛОКАДА АЦЕТИЛХОЛИНЭСТЕРАЗЫ И PH-ИМПУЛЬС В МЕХАНИЗМЕ ФУНКЦИОНИРОВАНИЯ ХОЛИНЕРГИЧЕСКОГО СИНАПСА
Член-корреспондент РАН С. Д. Варфоломеев 1, В. И. Быков 2, *, С. Б. Цыбенова 2
1 Московский Государственный Университет
им. М.В. Ломоносова, Институт физико-химических основ функционирования сети нейронов и искусственного интеллекта
Москва, Россия
2 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: vibykov@mail.ru
Поступила в редакцию 09.09.2019
После доработки 09.09.2019
Принята к публикации 09.09.2019
Аннотация
Предложена кинетическая модель, описывающая динамику синаптического “разряда” с учетом кинетики инжекции нейромедиатора в синаптическую щель, pH-зависимости каталитической активности фермента и диффузионного вывода протонов. Модель дает физико-химическое объяснение для ряда принципиально важных физиологических феноменов, таких как нервно-мышечный паралич, молекулярный механизм нейрологической памяти, действия некоторых нейротоксинов и лекарств.
Исследование поведения системы нейросетей мозга человека – одна из ключевых задач современного естествознания [1, 2]. Функционирование системы межнейронных контактов, синапсов в процессе передачи возбуждения от одного нейрона к другому – ключевой процесс в операционном поведении нейросетей мозга. Принципиально важную многофункциональную роль в нейронных сетях играют процессы на основе нейромедиатора ацетилхолина (холинергические синапсы). Межклеточные контакты синаптической природы осуществляются путем введения (механического впрыскивания) везикул, наполненных ацетилхолином в гелиевую среду синаптической щели, насыщенную высокой концентрацией ацетилхолинэстеразы, гидролизующей ацетилхолин с образованием холина и уксусной кислоты (физические и концентрационные характеристики холинергического синапса см. ниже). Ацетилхолин преодолевает гидролитический барьер ацетилхолинэстеразы, достигает постсинаптической мембраны, связывается с ацетилхолиновыми рецепторами, действие которых вызывает передачу электрического возбуждения другому нейрону [3].
По крайней мере, два физиологических явления определяются работой холинергических синапсов:
1) Передача нейронного возбуждения и реализация механизма нейромышечного сокращения. Механизм передачи сигнала и мышечного сокращения – область большого научного и практического интереса. Механизмы действия нейропаралитических ядов (пестициды, боевые отравляющие вещества, некоторые лекарственные препараты) – предмет широкого и достаточно глубокого изучения в современной научной литературе [3–5]. Нервнопаралитические яды – ингибиторы ацетихолинэстеразы синаптической щели, обеспечивающие почти беспрепятственный транспорт ацетилхолина до постсинаптической мембраны и постоянное сокращение (без расслабления) мышечных волокон.
2) Существуют весьма обоснованные представления об определяющей роли ацетилхолина, холинергических синапсов и рецепторов в осуществлении механизмов памяти и обучения [6].
Наиболее популярной и, на наш взгляд, физически обоснованной представляется теория записи информации по механизму “открыт–закрыт” холинергический синапс, где информация представлена “деревом” (3D-образом) связанных между собой нейронов возбуждаемых специализированным сигналом [7].
В настоящее время достаточно подробно исследована структура ацетилхолинэстеразы человека, возможных полиморфных модификаций и ряда медицинских проявлений, связанных с этими модификаторами.
Наиболее фундаментальные результаты о механизме действия холинэстераз получены методами QM/MM моделирования на основе использования суперкомпьютерных технологий [8–11]. Активный центр ацетилхолинэстеразы включает два ключевых компонента, взаимодействие с которыми может принципиальным образом регулировать каталитическую активность. Для холинэстеразы человека это Ser203, по которому может идти необратимое ингибирование при фосфорилировании и His447, протонирование которого ведет к обратимой блокировке активности.
Нам представляется, что следующим существенным шагом вперед является системное моделирование механизма функционирования синапса как основополагающего элемента функционирования нейрональной сети. Кинетическое поведение ацетилхолинэстеразы определяется двумя особенностями:
1) Фермент характеризуется “неклассической” зависимостью скорости реакции от концентрации субстрата. Это фермент с ингибированием ферментативной активности высокими концентрациями ацетилхолина, при этом ингибирование проявляется при работе фермента в физиологических условиях [5, 12].
2) Как и все сериновые гидролазы, каталитическая функция которых определяется участием имидазольной группы гистидина, холинэстеразы ингибируются ионами водорода с pKa имидазольной группы около 7 (Kδ ∼ 10–7 М).
В настоящее время в первом приближении известны основные параметры функционирования холинергического синапса:
1) Толщина синаптической щели для разных категорий межклеточных контактов лежит в диапазоне 20–100 нм, диаметр площадки контакта (0.5–2) ⋅ 10–4 см [13], при этом контакт нейрон–нейрон (условно назовем это m-контактом) меньше чем контакт нейрон–мышца (нейромышечная передача сигнала с участием мотонейрона (условно назовем это n-j-контактом).
2) Концентрация ацетилхолина, нейромедиатора – субстрата ацетилхолинэстеразы, при инжекции его в синаптическую щель с поверхности пресинаптической мембраны при “разряде” синапса достаточно высока. Концентрация ацетилхолина в везикуле достигает 0.1–1 М [12, 14], при “разряде” нескольких везикул с переносом ацетилхолина в синаптическую щель при известной геометрии щели, концентрация S0 достигает значения 10–300 Ммоль [14]. При относительной малой толщине щели диффузионное распределение субстрата происходит в высшей степени быстро.
3) Критический параметр – концентрация фермента в синаптической щели. Оценку диапазона концентрации фермента можно сделать на основании сопоставления времени гидролиза (несколько миллисекунд) со скоростью ферментативной реакции. Для того, чтобы фермент при известной kcat был способен гидролизовать миллимолекулярную концентрацию субстрата за несколько миллисекунд его концентрация не может быть ниже 5–50 ммоль. Таким образом, концентрация ацетилхолинэстеразы в полисахаридном геле синаптической щели также исключительно высока. Для того, чтобы гидролизовать в норме нейромедиатор практически полностью и не дать ему “заселить” ацетилхолиновые рецепторы постсинаптической мембраны, необходима исключительно высокая концентрация фермента (см. ниже) [12, 14].
4) Принципиальной особенностью функционирования холинергического синапса является продукция в синаптической щели ионов водорода в результате образования достаточно сильной уксусной кислоты (pKa ∼ 4). При проведении реакции гидролиза ацетилхолина в растворе кислотный продукт практически мгновенно нейтрализуется буферными компонентами раствора и практически не сказывается на кинетическом поведении системы [5]. Однако, в условиях высокой концентрации субстрата и фермента в макрокинетических условиях синаптической щели процесс продукции кислоты является принципиально важным и должен быть учтен при описании кинетики процесса. pH-зависимость каталитической активности ацетилхолинэстеразы контролируется ионогенной группой гистидина – 447 с pKa около 7. При этом протонирование этой каталитически важной группы приводит к полной обратимой блокировке активности фермента.
“Очистка” синапса от продуцированных ацетилхолинэстеразой протонов может происходить в первую очередь путем диффузии протонов из синаптической щели полисахаридного геля, поскольку не являются протон-проводящими средами. Оценка времени освобождения синапса путем диффузии протона в полимерной среде может быть проведена в первую очередь по уравнению
где $\ell $ – диффузионный путь, D – коэффициент диффузии.Если принять $\ell $ – радиус межклеточного контакта равной 2 ⋅ 10–5 см, коэффициент диффузии – 5 ⋅ 10–5 см2/с (предельно высокое значение коэффициента диффузии протона в полимерной среде), оценка ${{\tau }_{{дисс{{{\text{H}}}^{ + }}}}}$ приводит к значению порядка ∼1 ⋅ 10–5 с [15]. Время “разряда” синапса в разных работах оцениваются по-разному: от 20–50 микросекунд [13, 14] до нескольких миллисекунд [12].
Динамику синаптического “разряда” с учетом кинетики инжекции нейромедиатора в синаптическую щель, pH-зависимости каталитической активности фермента и диффузионного вывода протонов описывает система уравнений
(2)
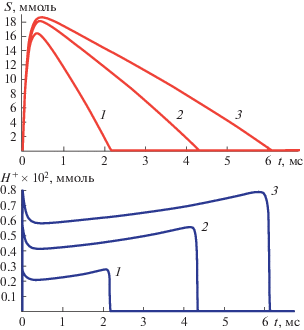
$\begin{gathered} \frac{{dS}}{{dt}} = \alpha {{S}_{0}}{{e}^{{ - \delta t}}} - \frac{{{{k}_{{cat}}}{{E}_{0}}S}}{{(1 + {{{\text{H}}}^{ + }}{\text{/}}{{K}_{a}})({{K}_{m}} + S + {{S}^{2}}{\text{/}}{{K}_{i}})}}, \\ \frac{{d{{{\text{H}}}^{ + }}}}{{dt}} = \frac{{{{k}_{{cat}}}{{E}_{0}}S}}{{(1 + {{{\text{H}}}^{ + }}{\text{/}}{{K}_{a}})({{K}_{m}} + S + {{S}^{2}}{\text{/}}{{K}_{i}})}} - \beta {{{\text{H}}}^{ + }}, \\ \end{gathered} $Процесс продукции протонов ацетилхолинэстеразой драматически сказывается на кинетическом поведении системы. На рис. 1 и 2 представлена динамика “разряда” ацетилхолинового синапса при различных концентрациях E0 и параметра диссипации протонов β. Почти синхронно с вводом в синаптическую щель нейромедиатора растет концентрация протонов и pH падает практически до 5. Продолжительность H+- импульса строго коррелирует со временем гидролиза нейромедиатора. В рамках данной модели описать экспериментально наблюдаемый процесс гидролиза нейромедиатора (τ ∼ 3 мс) удается лишь при высоких значениях E0 и β. Формирование pH-импульса имеет почти прямоугольный характер и характеризуется относительно плоской вершиной (см. рис. 1 и рис. 2).
Рис. 1.
Динамика “разряда” ацетилхолинового синапса и концентрации H+ при значениях параметров: S0 = 18.5 ммоль; α = 104 с–1; β = 106 с–1; δ = 9 ⋅ 103; kcat = 7 ⋅ 103 с–1; Km = 0.058 ммоль; Ki = 17.9 ммоль; Ka = 10–4 ммоль и различных концентрациях фермента E0: 1 – E0 = 80 ммоль; 2 – E0 = 50 ммоль; 3 – E0 = 30 ммоль.
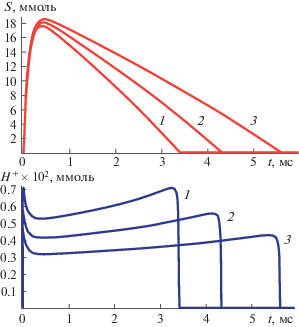
Рис. 2.
Расчетные кривые динамики изменения концентраций ацетилхолина и протонов в синаптической щели при значениях параметров: S0 = 18.5 ммоль; E0 = 50 ммоль; α = 104 с–1; δ = 9 ⋅ 103; kcat = 7 ⋅ 103 с–1; Km = 0.058 ммоль; Ki = 17.9 ммоль; Ka = 10–4 ммоль и при варьировании β: 1 – β = 4 ⋅ 106 с –1; 2 – β = 106 с–1; 3 – β = 5 ⋅ 105 с–1.
Проведенный анализ приводит к некоторым важным заключениям.
Функционирование нервно-мышечного синаптического контакта (n–j контакта) может протекать в двух режимах:
1) τpH имп < 1/ω, где ω – частота возбуждения нейрона. Это нормальный режим, при котором синапс освобождается от протонов раньше, чем приходит следующий нейромедиатор синапса;
2) τpH имп > 1/ω, это патологичное состояние, при котором возбуждение нейрона происходит раньше диссипации протонов. В этом режиме ацетилхолинэстераза блокирована по активному центру, фермент обратимо инактивирован, нейромедиатор практически беспрепятственно преодолевает синаптическую щель и связывается с рецепторами постсинаптической мембраны. Если это происходит при нервно-мышечной передаче – мышца всегда находится в сокращенном состоянии. Это нервно-мышечный паралич. По-видимому, процессы такого характера происходят при инсультных поражениях, коме и родственных нейропатологиях.
Если учесть большую роль ацетилхолина и ацетилхолиновых синапсов в механизмах нейропатологической памяти и обучения [6], H+ блокировка холинергического синапса может служить механизмом записи и поддержания информации. В рамках клеточной теории нейрологической памяти информация создается и хранится в виде “3D-образа” открытых нейрональных контактов, поддерживаемых нейросетью определенное время и активируемых сигналом востребованности. Для синаптических холинергических контактов этого типа (m-синапсы) условием сохранения “3D-образа” является устойчивая проницаемость синапсов по всей совокупности нейрональных контактов, задействованных в формировании “3D-образа”. Условием такого рода состояния является τpH имп > 1/ω для каждого синапса цепи.
Развитая модель достаточно адекватно описывает поведение холинергических синапсов при отравлении организма отравляющими веществами и пестицидами, терапевтические эффекты “ботокса”, лекарственные эффекты ингибиторов ацетилхолинэстеразы при терапии болезни Альцгеймера.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Работа поддержана Российским научным фондом (грант № 18–13–00030).
Список литературы
Варфоломеев С.Д., Семенова Н.А., Быков В.И., и др. Кинетика химических процессов в мозге человека. Моделирование BOLD-сигнала при фМРТ исследовании // ДАН. 2019. Т. 488. № 2. С. 39–43.
Varfolomeev S.D., Semenova N.A., Ublinskiy M.V. et al. fMRI and MR-spectroscopy in research on triggering and autostabilization of N-acetylaspartate // Chem. Phys. Let. 2019. V. 729. P. 84–91.
Сергеев П.В., Шимановский Н.Л., Петров В.Н. Рецепторы физиологически активных веществ. 2-е изд. Волгоград: Семь ветров, 1999.
Rozengart E.V., Basova N.E., Moralev S.N., et al. Research on cholinesterases in the Soviet Union and Russia: a historical perspective // Chemico-Biological Interactions. 2013. V. 203. № 1. P. 3–9.
Rosenberry T.L., Mallender W.D., Thomas P.J., et al. A steric blocade model for inhibition of acetylcholinesterase by peripheral site ligands and substrate // Chemico-Biological Interactions. 1999. V. 119–120. P. 85–97.
Hasselmo M.E. The role of acetylcholine in learning and memory // Current Opinion in Neurobiology. 2006. V. 16. № 6. P. 710–715.
Титов С.А. Нейрохимические основы памяти. В: Ашмарин И.П., Стукалов П.В., Ещенко Н.Д., ред. Нейрохимия. М.: Изд. Института биомедицинской химии РАМН, 1996. С. 370–414.
Lushchekina S.V., Schopfer L.M., Grigorenko B.L., et al. Optimization of cholinesterase-based catalytic bioscavengers against organophosphorus agents // Frontiers in Pharmacology. 2018. V. 9. № 211. P. 1–13.
Немухин А.В., Кулакова А.М., Лущекина С.В., и др. Моделирование химических превращений в активных центрах холинэстераз методами квантовой теории // Вестник Московского университета. Серия 2: Химия. 2015. Т. 56. № 6. С. 343–347.
Nemukhin A.V., Grigorenko B.L., Morozov D.I., et al. On quantum mechanical-molecular mechanical (QM/MM) approaches to model hydrolysis of acetylcholine by acetylcholinesterase // Chemico-Biological Interactions. 2013. V. 203. № 1. P. 51–56.
Lushchekina S., Gubaydullina A., Polomskih V., et al. QM/MM of ChE-catalyzed reactions with special attention to OP inhibition // FEBS Journal. 2013. V. 280. № SI Suppl. 1. P. 164–174.
Reed M.C., Lieb A., Nijhout H.F. The biological significance of substrate inhibition: A mechanism with diverse functions // Bioessays. 2010. V. 32. P. 422–429.
Tai K., Bond S.D., MacMillan H.R., et al. Finite element simulations of acetylcholine diffusion in neuromuscular junctions // Biophysical Journal. 2003. V. 84. № 4. P. 2234–2241.
Aidoo A., Ward K. Spatio-temporal concentration of acetylcholine in vertebrate synaptic cleft // Mathematical and Computer Modelling. 2006. V. 44. P. 952–962.
Middendorf H.D., Di Cola D., Cavatorta F., et al. Water dynamics in charged and uncharged polysaccharide gels by quasi-elastic neutron scattering // Biophysical Chemistry. 1994. V. 47. P. 145–153.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


