Доклады Российской академии наук. Науки о жизни, 2020, T. 492, № 1, стр. 280-286
ТРАНС-ФАКТОР HY5 УЧАСТВУЕТ В ЦИТОКИНИН-ЗАВИСИМОЙ РЕГУЛЯЦИИ ЭКСПРЕССИИ ГЕНОВ БЕЛКОВ, АССОЦИИРОВАННЫХ С ПЛАСТИДНОЙ РНК-ПОЛИМЕРАЗОЙ БАКТЕРИАЛЬНОГО ТИПА ПРИ ДЕЭТИОЛЯЦИИ ARABIDOPSIS THALIANA
А. С. Дорошенко 1, М. Н. Данилова 1, А. А. Андреева 1, 2, Н. В. Кудрякова 1, *, член-корреспондент РАН Вл. В. Кузнецов 1, В. В. Кузнецов 1
1 Институт физиологии растений
им. К.А. Тимирязева Российсской академии наук
Москва, Россия
2 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
* E-mail: nvkudryakova@mail.ru
Поступила в редакцию 06.02.2020
После доработки 06.02.2020
Принята к публикации 06.02.2020
Аннотация
HY5 (ELONGATED HYPOCOTYL5), bZIP транс-фактор, принадлежит к числу основных регуляторов светового и гормонального сигналинга. Среди мишеней этого гена особое место занимают гены транскрипционного комплекса хлоропластов, координированная экспрессия которых обеспечивает начальные этапы фотоморфогенеза. В представленной работе мы показали, что при деэтиоляции HY5 функционирует как положительный цитокинин (ЦК)-зависимый регулятор экспрессии генов белков, ассоциированных с пластидной РНК полимеразой (РАР), действующий ниже первичной цепи восприятия цитокининового сигнала. При этом отсутствие блокирующего действия мутаций по генам фоторецепторов CRY1, CRY2, PHYA, PHYB на ЦК-зависимое содержание транскриптов генов PAP свидетельствует о параллельном действии света и гормона в их регуляции.
ВВЕДЕНИЕ
HY5 (ELONGATED HYPOCOTYL5) кодирует bZIP транс-фактор, который принадлежит к числу основных регуляторов фотоморфогенеза [1]. Белок является субстратом для Е3 убиквитинлигазы COP1 (CONSTITUTIVE PHOTOMORPHOGENIC1), способной образовывать комплекс с SUPRESSOR OF PHYTOCHROME A-105(SPA). Комплекс COP/SPA функционирует в качестве отрицательного регулятора фотоморфогенеза в темноте. При освещении фоторецепторы, связываясь с ним, защищают HY5, а также ряд других транс-факторов (HYH, HFR1 и LAF1) от деградации и запускают транскрипцию светорегулируемых генов [2]. Наряду с участием в световом сигналинге, HY5 является компонентом реализации сигнала цитокинина. Согласно модели Vandenbusshe и коллег [3], цитокинин, воспринимаемый рецепторными гистидинкиназами AHK, ингибирует COP1-зависимую деградацию HY5 за счет неизвестного механизма и способствует повышенной экспрессии светорегулируемых генов.
К числу таких светорегулируемых генов, критичных для биогенеза хлоропластов, принадлежат гены транскрипционного комплекса хлоропластов PEP-А. Этот комплекс образуется в процессе деэтиоляции, когда под действием света к транскрипционному комплексу PEP-В этиопластов, включающему субъединицы РНК-полимеразы бактериального типа (PEP) и один из σ-факторов, присоединяются дополнительные полипептиды, так называемые PEP ассоциированные белки (РЕР-ASSOCIATED PROTEINS, РАР). Хотя РАР и различаются по своей структуре и функциям, анализ in silico транскриптомных данных свидетельствует, что кодирующие их ядерные гены образуют регулон [4]. Инактивация любого из генов РАР приводит к нарушениям в сборке РЕР комплекса и/или его стабильности и нарушениям в транскрипции хлоропластных генов и как результат к бесхлорофильному фенотипу.
Координированная экспрессия РАР генов на ранних этапах биогенеза хлоропластов предполагает существование общего регулятора, потенциальным кандидатом на роль которого является HY5. Согласно данным Liebers и коллег [5] при переходе от ското- к фотоморфогенезу накопление транскриптов HY5 соответствует профилю накопления транскриптов генов PAP. Таким образом, HY5 может являться одним из базовых регуляторов экспрессии РАР генов, если HY5 не следует клеточной регуляции, идентичной РАР. Участие HY5 в светоиндуцируемой экспрессии генов РАР можно продемонстрировать, используя в качестве модели гормон-зависимую активацию их экспрессии при деэтиоляции. В наших предыдущих исследованиях [6] было обнаружено, что компоненты цепи трансдукции сигнала ЦК способны регулировать накопление матриц генов аппарата транскрипции пластид при переходе от ското- к фотоморфогенезу, включая транскрипты гена РАР5. Белок HEMERA/pTAC12/РАР5 участвует в формировании РЕР комплекса в хлоропластах и одновременно осуществляет протеолиз фитохрома А [7] в составе фитохромных ядерных телец. В настоящей работе мы впервые показали, что цитокинин-зависимая регуляция РАР генов при деэтиоляции происходит при участии транс-фактора HY5.
МАТЕРИАЛЫ И МЕТОДЫ
В опытах использовали стандартную биологическую тест-систему, в основе которой лежит светоиндуцируемая деэтиоляция проростков, выращенных в темноте и перенесенных на свет. Мутанты Arabidopsis thaliana (hy5, cry1cry2 и phyAphyB) и проростки исходного родительского экотипа Landsberg erecta культивировали в течение 4-х дней в условиях полной темноты на питательной среде Мурасиге–Скуга без гормона (контроль) и в присутствии 1 мкМ транс-зеатина (опыт), а затем переносили в климатическую камеру MLR-352Н-PE (Sanyo, Япония) с интенсивностью освещения 120 мкE⋅м-2⋅с-1 и температурой 21°С. Экспрессию генов РАР исследовали на проростках, зафиксированных в 7 ч утра и через 6 ч после начала освещения (точное время фиксации связано со значительной регуляцией экспрессии РАР генов циркадными ритмами). Параллельно анализировали 7-дневные проростки, выращенные на свету при интенсивности освещения 120 мкE⋅м–2⋅с–1, температуре 21°С и фотопериоде 16 ч свет/8 ч темнота и обработанные раствором 5 мкМ транс-зеатина в течение 3 ч. Относительный уровень транскриптов оценивали методом полимеразной цепной реакции в режиме реального времени после обратной транскрипции на амплификаторе LigthCyclerR96 (Roche, Швейцария) согласно протоколу, описанному ранее [6]. Последовательности использованных праймеров приведены в наших недавних публикациях [6, 8]. Эксперименты проводили в 3–4-кратной биологической повторности. Достоверность различий проверяли при помощи критерия Стьюдента (t-критерий).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Укорочение гипокотилей проростков A. thaliana, культивируемых в условиях полной темноты на среде с добавлением ЦК, является одним из общепринятых тестов на чувствительность объекта к гормону [9]. В нашей предшествующей работе показано, что величины гипокотилей у 4-дневных проростков hy5 и проростков L. erecta, выращенных на питательной среде с добавлением 1 мкМ транс-зеатина, не имели существенных различий, то есть в условиях темноты по этому параметру оба образца имели одинаковую чувствительность к гормону. При этом экзогенный цитокинин стимулировал накопление хлорофилла при освещении в обоих образцах, а добавление гормона в среду культивирования резко увеличивало содержание транскриптов гена ARR5, индикатора действия цитокинина [6, 8].
Однако при сохранении способности к восприятию гормонального сигнала мутация по гену HY5 оказала значимое влияние на уровни базовой экспрессии компонентов цепи сигналинга ЦК. Согласно полученным нами результатам базовые уровни накопления матриц рецепторов ЦК AHK2, AHK3 и регуляторов ответа типа B ARR1 и ARR10 у мутанта были существенно выше, чем у растений дикого типа. ЦК способствовал активации генов AHK2 и AHK4 и росту матриц ARR1 и ARR10, но подавлял экспрессию гена ARR12 (рис. 1). Ранее о нарушении чувствительности к экзогенному ЦК в корнях и каллусе мутанта hy5 сообщали Cluis et al. [10], которые связывали с измененным балансом между генами сигналинга ЦК и ауксинов.
Рис. 1.
Влияние цитокинина и мутации по гену HY5 на содержание транскриптов генов, кодирующих белки передачи сигнала цитокинина и цитокинин-зависимые транс-факторы в 4-дневных этиолированных проростках A. thaliana дикого типа Landsberg erecta (Ler) и мутанта hy5. (1 – 0 мкМ транс-зеатина, 2 – 1 мкМ транс-зеатина).
● – достоверные различия между средними значениями экспрессии у дикого типа Landsberg erecta (Ler) без ЦК и с ЦК при p ≤ 0.05, ●● при p ≤ 0.01; # – достоверные различия между средними значениями экспрессии у мутанта hy5 без ЦК и с ЦК при p ≤ 0.05, ## при p ≤ 0.01; ♦ – достоверные различия между средними значениями экспрессии у мутанта hy5 без ЦК и экспрессии у дикого типа Landsberg erecta (Ler) без ЦК при p ≤ 0.05, ♦♦ при p ≤ 0.01.

HY5, в соответствии с данными Xie et al. [11] является одним из возможных целевых генов для регуляторов ответа на ЦК ARR1, ARR10, ARR12. Помимо ключевых компонентов цепи трансдукции ЦК, включающих сенсорные гистидинкиназы, фосфотрансмиттеры и регуляторы ответы типа В, реакция транскриптома на действие ЦК обеспечивается множественными дополнительными транс-факторами. Среди них особый интерес с точки зрения перекрестных взаимодействий с HY5 представляют факторы ответа на цитокинин – CRF (Cytokinin Response Factors), принадлежащих к классу транскрипционных факторов APETALA2/ETHYLENE FACTOR. Три из них CRF1, CRF5 и CRF6 напрямую связываются c HY5, который при этом активирует их экспрессию в 3–4 раза [12]. Кроме того, HY5 способен опосредовано регулировать более 1000 генов [13], действуя через субсети других регуляторов. Показано также, что экспрессия HY5 коррелировала с экспрессией ЦК-индуцируемого гена GNL (CYTOKININ-RESPONSIVE GATA1) [14]. Однако GNL, как и еще один ЦК-зависимый транс-фактор GNC (GATA NITRATE-INDUCIBLE CARBON-METABOLISM-INVOLVED), по-видимому, не являются облигатными участниками реализации сигнала ЦК при деэтиоляции, так как двойной мутант gncgnl, по данным Cortleven et al. [15] сохранял способность отвечать на действие ЦК.
В наших экспериментах у проростков мутанта hy5 и проростков дикого типа экспрессия гена CRF6 на среде с ЦК возрастала. Присутствие ЦК в среде не оказывало существенного влияния на уровень транскриптов генов GNC и GNL у растений экотипа L. erecta, тогда как у мутантной линии содержание матриц гена GNC достоверно увеличивалось, а уровень матриц GNL снижался (рис. 1).
Эти данные позволяют заключить, что в условиях темноты HY5 является положительным регулятором ЦК-индуцируемой экспрессии гена транс-фактора GNL/CGA1 и отрицательным GNC. При этом у мутанта hy5 сохранялась повышенная чувствительность к гормону.
Тем не менее, наиболее очевидным и выраженным последствием инактивации гена HY5 в наших опытах является почти полное отсутствие ЦК-зависимого роста экспрессии генов РАР при деэтиоляции. Если у растений дикого типа уровень матриц всех генов РАР достигал максимума через 6 ч после начала освещения и существенно превышал в этой временной точке значения “темновых” вариантов, то у мутанта, напротив, содержание транскриптов РАР генов в присутствии ЦК не отличалось от “темнового” варианта или было снижено. При этом свето-зависимая активация на среде без гормона сохранялась. Следует особо подчеркнуть, что все 12 PAP генов продемонстрировали высокую степень корегуляции в соответствии с предположением об их принадлежности к общему регулону [4]. На рис. 2 и 3 приведены данные для РАР генов, представляющих две основные функциональные группы. Первый из них, РАР6, относится к группе, связанной с редокс-регуляцией и защитой от окислительного стресса, тогда как РАР7 принимает участие в ДНК/РНК метаболизме. Интересно, что у мутантов по генам фоторецепторов cry1cry2 и phyAphyB характер ЦК-зависимой экспрессии генов РАР при деэтиоляции не отличался от показателей дикого типа, то есть фоторецепторы не были задействованы в модуляции ответа генов РАР на действие гормона (рис. 2). Тот факт, что экзогенный цитокинин сохранял способность стимулировать накопление на свету транскриптов гена HY5 у нокаут-мутантов cry1cry2 и phyAphyB свидетельствует в пользу отсутствия блокирующего действия мутаций по фоторецепторам на передачу сигнала ЦК, и, следовательно, о параллельном действии света и гормона в регуляции экспрессии HY5.
Рис. 2.
Влияние цитокинина и света на содержание транскриптов генов PAP6 (столбец “а”) и PAP7 (столбец “б”) в 4-дневных этиолированных проростках A. thaliana дикого типа Landsberg erecta (Ler) и нокаут-мутантов hy5, cry1cry2 и phyAphyB. (1 – 0 мкМ транс-зеатина, 2 – 1 мкМ транс-зеатина.) # – достоверные различия между средними значениями экспрессии у проростков, выращенных на питательной среде с ЦК, в условиях темноты и экспрессии у проростков, выращенных на питательной среде с ЦК, спустя 6 ч освещения при p ≤ 0.05, ## при p ≤ 0.01.
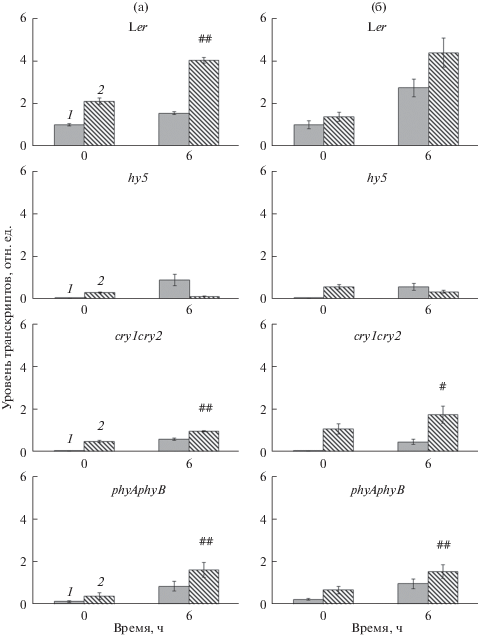
Рис. 3.
Влияние цитокинина и мутации по гену HY5 на содержание транскриптов генов, кодирующих белки, ассоциированные с РНК-полимеразой бактериального типа в 7-дневных растениях A. thaliana дикого типа Landsberg erecta (Ler) и мутанта hy5. (1 – 0 мкМ транс-зеатина, 2 – 5 × 10–6транс-зеатина). ●● – достоверные различия между средними значениями экспрессии у дикого типа Landsberg erecta (Ler) с ЦК и экспрессии у дикого типа Landsberg erecta (Ler) без ЦК при p ≤ 0.01; ♦♦ – достоверные различия между средними значениями экспрессии у мутанта hy5 и экспрессии у дикого типа Landsberg erecta (Ler) при p ≤ 0.01; ## – достоверные различия между средними значениями экспрессии у мутанта hy5 с ЦК и экспрессии у дикого типа Landsberg erecta (Ler) с ЦК при p ≤ 0.01.

Таким образом, полученные нами данные позволяют сделать вывод, что при деэтиоляции транс-фактор HY5 функционирует как положительный ЦК-зависимый регулятор экспрессии генов РАР, действующий ниже первичной цепи восприятия цитокининового сигнала. При этом механизм транскрипционной регуляции генов РАР может обеспечиваться взаимодействием HY5 с субсетью ЦК-регулируемых транс-факторов, включая CRF6, GNL и GNC.
Интересно, что у 7-дневных проростков, выращенных при стандартном освещении на среде без гормона, блокирующее влияние мутации hy5 на увеличение экспрессии генов РАР под действием ЦК отсутствовало. У мутанта, как и у растений дикого типа, наблюдалось достоверное увеличение экспрессии генов РАР уже через три часа после обработки транс-зеатином (рис. 3). При этом базовые уровни транскриптов PAP генов были снижены в 3–8 раз. Базовые уровни компонентов цепи сигналинга ЦК AHK2, AHK4, ARR1, ARR10 и ARR12 и целевых генов CRF6, GNL и GNC у мутантов, а также профили их экспрессии при обработке гормоном также существенно отличались от показателей дикого типа (рис. 4).
Рис. 4.
Влияние цитокинина и мутации по гену HY5 на содержание транскриптов генов, кодирующих белки передачи сигнала цитокинина и цитокинин-зависимые транс-факторы в 7-дневных растениях A. thaliana дикого типа Landsberg erecta (Ler) и мутанта hy5. (1 – 0 мкМ транс-зеатина, 2 – 5 × 10–6транс-зеатина).
● – достоверные различия между средними значениями экспрессии у дикого типа Landsberg erecta (Ler) с ЦК и экспрессии у дикого типа Landsberg erecta (Ler) без ЦК при p ≤ 0.05, ●● при p ≤ 0.01; ♦ – достоверные различия между средними значениями экспрессии у мутанта hy5 и экспрессии у дикого типа Landsberg erecta (Ler) при p ≤ 0.05, ♦♦ при p ≤ 0.01; # – достоверные различия между средними значениями экспрессии у мутанта hy5 с ЦК и экспрессии у дикого типа Landsberg erecta (Ler) с ЦК при p ≤ 0.05, ## при p ≤ 0.01.

Можно предположить, что в отсутствии белка HY5 у мутанта hy5 функцию этого транс-фактора в ЦК зависимой экспрессии РАР генов при фотоморфогенезе принимает на себя его гомолог HYH (HY5 HOMOLOG), который, как и HY5, способен связывать ACGT – содержащие цис-элементы промоторов целевых генов [13] и/или другие положительные регуляторы фотоморфогенеза (FHY3, FAR1, HFR1, LAF1). На начальных этапах деэтиоляции действие HYH у мутантных растений могло полностью ингибироваться убиквитин-лигазным комплексом COP1/SPA, усиливающим деградацию HYH и ряда других положительных регуляторов фотоморфогенеза. По мере деэтиоляции свет способен усиливать физиологическую активность транс-факторов, запускающих транскрипцию светорегулируемых генов за счет ингибирования их фосфорилирования и связывания комплекса COP1/SPA фоторецепторами. Справедливость этой модели предполагается проверить в дальнейшем с привлечением мутантов hyh и двойного мутанта hy5hyh.
Таким образом, результаты проведенных нами исследований позволяют впервые заключить, что транс-фактор HY5 определяет цитокинин-зависимую экспрессию генов PEP-ассоциированных белков при деэтиоляции, действуя ниже первичной цепи восприятия цитокининового сигнала.
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований гранты № 20-04-00294 и 19-34-90183.
Список литературы
Gangappa S.N., Botto J.F. // Molecular Plant 2016. V. 9. P. 1353–1365.
Lau O.S., Deng X.W. // Trends in Plant Sci. 2012. V. 17. P. 584–593.
Vandenbussche F., Habricot Y., Condiff A.S., Maldiney R., Van Der Straeten D., Ahmad M. // Plant J. 2007. V. 49. P. 428–441.
Pfannschmidt Th., Blanvillain R., Merendino L., Courtois F., Chevalier F., Liebers M., Grübler B., Hommel E., Lerbs-Mache S. // J. Exp. Bot. 2015. V. 66. P. 6957–6973.
Liebers M., Chevalier F., Blanvillain R., Pfannschmidt Th. // Planta 2018. V. 284. P. 629–636.
Danilova M.N., Doroshenko A.S., Kudryakova N.V., Andreeva A.A., Kusnetsov V.V. // Russian Journal of Plant Physiology 2018. V. 65. P. 801–812.
Chen M., Galvão R.M., Li M., Burger B., Bugea J., Bolado J., Chory J. // Cell. 2010. V. 141. P. 1230–1240.
Дорошенко А.С., Данилова М.Н., Медведева А.С., Кузнецов В.В. // Физиология растений 2019. Т. 66. С. 403–411.
Chory J., Reinecke D., Sim S., Washburn T., Brenner M. // Plant Physiol. 1994. V. 104. P. 339–347.
Cluis C.P., Mouchel C.F., Hardtke C.S. // Plant J. 2004. V. 38. P. 332–347. The Arabidopsis transcription factor HY5 integrates light and hormone signaling pathways.
Xie M., Chen H., Huang L., O’Neil R.C., Shokhirev M.N., Ecker J.R. // Nature Communications. 2018. V. 9. P. 1604. https://doi.org/10.1038/s41467-018-03921-6
Zhang H., He H., Wang X., Wang X., Yang X., Li L., Deng X.W. // Plant J. 2011. V.65. P. 346–358.
Ee J., He K., Stolc V., Lee H., Gao F.P., Zhao T.W., Lee I., Deng X.W. // Plant Cell V. 19. P. 731–749.
Monte E., Tepperman J.M., Al-Sady B., Kaczorowski K.A., Alonso J.M., Ecker J.R., Li X., Zhang Y.L., Quail P.H. // PNAS. 2004. V. 101. P. 16091–16098.
Cortleven A., Marg I., Yamburenko M.V., Schlicke H., Hill K., Grimm B., Schaller G.E., Schmulling T. // Plant Physiol. 2016. V. 172. P. 464–478.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


