Доклады Российской академии наук. Науки о жизни, 2020, T. 492, № 1, стр. 238-241
ФИЗИОЛОГО-БИОХИМИЧЕСКИЕ СТРАТЕГИИ АДАПТАЦИИ ГАЛОФИТОВ
О. А. Розенцвет 1, В. Н. Нестеров 1, *, Е. С. Богданова 1, член-корреспондент РАН Г. С. Розенберг 1
1 Институт экологии Волжского бассейна Российской академии наук – филиал Федерального государственного бюджетного учреждения науки Самарского федерального исследовательского центра Российской академии наук
Тольятти, Россия
* E-mail: nesvik1@mail.ru
Поступила в редакцию 07.02.2020
После доработки 11.02.2020
Принята к публикации 11.02.2020
Аннотация
Впервые показана взаимосвязь экологических стратегий адаптации отдельных групп галофитов и их метаболизма, определяющая их конкурентные возможности и занимаемое место в экосистеме. Установлены особенности содержания суммарных и мембранных липидов, хлорофиллов, каротиноидов, мембранных и водорастворимых белков, уровня перекисного окисления липидов, оводненности фотосинтетических органов и накопления натрия у эугалофитов, криногалофитов и гликогалофитов, приуроченных к различным уровням засоленности почвы.
В настоящее время под стратегией вида понимается совокупность приспособлений, обеспечивающих возможность обитать совместно с другими организмами и занимать определенное место в соответствующем биогеоценозе [1–3]. Виды, сходно реагирующие на действие какого-либо ведущего фактора среды, объединяют в экологические группы. Так, растения, приспособившиеся к жизни на засоленных почвах, называют галофитами. Они способны расти в аридных областях, на морских побережьях, по берегам соленых озер. В пустынях галофиты существуют в условиях засоленности почвы, постоянной почвенной и атмосферной сухости, перегрева, резких суточных колебаний температур, интенсивной инсоляции, сильных ветров [4]. Эти растения представляют собой важный источник масличных, кормовых, лекарственных, декоративных растений, энергоносителей и фитомелиорантов, а также генетического материала для создания устойчивых сортов культурных растений.
По солеустойчивости галофиты не только отличаются от гликофитов – растений, произрастающих на незасоленных почвах, но и различаются между собой [5]. Для истинных (облигатных) галофитов соль оказывает благотворное влияние. Об этом свидетельствуют более высокая биомасса проростков, повышенная эффективность фотосинтеза и урожайность, что приводит к увеличению производства семян для следующего поколения [6]. Гликофиты и факультативные галофиты чувствительны к соли, их рост и продуктивность снижаются на засоленной почве.
Различают галофиты, накапливающие NaCl в надземной части – эугалофиты, выделяющие соли на поверхность листьев – криногалофиты, ограничивающие или избегающие поступления соли – гликогалофиты и псевдогалофиты [7]. Экологическая дифференциация галофитов основана на разных стратегиях адаптации к засолению на уровне целого растения, органов, тканей и клетки. Например, защита от действия солей у гликогалофитов связана с низкой проницаемостью мембран в клетках корня. Соленакапливающие и солевыдедяющие виды способны защищать метаболически активные компартменты клетки путем удаления ионов Na+ и Cl– из цитозоля в апопласт, компартментацией в вакуоли с помощью мембранных ионных насосов, или выделением соли на поверхность листьев с помощью специальных выделительных систем. У эугалофитов осморегуляторную роль выполняют ионы Na+, а у крино- и гликогалофитов – низкомолекулярные осмолиты, такие как пролин, бетаин, сахара и др. [8].
В данной работе мы исследовали комплекс физиологических и биохимических параметров галофитов, реализующих разные стратегии регуляции солевого обмена, обеспечивающих их приспособление к условиям засоления. Для этого в листьях растений определяли содержание Na+, оводненность тканей (Н2О), количество мембранных (МБ) и водорастворимых белков (ВБ), суммарных липидов (СЛ), мембранных фосфо- (ФЛ) и гликолипидов (ГЛ), хлорофиллов a и b (Хл а, Хл b), каротиноидов (Кар), уровень процессов перекисного окисления липидов (ПОЛ) в соответствии с описаниями [9, 10]. Объектами исследования были 16 видов, которые принадлежат к трем семействам – Chenopodiaceae, Plumbaginaceae, Asteraceae и 8 родам – Artemisia, Climacoptera, Halocnemum, Halimione, Limonium, Petrosimonia, Salicornia, Suaeda. Эугалофитами являются Salicornia perennans, Halocnemum strobilaceum, Climacoptera crassa, Suaeda eltonica, Suaeda acuminata, Suaeda linifolia, Suaeda salsa, Petrosimonia oppositifolia, криногалофитами – Halimione verrucifera, Limonium gmelinii, Limonium caspium и гликогалофитами– Artemisia santonica, Artemisia marschalliana, Artemisia lercheana, Artemisia pauciflora, Artemisia draсunculus. Исследования проводили в течение 2012–2018 гг. на территориях, прилегающих к соленым озерам Большой Морец (Саратовская обл.), Булухта и Эльтон (Волгоградская обл.), Баскунчак (Астраханская обл.) [9–11]. Для биохимических анализов использовали 10–15 завершивших рост листьев среднего яруса одного и того же вида в пределах одного биотопа. Из усредненной биомассы отбирали навески 0.5–5 г в зависимости от вида анализа в трех биологических повторностях и хранили в жидком азоте. Одновременно отбирали образцы почвы для определения содержания в них водорастворимых солей.
Установлено, что разные группы галофитов отличались по оводненности фотосинтетических органов. Оводненность листьев эугалофитов в среднем составляла 81% от сырой массы (сыр. м.), криногалофитов – 67%, а гликогалофитов – 56% (F = 18.8, p = 0.001).
Содержание СЛ, выделяемых хлороформом и метанолом, в расчете на 1 г сухой массы (сух. м.), имело другую направленность. В листьях эугалофитов их количество составило в среднем 48 мг/г сух. м., у криногалофитов – 63 мг/г, у гликогалофитов – 94 мг/г (F = 12.4, p = 0.005). Клетки крино- и гликогалофитов практически не отличались по количеству мембранных ГЛ – 32 мг/г сух. м., но эугалофиты содержали ГЛ на треть меньше – 22 мг/г (F = 4.8, p = 0.01). Похожая закономерность была выявлена и в отношении ФЛ: крино- и гликогалофиты содержали в среднем 12–13 мг/г сух. м., а эугалофиты – 9 мг/г.
В отношении пигментов в фотосинтетических органах установлено, что глико- и криногалофиты содержали в среднем в 3 раза больше Хл a и b, чем эугалофиты. По содержанию Кар доминировали гликогалофиты – количество желтых пигментов было в 2 раза больше, чем у других галофитов.
Для солевыделяющих и ограничивающих поступление солей в надземную часть галофитов процессы ПОЛ играют более существенную роль, исходя из большего количества конечных продуктов окисления – малонового диальдегида (МДА). Содержание МДА в клетках листьев эугалофитов в среднем составляла 0.04 мкмоль/г сыр. м., у крино- и гликогалофитов – в 2–3 раза выше (F = 11.8, p = 0.003). Однако у этих же типов растений выявлена и большая активность антиокислительной защиты [12]. Количество ВБ и МБ у гликогалофитов практически втрое превышает данные показатели у эу- и криногалофитов.
Анализ элементного состава показал, что содержание Na+ в листьях эугалофитов в 3 и более раза выше, чем у крино- и гликогалофитов (140 и 40 мг/г воздушно-сух. м. соответственно) (F = 16.8, p = 0.01). То есть аккумулирующая способность растений по отношению к ионам Na+ соответствовала стратегии накопления солей.
Известно, что отдельные группы галофитов (эу-, крино-, гликогалофиты) хорошо приспособлены к окружающей природной среде и каждая из них занимает свое место в экосистеме [13]. Исследованные в данной работе виды различались по приуроченности к почвенному засолению: эугалофиты произрастали при уровне засоления 1.0–8.0% от воздушно-сух. м. почвы; криногалофиты – 0.6–3.3%; гликогалофиты – 0.5–2.0%. Очевидно, при изменении фактора засоленности субстрата от наибольшего к наименьшему, соответственно, меняется последовательность эугалофиты → криногалофиты → гликогалофиты или облигатные → факультативные галофиты.
Полученные данные обобщены в приведенном рис. 1.
Рис 1.
Количественные показатели физиолого-биохимических компонентов листьев различных групп галофитов по отношению к уровню засоления почвы. СЛ – суммарные липиды, ГЛ – гликолипиды, ФЛ – фосфолипиды, ПОЛ – перекисное окисление липидов, Хл а, b – хлорофиллы а, b, Кар – каротиноиды, МБ и ВБ – мембранные и водорастворимые белки, H2O – оводненность, Na+ – содержание натрия. ЭуГ – эугалофиты, КриноГ – криногалофиты, ГликоГ – гликогалофиты.
* уровень засоления, % от воздушно-сух. м. почвы.
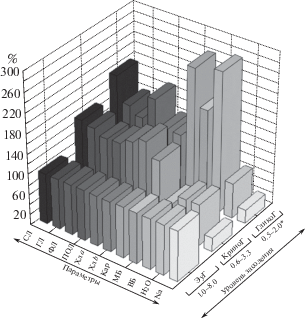
Для наглядности средние значения физиолого-биохимических характеристик видов, занимающих наиболее минерализованный пояс в природной среде – эугалофитов, были взяты за 100%. Для других групп растений все показатели приведены относительно соответствующих значений эугалофитов.
Суммируя полученные данные можно заключить, что отдельные группы галофитов, благодаря специфическим особенностям метаболизма, основанным на количественных различиях физиолого-биохимических параметров, реализуют разные экологические стратегии адаптации, что обеспечивает им конкурентные возможности и определяет их место в экосистеме.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Работа выполнена при поддержке грантов РФФИ № 12-0401110-а и № 14-04-1018914-к.
Список литературы
Работнов Т.А. // Бюлл. МОИП. Отд. биол. 1975. Т. 80. Вып. 2. С. 5–17.
Миркин Б.М., Наумова Л.Г. Введение в современную науку о растительности. М.: Геос, 2017. 280 с.
Ivanova L.A., Zolotareva N.V., Ronzhina D.A., Podgaevskaya E.N., Migalina S.V., Ivanov L.A. // Flora. 2018. V. 239. P. 11–19.
Березина Н.А. Экология растений. М.: Академия, 2009. 400 с.
Yang Y., Guo Y. // New Phytol. 2018. V. 217. P. 523–539.
Guo J., Li Y., Han G., Song G., Wang B. NaCl markedly improved the reproductive capacity of the euhalophyteSuaeda salsa // Funct. PlantBiol. 2018. V. 44. P. 350–361.
Генкель П.А. Физиология жаро- и засухоустойчивости растений. М.: Наука, 1982. 280 с.
Розенцвет О.А., Нестеров В.Н., Богданова Е.С. // Физиология растений. 2017. Т. 64. № 4. С. 251–265.
Rozentsvet O., Nesterov V., Bogdanova E., Kosobryukhov A., Zubova S., Semenova G. // Plant Physiol. Biochem. 2018. V. 129. P. 213–220.
Rozentsvet O.A., Nesterov V.N., Bogdanova E.S. // Phytochemistry. 2014. № 105. P. 37–42.
Нестеров В.Н., Розенцвет О.А.// Изв. Самар. НЦ РАН. 2017. Т. 19. № 5. С. 334–341.
Нестеров В.Н., Богданова Е.С., Табаленкова Г.Н., Розенцвет О.А. // Изв. Самар. НЦ РАН. 2014. Т. 16. № 5. С. 299–303.
Сухоруков А.П. Карпология семейства Chenopodiaceae в связи с проблемами филогении, систематики и диагностики его представителей. Тула: ГрифиК., 2014. 400 с.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


