Доклады Российской академии наук. Науки о жизни, 2020, T. 492, № 1, стр. 272-275
ВЛИЯНИЕ ХИРУРГИЧЕСКОЙ ТРАВМАТИЗАЦИИ В ПОЛОСТИ НОСА НА ПОВЕДЕНИЕ В ОТКРЫТОМ ПОЛЕ И ВЕГЕТАТИВНУЮ НЕРВНУЮ СИСТЕМУ КРЫС
И. В. Кастыро 1, *, Академик РАН И. В. Решетов 2, Г. В. Хамидулин 1, П. Е. Шмаевский 1, О. В. Карпухина 3, А. Н. Иноземцев 3, В. И. Торшин 1, Н. В. Ермакова 1, В. И. Попадюк 1
1 ФГАОУ ВО Российский Университет дружбы народов
Москва, Россия
2 ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова
Москва, Россия
3 ФГБОУ ВО Московский университет
им. М.В. Ломоносова
Москва, Россия
* E-mail: ikastyro@gmail.com
Поступила в редакцию 20.02.2020
После доработки 26.02.2020
Принята к публикации 03.03.2020
Аннотация
В статье исследовано влияние хирургического повреждения слизистой оболочки полости носа у крыс под действием общей анестезии. Изучались двигательная активность крыс и вариабельность сердечного ритма (ВРС) до и на вторые сутки после операции. После хирургического воздействия снижалась двигательная активность, увеличивалось время замирания и груминга, уменьшилось значение HF и росло VLF. Хирургическая травматизация перегородки носа у крыс на раннем пост-операционном этапе способствует мощному стрессовому ответу в виде резкого смещения баланса вегетативной нервной системы в сторону симпатического звена, вызывает снижение исследовательской активности, провоцирует тревожное, депрессивно-подобное состояние и беспокойство у крыс.
ВВЕДЕНИЕ
Хирургический стресс приводит к изменениям в работе вегетативной нервной системы (ВНС), которая через свои симпатическую (СНС) и парасимпатическую (ПНС) части обеспечивает контроль широкого спектра физиологических функций [12]. Так, нарушения в регуляции стресс-ответа приводят к формированию посттравматического дистресс-синдрома и тревожно-депрессивных состояний. Любое хирургическое вмешательство помимо болевого синдрома провоцирует эмоциональную реакцию, в частности, раздражение, тревожность, беспокойство и др. [13]. Такое хирургическое вмешательство в полости носа, как септопластика, сопровождается частичной постравматической обструкцией верхнего отдела дыхательных путей (полости носа), что может влиять на активацию СНС и ПНС, а также на различные реакции сердца, вызванные регуляторным действием ВНС [1].
До сих пор остается не вполне ясным, как влияет травматизация слизистой оболочки полости носа на состояние организма после хирургических вмешательств на перегородке носа, которые являются мощным стрессорным фактором, учитывая наличие диффузного вегетативного ганглия в ее задненижней части [6]. В частности, мало изучена взаимосвязь поведенческих реакций и вегетативной регуляции организма при хирургических вмешательствах на перегородке носа.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить роль хирургической травматизации в полости носа в возникновении депрессивно-подобных и тревожного состояний у крыс и изменении баланса ВНС.
МАТЕРИАЛЫ И МЕТОДЫ
Работа была проведена на 10 половозрелых беспородных крысах-самцах массой 185–250 г. За сутки до операции у животных в течение 3 мин тестировали поведение в “открытом поле” (ОП) с центральными и периферическими секторами (ЦС, ПС) и норками (ЦН, ПН). Для оценки состояния ВНС проводили спектральный анализ вариабельности сердечного ритма (ВСР) у крыс до операции и за 1 ч до тестирования в ОП. Влияние гуморального и надсегментарного уровней регуляции ВСР оценивали при помощи анализа очень низкочастотного (VLF), а состояние ПНС и СНС – с помощью высокочастотного компонента сердечного ритма (HF) и низкочастотного компонента сердечного ритма (LF), соответственно, как процентное отношение каждого частотного показателя от их суммы.
За 10 мин до операции в целях общей анестезии внутрибрюшинно вводили раствор Золетила в дозировке 15 мг/кг. Операция проводилась путем двусторонней зигзагообразной скарификации слизистой оболочки перегородки носа на всем протяжении перегородки носа остроконечным зондом. На вторые сутки после операции проводили повторный анализ поведения крыс в ОП и сердечного ритма, как это описано выше. Для оценки различий результатов до и после операции использовали критерий для связных выборок Вилкоксона.
Исследования на животных проводили согласно требованиям “Правил проведения работ с использованием экспериментальных животных” (1984 г.) и “Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях” (1986 г.).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
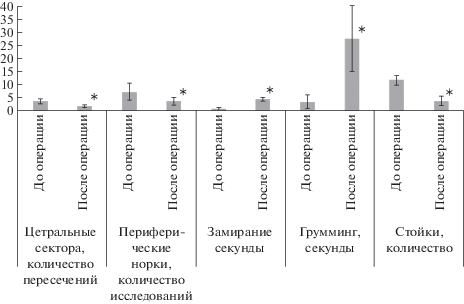
Хирургическое вмешательство резко уменьшило посещение крысами ЦС, обследование ПН и стоек относительно величин до операции. Одновременно у животных увеличилось количество актов замирания и груминга (рис. 1).
Рис. 1.
Изменения поведения крыс в открытом поле до и после септопластики у крыс. Примечание: * – достоверные различия между данными до и после операции (p < 0.05).
Показатели VLF, по сравнению с контролем (55.61 ± 3.88%), во второй день увеличились до 72.17 ± 5.03% (p < 0.01). Высокочастотный компонент частотного спектра, по сравнению с контролем (32.59 ± 3.05%), на второй день понизился (23.06 ± 5.01%) и был достоверно меньше в этот день, чем низкочастотный (47.24 ± 5.29) (p < 0.01) (рис. 2). Изменений показателей LF и ИЦ отмечено не было (рис. 2).
Рис. 2.
Изменения показателей ВРС у крыс после моделирования септопластики: сравнение гуморального влияния и надсегментарного уровня регуляции (VLF и ИЦ), состояния СНС (LF) и ПНС (HF). * – достоверное различие между данными до операции (данными контроля) и после нее (p < 0.01).

Подобный эффект можно объяснить, на наш взгляд, несколькими причинами. Во-первых, операция вызывает болевой синдром, который является стрессогенным фактором, влияющим на поведение [8]. Во-вторых, дополнительным стрессогенным воздействием служат осложнения после хирургического вмешательства (отек слизистой, воспаление, гипоксемия) [9], которые, по нашему мнению, вероятнее всего могли спровоцировать болевой синдром, вызывающий тревожное состояние [13]. В-третьих, известно, что экстренные изменения в среде, в том числе помещение крыс в освещенное открытое пространство, вызывают у животных состояние стресса, который резко изменяет поведение [5, 11]. Благодаря этому ОП используется для анализа поведения грызунов в условиях модели депрессивно-подобного состояния [2, 8].
Известно, что стрессор может вызывать противоположное влияние на поведение животных. Слабое однократное воздействие не вредящих раздражителей (свет, звук, вибрация) вызывают активацию поведения [4], а хроническое воздействие приводит к угнетению поведения в ОП и депрессивно-подобному состоянию [7, 10]. Учитывая сказанное, можно предположить, что наблюдаемое в наших опытах уменьшение исследовательской активности и увеличение груминга свидетельствует о том, что хирургическое вмешательство вызывает у крыс депрессивно-подобное состояние. Дополнительным подтверждением нашего предположения служит то, что бульбэктомия, также вызывающая нарушение обоняния, используется как модель депрессии [3, 7].
Рост VLF на второй день после операции говорит о гиперадаптивном состоянии, мобилизации энергетических и метаболических резервов, централизации регуляции адаптивных механизмов за счет увеличения влияния высших вегетативных центров и мобилизации гипоталамо-гипофизирно-надпочечниковой оси [1].
Падение HF по сравнению с LF, и повышение VLF, которые наблюдаются одновременно с поведенческими, также можно объяснить эффектом постхирургического воспаления. Известно, что изменения HF связаны с выбросом провоспалительных цитокинов через час после стрессового фактора [4] и что неадекватное анестезиологическое пособие вызывает повышенную активность именно ПНС [10]. В полости носа после септопластики, особенно на ранних сроках, воспаление сопровождается отеком слизистой оболочки, а это приводит к сужению носовых ходов и последующей гипоксемии, которая может увеличивать активность ПНС [8]. Однако при данном методе хирургического вмешательства в полости носа у крыс в исследуемые сроки произошло падение HF, вероятно, из-за развития классического стресс-ответа и развития депрессивно-подобного состояния [11] (p < 0.01) (рис. 2).
Совокупность приведенных данных подтверждает, что операция вызывает депрессивно-подобное состояние у крыс.
ЗАКЛЮЧЕНИЕ
Хирургическая травматизация перегородки носа у крыс на раннем постоперационном этапе способствует мощному стрессовому ответу в виде резкого снижения исследовательской активности, проявления тревожного, депрессивно-подобного состояния и беспокойства у животных. Эти изменения поведения сопровождаются смещением баланса ВНС в сторону симпатического компонента и увеличением мобилизации высших вегетативных центров, ростом влияния нейро-гуморального и метаболического уровней регуляции.
Список литературы
Баевский Р.М., Иванов Г.Г., Чирейкин Л.В., Гаврилушкин А.П., Довгалевский П.Я., Кукушкин Ю.А., Миронова Т.Ф., Прилуцкий Д.А., Семенов А.В., Федоров В.Ф., Флейшман А.Н., Медведев М.М. Анализ вариабельности сердечного ритма при использовании различных электрокардиографических систем (часть 1) // Вестник аритмологии. 2002. № 24. С. 65–87
Горлова А.В., Павлов Д.А., Ушакова В.М., Зубков Е.А., Морозова А.Ю., Зоркина Я.А., Иноземцев А.Н., Чехонин В.П. Хроническое ультразвуковое воздействие вызывает ангедонию, снижение исследовательской активности и изменение уровня тревожности крыс // Журнал высшей нервной деятельности им. И.П. Павлова. 2019. Т. 69. № 6. С. 752–760.
Ушакова В.М., Горлова А.В., Зубков Е.А., Морозова А.Ю., Зоркина Я.А., Павлов Д.А., Иноземцев А.Н., Чехонин В.П. Экспериментальные модели депрессивного состояния // Журнал высшей нервной деятельности им. И.П. Павлова. 2019. Т. 69. № 2. С. 230–247.
Goebel M.U., Mills P.J., Irwin M.R., Ziegler M.G. Interleukin-6 and tumor necrosis factor-alpha production after acute psychological stress, exercise, and infused isoproterenol: differential effects and pathways // Psychosom Med. 2000. V. 62. P. 591–598.
Inozemtsev A.N. Biological origins of protective mechanisms activated by the disruption of higher nervous activity // Moscow University Biological Sciences Bulletin. 2009. V. 64. Iss. 2. P. 57–62.
Kastyro I.V., Popadyuk V.I., Torshin V.I. Changes in heart rate during septoplasty with local anesthesia // European Journal of Preventive Cardiology. 2017. V. 24. Iss. 1 (suppl). P. S125.
Katz R.J., Roth K.A., Carroll B.J. Acute and chronic stress effects on open field activity in the rat: implications for a model of depression // Neurosci. Biobehav. Rev. 1981. V. 5. Iss. 2. P. 247–251.
Kim E.J., Pellman B., Kim J.J. Stress effects on the hippocampus: a critical review // Learn Mem. 2015. 22. Iss. 9. P. 411–416.
Molchan S.L., Hsu D.P. Successful Treatment of Persistent Hypoxemia by Nasal Suctioning in a Neonate with Primary Ciliary Dyskinesia // J. Clin. Neonatol. 2012. V. 1. Iss. 2. P. 98–100.
Popadyuk V.I., Kastyro I.V., Ermakova N.V., Torshin V.I. Septoplasty and tonsillectomy: acute stress response as a measure of effectiveness of local anesthetics // Vestn. Otorinolaringol. 2016. V. 81. Iss. 3. P. 7–11.
Sturman O., Germain P.L., Bohacek J. Exploratory rearing: a context- and stress-sensitive behavior recorded in the open-field test // Stress. 2018 V. 2. Iss. 5. P. 443–452.
Ulrich-Lai Y.M., Herman J.P. Neural regulation of endocrine and autonomic stress responses // Nat. Rev. Neurosci. 2009. V. 10. Iss. 6. P. 397–409.
Wetzel C.M., Kneebone R.L., Woloshynowych M., Nestel D., Moorthy K., Kidd J., Darzi A. The effects of stress on surgical performance // The American Journal of Surgery. 2006. V. 191. P. 5–10.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


