Доклады Российской академии наук. Науки о жизни, 2020, T. 492, № 1, стр. 255-259
ВЛИЯНИЕ АКРИЛАМИДА НА ЭНЕРГЕТИЧЕСКОЕ СОСТОЯНИЕ И ВЫЖИВАЕМОСТЬ БАКТЕРИЙ РАЗНЫХ СИСТЕМАТИЧЕСКИХ ГРУПП
Ю. Г. Максимова 1, 2, *, **, Е. М. Мочалова 2, член-корреспондент РАН В. А. Демаков 1, 2
1 Институт экологии и генетики микроорганизмов Уральского отделения Российской академии наук, Пермский федеральный исследовательский центр
Пермь, Россия
2 Пермский государственный национальный исследовательский университет
Пермь, Россия
* E-mail: maks@iegm.ru
** E-mail: yul_max@mail.ru
Поступила в редакцию 14.02.2020
После доработки 03.03.2020
Принята к публикации 03.03.2020
Аннотация
Изучали влияние акриламида на содержание внутриклеточного АТФ в клетках бактерий родов Rhodococcus и Alcaligenes свечение генноинженерного штамма Escherichia coli K12 TG1 (pXen7) и выживаемость бактерий различных систематических групп. По уровню снижения концентрации внутриклеточного АТФ установлено, что наиболее чувствительным к акриламиду при 20-минутной экспозиции являлся штамм с более низкой амидазной активностью (R. erythropolis) и грамотрицательные протеобактерии A. faecalis, тогда как устойчивым – штамм R. ruber, обладающий высокой нитрилгидратазной активностью в сочетании с низкой амидазной активностью. Для штамма E. coli K12 TG1 (pXen7) ЕС50 акриламида за 2 ч составляла 7.1 г/л. Акриламид в концентрации 10–20 мМ, добавленный в среду культивирования, приводил к незначительному снижению количества КОЕ родококков, A. faecalis и E. coli по сравнению с контролем. При концентрации акриламида 250 мМ сохранялось от 0.016 до 0.116% жизнеспособных бактериальных клеток, а раствор 500 мМ и выше подавлял рост большинства изученных штаммов. Полученные результаты подтверждают, что акриламид гораздо менее токсичен для прокариотов, чем для эукариотов.
Акриламид является высокотоксичным соединением для животных и человека и обладает по отношению к ним мутагенным, тератогенным и канцерогенным эффектом. В окружающую среду акриламид попадает в основном со стоками предприятий по синтезу акриловых полимеров, кроме того, имеются многочисленные данные об образовании акриламида в пище и напитках при высокотемпературном взаимодействии аспарагина с соединениями, имеющими α-гидроксикарбонильные группы (восстанавливающими сахарами), известном как реакция Майяра [1, 2].
Взаимодействие этого токсичного вещества c микроорганизмами привлекает внимание исследователей в связи с изучением его биодеградации в окружающей среде и воздействия на микрофлору кишечника. Известно, что микробная амидаза (КФ 3.5.1.4) может участвовать в деградации акриламида, и выделены бактерии, способные использовать акриламид как единственный источник углерода и энергии. Среди бактерий, утилизирующих акриламид, изолированы представители родов Alcaligenes, Arthrobacter, Bacillus, Enterobacter, Moraxella, Pseudomonas, Rhodococcus, Rhodopseudomonas, Stenotrophomonas и др. [3–8]. Есть сведения о том, что клеточная стенка лактобацилл может связывать акриламид, снижая тем самым его всасывание в пищеварительном тракте [9]. Однако остается не до конца выясненной степень токсичности этого вещества по отношению к прокариотам.
В связи с этим, целью нашей работы явилось изучение влияния акриламида на энергетическое состояние и выживаемость бактерий родов Rhodococcus, Alcaligenes и Escherichia coli.
Объектами исследования являлись штаммы Rhodococcus erythropolis 4-1, R. erythropolis 11-2, R. erythropolis 6-21, R. ruber gt1, Alcaligenes faecalis 2, обладающие ферментами гидролиза нитрилов, а также Escherichia coli K12 и E. coli K12 TG1 (pXen7).
Все эксперименты проводили не менее чем в 3-х кратной повторности. Статистическую обработку полученных данных осуществляли с использованием программы Microsoft Excel. Достоверность различий оценивали с помощью t-критерия Стьюдента, p < 0.05.
Нитрилгидратазную и амидазную активность клеток определяли при культивировании штаммов на жидкой минимальной солевой среде следующего состава (г/л): KH2PO4 – 1.0, K2HPO4 ⋅ ⋅ 3H2O – 3.75, NaCl – 0.5, MgSO4 ⋅ 7H2O – 0.5, CoCl2 ⋅ 6H2O – 0.01, FeSO4 ⋅ 7H2O – 0.005, pH 7.2 ± ± 0.2. Источником азота для штамма R. ruber gt1 служил хлористый аммоний в концентрации 10 мМ, для R. erythropolis 4-1, R. erythropolis 11-2, R. erythropolis 6-21 – ацетонитрил в концентрации 0.05%; источником углерода для всех перечисленных штаммов – 0.1% глюкоза. Для штамма A. faecalis 2 единственным источником углерода и азота был 0.1 М ацетамид. Нитрилгидратазную и амидазную активность клеток определяли в процессе реакции трансформации 0.6 М акрилонитрила и 0.1 М акриламида, соответственно, в 0.01 М калий-фосфатном буфере (рН 7.2 ± 0.2) при 22°С в течение 10–60 мин. Концентрацию акриламида, акриловой кислоты и акрилонитрила определяли методом ВЭЖХ (LC-10, “Shimadzu”, Япония) на колонке (250 × 4.6 мм) Synergi 4u Hydro–RP 80A. В качестве подвижной фазы использовали 25 мМ NaH2PO4, со скоростью потока 0.75 мл/мин при 25°C. Удельную активность определяли как количество клеток, мг (г), трансформирующих 1 мкмоль (1 ммоль) субстрата в продукт за 1 мин (1 ч) и выражали в мкмоль/мг/мин (ммоль/г/ч).
Штаммы R. erythropolis 4-1, R. erythropolis 11-2, R. erythropolis 6-21 и A. faecalis 2 проявляли выраженную амидазную активность, а наиболее активной нитрилгидратазой обладал штамм R. ruber gt1 (150–200 мкмоль/мг/мин), тогда как амидаза этого штамма была неактивна. Амидазная активность R. erythropolis 6-21, R. erythropolis 4-1 и A. faecalis 2 составляла 4, 9, и 14 ммоль/г/ч, соответственно, а увеличение концентрации акриламида до 500 мМ не приводило к ингибированию активности фермента.
Энергетический статус оценивали по содержанию АТФ в клетках бактериальных штаммов R. erythropolis 4-1, R. erythropolis 11-2, R. erythropolis 6-21, R. ruber gt1 и A. faecalis 2 после воздействия растворов акриламида в концентрациях 20, 50, 100 и 1000 мМ в течение 20 мин. Клетки бактерий культивировали на минимальной солевой среде вышеприведенного состава до стационарной фазы роста, центрифугировали 20 мин при 10500 g, отмывали однократно 0.01 М калий-фосфатным буфером, рН 7.2 ± 0.2, центрифугировали повторно и ресуспендировали в свежем 0.01 М калий-фосфатном буфере до концентрации клеток 0.3–0.4 мг/мл, раститровывали по 100 мкл в лунки круглодонного полимерного планшета (Медполимер, Россия) и вносили раствор акриламида до указанных концентраций. Контролем служили клетки без воздействия акриламида.
После 20-минутной экспозиции культуральный планшет центрифугировали 10 мин при 2464 g, удаляли надосадочную жидкость и разрушали клетки 90%-ным диметилсульфоксидом в течение 15 мин на льду, замораживали образец и хранили при –18°С. Для определения концентрации АТФ использовали стандартный набор реактивов ATP Bioluminescent Assay Kit (Sigma, США), образцы разводили в 10 раз и измеряли интенсивность свечения на планшетном ридере Infinite M1000 pro (Tecan, Швейцария). Концентрацию АТФ определяли по калибровочному графику.
Нами не было установлено достоверного отличия от контроля содержания АТФ в клетках R. ruber gt1 и R. erythropolis 4-1 после воздействия акриламида (рис. 1а, б), тогда как у R. erythropolis 6-21 и A. faecalis 2 (рис. 1в, г) снижение концентрации внутриклеточного АТФ было достоверным (p < 0.05). При этом не была обнаружена зависимость изменения содержания АТФ от концентрации акриламида.
Рис. 1.
Влияние акриламида на содержание АТФ в клетках R. ruber gt1 (а), R. erythropolis 4-1 (б), R. erythropolis 6-21 (в), A. faecalis 2 (г)

Различное воздействие акриламида на энергетический статус изученных бактерий можно объяснить совокупностью свойств этих микроорганизмов, среди которых уровень активности нитрилгидролизующих ферментов и строение клеточной стенки. Так, наиболее активной нитрилгидратазой обладал штамм R. ruber gt1, при этом амидаза этого штамма была неактивна, в связи с чем штамм был устойчив к накоплению акриламида в среде как продукта трансформации акрилонитрила. Уровень амидазной активности R. erythropolis 4-1 и A. faecalis 2 был сопоставим, но виды отличались по грам-принадлежности. Грамположительные родококки более устойчивы к негативным воздействиям окружающей среды и обладают высоким биодеградативным потенциалом по отношению к широкому ряду токсичных соединений [10]. Однако активность амидазы R. erythropolis 6-21 была невысока, а нитрилгидратазная активность близка к нулю, в связи с чем штамм был чувствителен даже к низким концентрациям акриламида.
Влияние акриламида на свечение генноинженерного штамма E. coli K12 TG1 (pXen7) изучали при добавлении акриламида до конечной концентрации 10–1500 мМ к суспензии клеток. Люминесценцию регистрировали на универсальном микропланшетном ридере Infinite M1000 pro (Tecan, Швейцария) сразу после добавления акриламида и через 10, 20, 30, 40, 50 и 120 мин экспозиции.
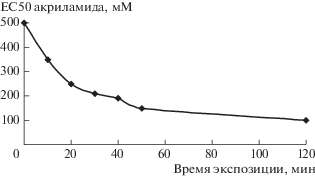
Известно, что свечение люминесцентных бактерий зависит от физиологического состояния клетки, а именно, от уровня НАДФН. Токсичные вещества, ингибируя электронтранспортную цепь, приводят к подавлению свечения этих микроорганизмов. Следовательно, токсичность образцов, содержащих ксенобиотики, тяжелые металлы и другие экотоксиканты, может быть оценена по степени тушения люминесценции [11]. В наших экспериментах гашение на 50% (ЕС50) свечения штамма E. coli K12 TG1 (pXen7) наблюдалось при концентрациях 500, 350, 250, 210, 190, 150 и 100 мМ акриламида за 0, 10, 20, 30, 40, 50 и 120 мин соответственно (рис. 2). ЕС50 акриламида для этого штамма за 2 ч составляла 7108 мг/л, в то время как по отношению к дафниям и другим водным беспозвоночным ЕС50 акриламида составляет 98 мг/л при воздействии в течение 48 ч (паспорт безопасности акриламида, www.merckmillipore.com). Таким образом, токсический эффект акриламида проявляется, главным образом, по отношению к эукариотам, а не к прокариотам. Различие в его воздействии на бактериальные клетки и эукариотов может объясняться разными мишенями повреждающего действия этого токсического вещества. Так, у эукариотов этой мишенью в первую очередь является ДНК, что связано с трансформацией акриламида в более мутагенный глицидамид [12]. Есть сведения, что у животных и акриламид, и его метаболит глицидамид могут конъюгировать с глутатионом, благодаря активности глутатион-S-трансфераз, а затем трансформироваться в конъюгаты меркаптуровых кислот и выделяться с мочой. Конъюгация с глутатионом может приводить к снижению его доступности в клетке, что в свою очередь приводит к аккумуляции избыточного количества активных форм кислорода и окислительному стрессу [2]. Механизмы воздействия акриламида на прокариотов не исследованы.
Рис. 2.
Гашение свечения E. coli K12 TG1 (pXen7) на 50% (EC50) в зависимости от времени экспозиции с акриламидом.
Способность к росту бактерий родов Rhodococcus, Alcaligenes и Escherichia на полноценной питательной среде LB (Диаэм, Россия) при добавлении акриламида до конечных концентраций 10, 20, 50, 100, 250, 500 и 1000 мМ оценивали высевом на агаризованную питательную среду LB из серийных разведений и подсчетом количества колониеобразующих единиц. Cреду LB (5 мл) с акриламидом инокулировали 100 мкл суспензии соответствующего штамма, содержащей 108 клеток в мл и культивировали при 30°С в течение 7 суток. Контролем служила среда LB без акриламида.
У большинства изученных штаммов нами было выявлено отсутствие роста с акриламидом в концентрации от 500 мМ и выше, за исключением R. erythropolis 11-2, количество КОЕ/мл которого при этой концентрации акриламида составляло (1.0 ± 0.2) ⋅ 104. Акриламид в концентрации 10–20 мМ приводил к незначительному снижению количества КОЕ по сравнению с контролем, а при концентрации 250 мМ сохранялось от 0.016 до 0.116% жизнеспособных бактериальных клеток (табл. 1).
Таблица 1.
Рост бактерий родов Rhodococcus, Alcaligenes и Escherichia (КОЕ/мл) в течение 7 суток на полноценной питательной среде LB, содержащей акриламид
| мМ | Штаммы | |||||
|---|---|---|---|---|---|---|
| R. ruber gt1 | R. erythro- polis 6-21 | R. erythro- polis 11-2 | A. faecalis 2 | E. coli K12 | E. coli K12 TG1 (pXen7) | |
| 0 | (6.0 ± 1.2) ⋅ 107 | (1.4 ± 0.2) ⋅ 108 | (2.1 ± 0.2) ⋅ 108 | (1.4 ± 0.25) ⋅ 109 | (6.0 ± 0.4) ⋅ 108 | (7.0 ± 0.6) ⋅ 108 |
| 10 | (1.5 ± 0.2) ⋅ 107 | (1.05 ± 0.30) ⋅ 108 | (2.0 ± 0.4) ⋅ 108 | (0.8 ± 0.1) ⋅ 109 | (5.0 ± 0.2) ⋅ 108 | (4.45 ± 0.2) ⋅ 108 |
| 20 | (0.9 ± 0.1) ⋅ 107 | (1.75 ± 0.13) ⋅ 108 | (1.75 ± 0.4) ⋅ 108 | (0.8 ± 0.05) ⋅ 109 | (4.75 ± 0.5) ⋅ 108 | (2.7 ± 0.2) ⋅ 108 |
| 50 | (1.3 ± 0.4) ⋅ 107 | (3.0 ± 0.6) ⋅ 107 | (1.45 ± 0.22) ⋅ 107 | (1.1 ± 0.2) ⋅ 109 | (7.0 ± 1.0) ⋅ 107 | (1.8 ± 0.3) ⋅ 108 |
| 100 | (1.15 ± 0.40) ⋅ 106 | (1.25 ± 0.22) ⋅ 106 | (5.0 ± 1.3) ⋅ 105 | (0.5 ± 0.2) ⋅ 108 | (3.2 ± 0.4) ⋅ 106 | (3.85 ± 0.15) ⋅ 106 |
| 250 | (1.3 ± 0.2) ⋅ 104 | (2.25 ± 0.20) ⋅ 104 | (1.4 ± 0.2) ⋅ 105 | (0.4 ± 0.03) ⋅ 106 | 0 | (8.1 ± 0.1) ⋅ 105 |
| 500 | 0 | 0 | (1.0 ± 0.2) ⋅ 104 | 0 | 0 | 0 |
| 1000 | 0 | 0 | 0 | 0 | 0 | 0 |
Таким образом, рост изученных штаммов подавляют только очень высокие концентрации акриламида, что согласуется с результатами изучения воздействия этого вещества на энергетическое состояние бактериальных клеток. Полученные нами данные подтверждают, что оценка токсичности вещества, в данном случае акриламида, по отношению к эукариотам не всегда может быть сделана на основании токсичности по отношению к прокариотам.
БЛАГОДАРНОСТИ
Авторы благодарят с.н.с. ИЭГМ УрО РАН, к.б.н. Масленникову И.Л. за предоставленный для работы штамм E. coli K12 TG1 (pXen7).
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
Работа выполнена в рамках государственного задания по теме “Молекулярные механизмы адаптации микроорганизмов к факторам среды”, регистрационный номер НИОКТР АААА-А19-119112290009-1.
Список литературы
Kusnin N., Syed M.A., Ahmad S.A. // JOBIMB. 2015. V. 3. № 2. P. 6–12.
Duda-Chodak A.,Wajda Ł., Tarko T., Sroka P., Sato-ra P. // FoodFunct. 2016. V. 7. № 3. P. 1282–1295.
Максимова Ю.Г., Васильев Д.М., Зорина А.С., Овечкина Г.В., Максимов А.Ю. // Прикл. биохимия и микробиология. 2018. Т. 54. № 2. С. 158–164.
Buranasilp K., Charoenpanich J. // J. Environ. Sci. 2011. V. 23. № 3. P. 396–403.
Jebasingh S.E.J., Lakshmikandan M., Rajesh R.P., Raja P. // Int. Biodeterior. Biodegrad. 2013. V. 85. P. 120–125.
Lakshmikandan M., Sivaraman K., Raja S.E., Vasanthakumar P., Rajesh R.P., Sowparthani K., Jeba-singh S.E.J. // Int. Biodeterior. Biodegrad. 2014. V. 94. P. 214–221.
Shen S.-M., Wan T.-J., Hwang H.-Y. // Biocatal. Agric. Biotechnol. 2012. V. 1. № 2. P. 110–114.
Wampler D.A., Ensign S.A. // Appl. Environ. Microbiol. 2005. V. 71. № 10. P. 5850–5857.
Rivas-Jimenez L., Ramírez-Ortiz K., González-Córdova A.F., Vallejo-Cordoba B., Garcia H.S., Hernandez-Mendo-za A. // Microbiol. Res. 2016. V. 190. P. 19–26.
Соляникова И.П., Головлёва Л.А. // Прикл. биохимия и микробиология. 2015. Т. 51. № 2. С. 132–139.
Куц В.В., Аленина К.А., Сенько О.В., Ефременко Е.Н., Исмаилов А.Д. // Вода: химия и экология. 2011. № 10. С. 47–53.
Gökmen V. Acrylamide in food: analysis, content and potential health effects. AcademicPress, 2015. 532 p.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


