Доклады Российской академии наук. Науки о жизни, 2020, T. 492, № 1, стр. 300-304
МОРФОЛОГИЧЕСКИЕ И МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ВОСПАЛИТЕЛЬНЫХ И РЕГЕНЕРАТОРНЫХ ПРОЦЕССОВ В ТКАНЯХ ПАРОДОНТА ПРИ ПЕРИИМПЛАНТИТЕ И ПАРОДОНТИТЕ
Академик РАН А. А. Кулаков 1, 2, Е. А. Коган 1, Т. В. Брайловская 1, 2, А. П. Ведяева 1, 2, *, Н. В. Жарков 1
1 ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава РФ
Москва, Россия
2 ФГБУ “ЦНИИС и ЧЛХ” Минздрава РФ
Москва, Россия
* E-mail: avedyaeva@yandex.ru
Поступила в редакцию 29.11.2019
После доработки 27.02.2020
Принята к публикации 12.03.2020
Аннотация
Проведено морфологическое и иммуногистохимическое исследование тканей пародонта у пациентов с хроническим генерализованным пародонтитом, которым проводилась дентальная имплантация. Исследованы 44 биоптата от 21 пациента (13 женщин и 8 мужчин) в возрасте 35–60 лет с диагнозом: периимплантационный мукозит (7 пациентов), периимплантит (8 пациентов), хронический генерализованный пародонтит тяжелой степени (6 пациентов). Установлено, что периимплантит отличается от периимплантационного мукозита более выраженной воспалительной реакцией с явным преобладанием плазматических клеток в инфильтрате, который захватывает фиброзную капсулу вокруг имплантата, разрушает ее и далее распространяется на костную ткань. На основании иммуногистохимических различий по SMA, VEGF, Ki-67 делается вывод, что периимплантационный мукозит и периимплантит являются последовательными стадиями прогрессирования одного и того же процесса. При сравнении хронического генерализованного пародонтита тяжелой степени и периимплантита, последний демонстрирует намного более выраженные воспалительно-деструктивные процессы в области имплантата, обусловленные присоединением иммунного воспаления, нарушением процессов регенерации и разрушением костной ткани.
ВВЕДЕНИЕ
В настоящее время успех дентальной имплантации у пациентов с частичной и полной потерей зубов в результате хронического генерализованного пародонтита (ХГП) в значительной степени ограничен не только сложной клинической и рентгенологической картиной, но и необратимыми морфологическими изменениями, связанными с хроническим воспалением [6, 9, 10, 14]. Проблема состояния тканей, окружающих зону имплантации, у пациентов с заболеваниями пародонта исследована недостаточно и представляет научный и клинический интерес. В научной литературе сравнение характера воспаления при пародонтите и периимплантите освещено достаточно мало [1, 3–5], поэтому является актуальным направлением для дальнейшей разработки клинически эффективного и научно обоснованного протокола лечения у данной категории пациентов [11–13].
Целью работы явилось исследование морфологических и молекулярно-биологических особенностей воспалительных и регенераторных процессов у пациентов при развитии периимплантационного мукозита (ПМ) и периимплантита в сравнении с пациентами с ХГП тяжелой степени с учетом экспрессии VEGF (фактора роста эндотелия), SMA (маркеров миофибробластической дифференцировки клеток) и Ki-67 (маркера пролиферативной активности).
МАТЕРИАЛЫ И МЕТОДЫ
Исследованы 44 биоптата от 21 пациента (13 женщин и 8 мужчин), средний возраст пациентов составил 41.7 ± 7.1 лет. Пациентам проведено хирургическое лечение в отделении клинической и экспериментальной имплантологии ФГБУ “ЦНИИС и ЧЛХ” Минздрава РФ в 2018 г. В ходе исследования пациенты были разделены на группы согласно новой классификации заболеваний пародонта (EFP 2018) [7]. 1-я группа (n = 7) – пациенты с диагнозом периимплантационный мукозит (ПМ), глубина зондирования 2.5 ± ± 0.7 мм, без убыли костной ткани. 2-я группа (n = 8) – пациенты с диагнозом периимплантит глубина зондирования 6.4 ± 1.2 мм, убылью костной ткани более 1/3 мм длины имплантата. 3-я группа (n = 6) пациенты c хроническим генерализованным пародонтитом (ХГП) тяжелой степени, глубина зондирования 6.6 ± 1.3 мм, двух-, трехстеночные костные дефекты. Критерии включения: возраст от 35 до 60 лет; установленный диагноз; отсутствие острого гнойного воспалительного процесса в области оперативного вмешательства; удовлетворительное гигиеническое состояние полости рта, письменное согласие пациента на участие в исследовании. Критерии исключения: возраст пациентов менее 35 и более 60 лет; выраженная сопутствующая патология; острый гнойный воспалительный процесс в области оперативного вмешательства; неудовлетворительное гигиеническое состояние полости рта; отказ пациента от участия в исследовании. Пациентам 1-й группы с их информированного согласия проводили инцизионную биопсию мягких тканей десны. Пациентам 2-й группы биопсию проводили на этапе хирургического вмешательства в области дентальных имплантатов, у пациентов 3-й группы биопсию проводили на этапе хирургической санации и установки дентальных имплантатов, размер биоптатов в среднем – 3 × × 3 мм. Биопсийный материал для исследования фиксировался в 10% нейтральном забуференном формалине и помещался в парафин. Серийные парафиновые срезы толщиной 4 мкм окрашивали гематоксилин-эозином, пикрофуксином по Ван Гизону для морфологической оценки, другие обрабатывали для иммуногистохимического исследования. Морфологически оценивали степень выраженности воспалительной реакции, дистрофические изменения эпителия, некроз тканей, акантоз покровного эпителия, склеротические изменения и ангиогенез, по методике описанной нами ранее и по аналогии со степенью определения гистологической активности хронического гепатита по Knodell [8]. На серийных парафиновых срезах проводили иммуногистохимические реакции с антителами к Ki-67 (в разведении 1:100, Dako), VEGF (в разведении 1:100, Abcam), SMA (LabVision, в концентрации 1:100), с последующим докрашиванием ядер клеток гематоксилином Майера. Демаскировка антигенов проводилась в ретривере с цитратным буфером с pH 6.0 при t 98°C в течение 20 мин с последующим остыванием до 60°C. Результаты реакций SMA, VEGF оценивались полуколичественным методом по шкале от 1 до 6 баллов [2]. Оценка экспрессии Ki-67 проводилась с расчетом индекса пролиферации (ИП) по проценту пролиферирующих клеток одного типа из расчета на 300 клеток. Статистическая обработка полученных данных проведена с помощью программного пакета для статистических исследований IBM SPSS Statistic 25 (IBM Corp., USA).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Морфологическая характеристика. Периимплантационный мукозит (1-я группа)
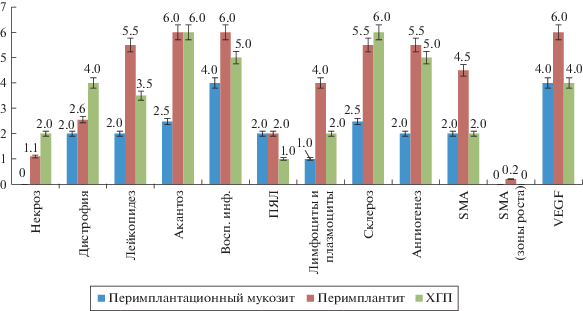
Биопсийный материал содержал фиброзную ткань (внутренний слой) с подслизистой оболочкой и покровным эпителием десны. В слизистой обнаруживались небольшие участки некроза эпителия, в сочетании с дистрофией клеток, умеренно выраженным акантозом и явлениями лейкопедеза. Формирование изъязвленного эпителия следует за апикальной пролиферацией остальной части эпителия и дегенерацией субэпителиальной соединительной ткани. В подслизистой оболочке обнаруживалась воспалительная лимфогистиоцитарная инфильтрация с примесью небольшого количества полиморфноядерных нейтрофильных гранулоцитов, макрофагов, Т-лимфоцитов и отдельных плазматических клеток, а также очаговые разрастания грануляционной ткани со слабо и умеренно выраженными склеротическими изменениями. Фиброзная ткань представлена зрелой соединительной тканью с фибробластическими элементами, коллагеновыми волокнами и слабо выраженной лимфогистиоцитарной инфильтрацией (рис. 1).
Периимплантит (2-я группа)
Биопсийный материал содержал фиброзную капсулу вокруг имплантата, относительно сохранную ткань десны и фрагменты костной ткани. В слизистой обнаруживались участки изъязвленного эпителия, в сочетании с дистрофией клеток, выраженным акантозом и явлениями лейкопедеза. Прогрессирующее уплотнение лейкоцитарного инфильтрата, проходящего латерально и апикально, обнаруживалось на стыке базальных отделов эпителия и супрабазальных слоев соединительной ткани. При этом в подслизистой оболочке также обнаруживалась воспалительная лимфогистиоцитарная инфильтрация с большим количеством нейтрофилов и примесью плазматических клеток, а также очаговые разрастания грануляционной ткани с выраженными в разной степени склеротическими изменениями на территории мягких тканей и связочного аппарата. Фиброзная ткань внутреннего слоя капсулы инфильтрирована лимфоплазмоклеточными элементами, которые распространялись в горизонтальном и вертикальном направлениях и разрушали коллагеновые волокна, прилежащие к имплантату. Остатки фиброзной капсулы внутреннего слоя плавно переходили в разрастания грануляционной ткани с воспалительной лимфогистиоцитарной инфильтрацией с примесью плазматических клеток и большого количества лейкоцитов. В костной ткани определяется активация остеокластов, которые высвобождают протеолитические ферменты, растворяющие коллагеновый матрикс кости. В последствие образуются, так называемые, лакуны с участками лизиса костных балок, которые фагоцитируются макрофагами и замещаются грануляционной тканью (рис. 1).
Хронический генерализованный пародонтит (ХГП) тяжелой степени (3-я группа)
Характеризовался разрастанием грануляционной ткани с выраженной воспалительной лимфогистиоцитарной инфильтрацией, с большим количеством нейтрофилов и с примесью плазматических клеток, а также очаговыми склеротическими изменениями (р < 0.05). При этом в слизистой обнаруживались крупные участки некроза эпителия, в сочетании с дистрофией клеток, выраженным диспаракератозом, акантозом и явлениями лейкопедеза (рис. 1).
Иммуногистохимическая характеристика. Периимплантационный мукозит (1-я группа)
Представлен зрелой фиброзной тканью без признаков пролиферативной активности и единичными SMA-позитивными клетками. Сохранная ткань прилежащей десны характеризовалась повышенной пролиферативной активностью как сохранных клеток эпителия (5.1% ± 0.3%), так и клеточных элементов грануляционной ткани, прежде всего эндотелия сосудов и фибробластических элементов (6.1% ± 0.3%) (p < 0.05). При этом пролиферирующие и SMA+клетки располагались разрозненно и не формировали “зон роста”. VEGF обнаруживался в клетках эндотелия новообразованных сосудов в умеренном количестве (рис. 1, табл. 1).
Таблица 1.
Иммуногистохимическая характеристика SMA, VEGF, Ki-67 при периимплантационном мукозите, периимплантите и ХГП тяжелой степени
| Группа | SMA | SMA (зоны роста) | VEGF | Ki-67 (эпит.), % | Ki-67 (соед. тк.), % | |
|---|---|---|---|---|---|---|
| Периим. мукозит | слизистая | 2.0 ± 0.1 | 0.0 ± 0.0 | 4.0 ± 0.01 | 5.1 ± 0.3 | 6.1 ± 0.3 |
| Периимплантит | слизистая | 3.0 ± 0.1 | 1.5 ± 0.1 | 5.5 ± 0.3 | 9.8 ± 0.5 | 7.6 ± 0.4 |
| капсула | 4.5 ± 0.3 | 0.2 ± 0.01 | 6.0 ± 0.3 | 22.2 ± 1.1 | 32.6 ± 1.6 | |
| ХГП тяжелой степени | слизистая | 2.0 ± 0.05 | 4.0 ± 0.01 | 4.0 ± 0.03 | 22.5 ± 1.12 | 7.5 ± 0.37 |
Периимплантит (2-я группа)
Капсула вокруг имплантата характеризовалась повышенной пролиферативной активностью как эпителиального компонента (22.2% ± 0.3%), так и клеточных элементов грануляционной ткани, прежде всего эндотелия сосудов и фибробластических элементов (32.6% ± 0.3%). При этом основные очаги пролиферации обнаруживались вокруг сосудов, где имелась гиперплазия SMA + + клеток. Пролиферативная активность клеток капсулы вокруг имплантата значительно превышала пролиферативную активность тех же клеточных элементов, что и при пародонтите. Отмечена особенность локализации SMA + клеток в зоне склероза, где они располагаются между компонентами экстрацеллюлярного матрикса. Сохранная ткань прилежащей десны также характеризовалась повышенной пролиферативной активностью как сохранных клеток эпителия (9.8% ± 0.5%), так и клеточных элементов грануляционной ткани, прежде всего эндотелия сосудов и фибробластических элементов (7.6% ± 0.4%), но в значительно меньшей степени, по сравнению с капсулой (p < 0.05). При этом пролиферирующие и SMA+клетки располагались разрозненно и не формировали “зон роста”. VEGF обнаруживался в клетках эндотелия новообразованных сосудов в значительном количестве (рис. 1, табл. 1).
ХГП тяжелой степени (3-я группа) сопровождался повышенной пролиферативной активностью сохранных клеток эпителия (22.5% ± 1.12%) и клеточных элементов грануляционной ткани, прежде всего эндотелия сосудов и фибробластических элементов (7.5% ± 0.37%) (р < 0.05). При этом пролиферирующие и SMA + клетки располагались разрозненно и не формировали “зон роста” (р < 0.05). VEGF позитивные клетки определялись в умеренном количестве в собственной пластинке слизистой, в основном в клетках сосудистой стенки (рис. 1, табл. 1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В ходе проведенного исследования выявлены морфологические особенности поражения тканей при периимплантационном мукозите, периимплантите и ХГП тяжелой степени. Хроническое воспаление при периимплантационном мукозите имеет умеренную активность, в среднем 4 балла и выражено в меньшей степени по сравнению с периимплантитом, где оно достигает 6 баллов. Судя по лимфоплазмолкеточной инфильтрации преобладают реакции нативного иммунитета. Проявления адаптивного иммунитета не столь выражены. Воспалительные изменения локализуются на уровне подслизистого и слизистого слоев и не сопровождаются повреждением фиброзной ткани в области шейки имплантата и разрушением костной ткани. По данным иммуногистохимического исследования у пациентов с периимплантационным мукозитом меньше выражен ангиогенез и экспрессия SMA, VEGF, Ki-67 в слизистой. Следует отметить, что периимплантит отличается более высокой активностью воспалительного процесса и прогрессивным течением по нелинейной и ускоряющейся схеме. Отличительной особенностью периимплантита является формирование фиброзной капсулы вокруг имплантата, приводящей к выраженной деструкции костной ткани. Прогрессирование воспаления, возможно, связано с присоединением иммунных механизмов, о чем свидетельствует лимфоплазмоцитарный характер инфильтрата, распространяющегося вместе с грануляционной тканью. При этом следует подчеркнуть, что вероятнее всего данное иммунное воспаление является проявлением аутоиммунизации и адаптивной гуморальной иммунной реакции, судя по преобладанию плазматических клеток в воспалительном инфильтрате. Иммуногистохимическое исследование у пациентов с периимплантитом выявило высокую пролиферативную активность элементов грануляционной ткани и эпителия, а также высокий уровень ангиогенеза, в ответ на выраженное повреждение и воспалительную реакцию, что может свидетельствовать о нарушении регенерации тканей и приводить к прогрессированию склероза и гиперпластических процессов в эпителии на фоне иммунного воспаления. Хроническое воспаление при ХГП тяжелой степени имеет выраженную активность, в среднем 5 баллов, однако достоверно в меньшей степени (р < 0.05) по сравнению с периимплантитом. Процессы деструкции костной ткани протекают менее активно, в отличие от периимплантита, где формируется фиброзная капсула.
ВЫВОДЫ
По данным морфологического и иммуногистохимического исследований периимплантит отличается от периимплантационного мукозита более выраженной воспалительной реакцией с явным преобладанием плазматических клеток в инфильтрате (р < 0.05), который захватывает фиброзную капсулу вокруг имплантата, разрушат ее и далее распространяется на костную ткань, что может свидетельствовать о иммунном характере воспаления с участием гуморальных иммунных реакций. Периимплантационный мукозит и периимплантит являются последовательными стадиями прогрессирования одного и того же процесса. Молекулярно-биологические и морфологические особенности воспалительной реакции и регенераторных процессов судя по высокой экспрессии SMA, VEGF, Ki-67 при периимплантите свидетельствуют о высокой готовности тканей пародонта к склеротическим изменениям и гиперплазии эпителия. Периимплантит демонстрирует намного более выраженные воспалительно-деструктивные процессы в тканях в области имплантата, обусловленные присоединением иммунного воспаления, нарушением процессов регенерации и разрушением костной ткани.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Научно-исследовательская работа проводится при поддержке внутривузовского гранта ФППОВ ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава РФ (г. Москва) 2019 г.
Список литературы
Berglundh T., Zitzmann N.U., Donati M. Are peri-implantitis lesions different from periodontitis lesions? // J Clin Periodontol. 2011. V. 38. Suppl 11. P. 188–202. https://doi.org/10.1111/j.1600-051X.2010.01672.x
Blinova E., Roshchin D., Kogan E., et al. Patient-Derived Non-Muscular Invasive Bladder Cancer Xenografts of Main Molecular Subtypes of the Tumor for Anti-Pd-l1 Treatment Assessment // Cells. 2019. V. 8 (6). P. 526. https://doi.org/10.3390/cells8060526
Carcuac O., Berglundh T. Composition of human peri-implantitis and periodontitis lesions // J. Dent. Res. 2014. V. 93. P. 1083–1088. https://doi.org/10.1177/0022034514551754
Chrcanovic B.R. A history of periodontitis suggests a higher risk for implant loss // J. Evid. Based Dent. Pract. 2015. V. 15 (4). P. 185–186. https://doi.org/10.1016/j.jebdp.2015.10.003
Ghighi M., Llorens A., Baroukh B. et al. Differences between inflammatory and catabolic mediators of peri-implantitis and periodontitis lesions following initial mechanical therapy: An exploratory study // J. Periodontal. Res. 2018. V. 53 (1). P. 29–39. https://doi.org/10.1111/jre.12483
Gualini F., Berglundh T. Immunohisto-chemical characteristics of inflammatory lesions at implants // J. Clin. Periodontol. 2003. V. 30 (1). P. 14–18.
Jack G. Caton, Gary Armitage, Tord Berglundh et al. A new classification scheme for periodontal and peri-implant diseases and conditions Introduction and key changes from the 1999 classification // J. Clin. Periodontol. 2018. V. 45. Suppl 20. P. S1–S8. https://doi.org/10.1111/jcpe.12935
Knodell R.G., Ishak K.G., Black W.C. et al. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis // Hepatology. 1981. V. 1. P. 431–435.
Raes M., D’hondt R., Teughels W. et al. A 5-year randomized clinical trial comparing minimally with moderately rough implants in patients with severe periodontitis // J Clin Periodontol. 2018. V. 45 (6). P. 711–720. https://doi.org/10.1111/jcpe.12901
Schwarz F., Becker J. Peri-implant Infection: etiology, diagnosis and treatment. 1 st ed. London, UK: Quintessence 2010. P. 296.
Teixeira M.K.S., Lira-Junior R., Telles D.M. et al. Th17-related cytokines in mucositis: is there any difference between peri-implantitis and periodontitis patients? // Clin Oral Implants Res. 2017. V. 28 (7). P. 816–822. https://doi.org/10.1111/clr.12886
Venza I., Visalli M., Cucinotta M. et al. Proinflammatory gene expression at chronic periodontitis and peri-implantitis sites in patients with or without type 2 diabetes // J. Periodontol. 2010. V. 81 (1). P. 99–108. https://doi.org/10.1902/jop.2009.090358
Wong R.L., Hiyari S., Yaghsezian A. et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis // J. Oral. Implantol. 2017. V. 43 (6). P. 437–445. https://doi.org/10.1563/aaid-joi-D-17-00157
Wong R.L., Hiyari S., Yaghsezian A. et al. Early intervention of peri-implantitis and periodontitis using a mouse model // J. Periodontol. 2018. V. 89 (6). P. 669–679. https://doi.org/10.1002/JPER.17-0541
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни