Доклады Российской академии наук. Науки о жизни, 2020, T. 492, № 1, стр. 305-309
КИНЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ В МОЗГЕ ЧЕЛОВЕКА. ХОЛИНЕРГИЧЕСКИЙ СИНАПС – МЕХАНИЗМЫ ФУНКЦИОНИРОВАНИЯ И МЕТОДЫ УПРАВЛЕНИЯ
Член-корреспондент РАН С. Д. Варфоломеев 1, В. И. Быков 2, *, С. Б. Цыбенова 2
1 Московский Государственный Университет
им. М.В. Ломоносова, Институт физико-химических основ функционирования сети нейронов и искусственного интеллекта
Москва, Россия
2 Институт биохимической физики им. Н.М. Эмануэля
Москва, Россия
* E-mail: vibykov@mail.ru
Поступила в редакцию 15.10.2019
После доработки 06.03.2020
Принята к публикации 10.03.2020
Аннотация
В рамках кинетической модели рассмотрено функционирование холинергического синапса. Представлены результаты математического моделирования изменения уровня ацетилхолина, индуцированного pH импульса, влияния частоты передачи импульса и ингибирования ацетилхолинэстеразы. Дано физико-химическое объяснение для ряда принципиально важных физиологических феноменов, таких как нервно-мышечный паралич, молекулярный механизм нейрологической памяти, действия нервно-паралитических ядов и токсинов.
Ключевой функционирующей единицей, в значительной степени, определяющей поведение нейросети мозга, является синапс – супрамолекулярная структура, реализующая контакты между нейронами. Химически активируемый синапс осуществляет передачу возбуждения от одного нейрона другому за счет “инжекции” нейромедиатора в синаптическую щель с последующим взаимодействием нейромедиатора с рецептором, локализованном на постсинаптической мембране. Синапс играет роль “химического полупроводника”, реализующего направленную передачу возбуждения от пресинаптической мембраны клетки донора медиатора к постсинаптической мембране возбуждаемого клетки-партнера. Разнообразие, природа синапсов, механизм передачи электрического возбуждения – предмет, активно исследуемый и разносторонне обсуждаемый в литературе.
Особенную и исключительно важную роль в нейрональных сетях человека играют ацетилхолиновые синапсы, использующие ацетилхолин в качестве нейромедиатора [1–4]. Ацетилхолиновые (холинергические) синапсы задействованы в механизме нервно-мышечной передачи [5, 6], записи и хранении информации [7], в механизмах действия нейротоксинов и антидотов [9–11].
Принципиальной особенностью холинергических синапсов является функционирование фермента ацетихолинэстеразы, локализованного в больших концентрациях в синаптической щели, разделяющей пресинаптическую и постсинаптическую мембраны.
Математические модели BOLD-эффекта и функционирование холинергического синапса представлены в [12]. Существенный фактор, влияющий на динамическое поведение системы, заключается в ингибировании каталитической активности фермента ионами водорода, продуцируемыми ацетилхолинэстеразой при гидролизе ацетилхолина [13]. Дальнейшее развитие модели позволяет выявить, исследовать и количественно описать многие физиологические явления, связанные с функционированием нейрональных сетей с участием ацетилхолиновых синапсов.
Базовая система уравнений:
(1)
$\begin{gathered} \frac{{dS}}{{dt}} = \alpha {{S}_{0}}{{e}^{{ - \delta (t - n\Delta t)}}} - {{v}_{E}}(S,{{H}^{ + }}), \\ \frac{{d{{H}^{ + }}}}{{dt}} = {{v}_{E}}(S,{{H}^{ + }}) - \beta {{H}^{ + }}, \\ {{v}_{E}}(S,{{H}^{ + }}) = \frac{{{{k}_{{cat}}}{{E}_{0}}S}}{{(1 + {{H}^{ + }}{\text{/}}{{K}_{a}})({{K}_{m}} + S + {{S}^{2}}{\text{/}}{{K}_{i}})}}. \\ \end{gathered} $Анализируемая система включает стадию “инжектирования” медиатора в синаптическую щель (αS0), скорость его ферментативного гидролиза ${{v}_{E}}(S,{{H}^{ + }})$, ингибирование фермента ионами водорода и избытком субстрата, диссипативное рассеивание и нейтрализацию ионов водорода (βH+). Параметры системы kcat, Ka, Ki, Km взяты из литературных данных [3, 4].
Основные динамические особенности поведения холинергического синапса представлены в работе [4]. Несмотря на разнообразие структурных характеристик, в качестве некоторого усредненного прототипа холинергического синапса можно принять следующие значения: концентрация субстрата “инжектируемого” в синаптическую щель за счет ионно-механистических эффектов S0 = 18.5 ммоль, концентрация ацетилхолинэстеразы в щели E0 = 50 ммоль [14].
Анализ показывает, что для того чтобы описать полный гидролиз ацетилхолина за времена около 1 мкс необходимо включать в реакцию ацетилхолинэстеразу в большой концентрации, при этом принять, что E0 > S0. Модель (1) достаточно адекватно описывает экспериментальные данные [3, 4].
Известно, что синаптическая задержка лежит в диапазоне 0.3–0.5 мкс, при этом частота ритмических разрядов зависит от силы раздражителя и в норме составляет 50–200 импульсов в секунду [15]. Некоторые нервные клетки (например, вставочные нейроны спинного мозга) разряжаются с частотой 1000–1500 импульсов секунду. Таким образом, если время синаптической задержки, связанного с гидролизом нейромедиатора, принять 2–5 мкс, а частоту импульса – 100 импульсов в секунду (время между импульсами Δt = 10 мкс), то значительную долю времени между импульсами синапс находится в “закрытом”, непроводящем электрическое поле состоянии при полном гидролизе нейромедиатора в синаптической щели (S → 0).
Для описания импульсного поведения системы в первое уравнение (1), описывающей “инжекцию” в синаптическую щель нейромедиатора введен дополнительный фактор (nΔt), где n – число циклов “инжекции”.
Управляющими кинетическим поведением системы являются следующие параметры: концентрация фермента E0, частота импульсов ω = = 1/τимп, скорость инжекции α, инжектируемая концентрация ацетилхолина (нейромедиатора – субстрата) S0, скорость диссипативного вывода из синаптической щели ионов водорода β. Параметры kcat, Ka, Ki, Km, характеризующие кинетику ферментативного гидролиза ацетилхолина, можно принять устойчиво зафиксированными (литературные данные взяты из [3]: kcat = 7 ⋅ 103 с–1; Km = 0.058 ммоль; Ki = 17.9 ммоль; Ka = 10–4 ммоль).
Математическое моделирование позволяет на качественном уровне объяснять ряд физиологических феноменов.
НЕРВНО-МЫШЕЧНЫЕ НЕЙРОПАТОЛОГИИ. НЕРВНО-ПАРАЛИТИЧЕСКИЕ ЯДЫ И АНТИДОТЫ
Известно, что нервно-паралитические газы – фосфорорганические боевые отравляющие вещества: зарин, зоман, VX-газы являются необратимыми ингибиторами, фосфорилизующими серин 203 активного центра ацетилхолинэстеразы человека [10, 11]. Инактивация ацетилхолинэстеразы, которая приводит к потере каталитической активности фермента, в первом приближении может быть описана экспоненциальной функцией
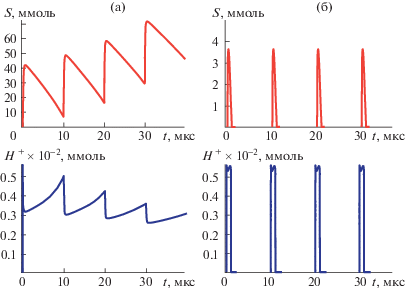
где τin – обратная величина константы скорости взаимодействия ингибитора I с активным центром фермента [2, 10].На рис. 1 представлено кинетическое поведение холинергического синапса в норме и при времени экспозиции системы t = 3τin (средний рисунок).
Рис. 1.
Динамика изменения концентраций S и H+ в холинергическом синапсе в норме, после инактивации (б) и реактивации (в) при значениях параметров: S0 = 18.5 ммоль; E0 = 50 ммоль; α = 104 с–1; β = 106 с–1; δ = 9 ⋅ 103; n = 4
Видно, что существенное понижение активности ацетилхолинэстеразы вызывает полное открытие синапса для передачи возбуждения. Нейромедиатор не разрушается ацетилхолинэстеразой (S > 0 во всем диапазоне времени), нейрон находится в постоянно возбужденном состоянии, посылая сигналы на непрерывное сокращение мышечной ткани. Вещества, используемые в качестве реактиваторов ацетилхолинэстеразы (антидоты, обычно оксимы), вызывают увеличение уровня концентрации активного фермента [11]
где τr – характерное время реактивации фер-мента.На рис. 1 (правая часть) представлены данные динамического поведения синапса после реактивации при t = 4τr. Происходит практически полное восстановление функционирования синапса.
НЕРВНО-МЫШЕЧНЫЙ ПАРАЛИЧ ПРИ ИНСУЛЬТНОМ ПОРАЖЕНИИ МОЗГА
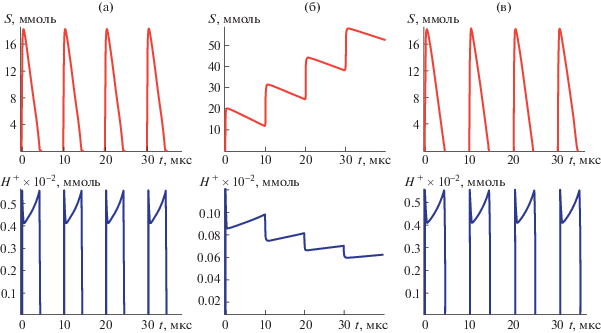
Типичным патологическим проявлением поражения центральной нервной системы (ЦНС) является нервно-мышечный паралич – постоянное сокращение мышц, ассоциированных с зоной поражения [5, 6]. По своей феноменологической картине развития патологии этот тип поражения мало отличается от действия нервно-паралитических ядов. Однако, эта патология может иметь другую физико-химическую природу. Нервно-мышечный паралич может быть связан с изменением частотных характеристик системы [15]. Возможно, пораженные области ЦНС подают сигналы нервно-мышечным синапсам с увеличенной частотой (рис. 2).
Рис. 2.
Кривые изменения концентраций ацетилхолина (S) и ионов водорода (H+) при варьировании частоты передачи импульсов: ω = 100 Гц (а); ω = 250 Гц (б).

При этом концентрация ацетилхолина в результате одиночного разряда не достигает нулевого значения – ацетилхолин проскальзывает в синаптическую щель, синапс непрерывно подает сигналы на сокращение. Зона синаптической щели закислена (pH около 5), что полностью блокирует активность ацетилхолинэстеразы.
ТОКСИН CLOSTRIDIUM BOTULINUM (BOTOX)
Одним из самых сильных нервно-паралитических ядов является токсин, вырабатываемый анаэробным микроорганизмом Clostridium botulinum. Согласно проведенным исследованиям этот токсин блокирует выделение ацетилхолина в синаптическую щель [8, 9]. В рамках данной модели этот токсин уменьшает S0. Однако, препараты токсина с невысокими характеристиками токсичности используют при лечении инсультных параличей. Проведение моделирования объясняет природу этого эффекта. С уменьшением концентрации ацетилхолина в синаптической щели под действием Botox падает скорость ферментативного гидролиза, снимая pH-блокаду синапса.
При определенной глубине уменьшения S0 ацетилхолинэстераза полностью гидролизует медиатр в синаптической щели, восстанавливая нормальное функционирование синапса (рис. 3б).
ПРОТОННЫЙ МЕХАНИЗМ ЗАПИСИ И ХРАНЕНИЯ ИНФОРМАЦИИ
Одна из наиболее достоверных и оправданных гипотез о природе неврологической памяти заключается в использовании представлений о механизме “открыт–закрыт” синаптического контакта при записи и хранении информации. Объемы записываемой информации соответствуют объемам неврологической памяти человека [7]. До настоящего времени остается открытым вопрос о молекулярной природе механизма “открыт–закрыт” синапс с точки зрения записи и относительно долговременного сохранения записанной информации. Представленная модель дает ответ на эти вопросы.
Запись информации, возможно, инициируется увеличением частоты нервного импульса в системе неврологической памяти. Это обеспечивает для данного синапса по пути взаимодействия с другими нейронами полное “открытие” передачи возбуждения. Ацетилхолин непрерывно достигает постсинаптической мембраны, обеспечивая включение данного синапса в систему записи информации. Переход от частоты 100 импульсов в секунду к частоте 250 импульсов в секунду обеспечивает “открытие” синапса (см. рис. 2).
Хранение информации связано с pH-блокировкой ацетилхолинэстеразы, обеспечивая синапсу непрерывное участие в передаче сигнала. Этот механизм может работать как при афферентном пути (запись информации), так и при эфферентном пути (считывание информации). В рамках данных представлений физико-химическая природа записи и сохранения информации имеет ту же основу, что и паралич, индуцированный инсультным поражением мозга (см. рис. 2).
Таким образом, в данной работе на основе предложенной кинетической модели (1) представлены результаты математического моделирования функционирования ацетилхолинового синапса при инактивации и реактивации ацетилхолинэстеразы, изменении частоты передачи импульса.
Модель (1) достаточно адекватно позволяет описать ряд физиологических феноменов: отравление нервно-паралитическими ядами, нервно-мышечный паралич, применение токсина Botox при лечении инсультных параличей, механизм записи и хранения информации в нейрологической памяти. Рассмотренная кинетическая модель может быть названа базовой, поскольку позволяет описывать основные процессы в синаптической щели. В дальнейшем ее можно детализировать и расширять.
В заключение отметим, что pH-импульс, связанный с гидролизом ацетилхолина и образованием уксусной кислоты, затрагивает всех участников синаптической передачи. Ключевыми здесь являются ацетилхолиновые рецепторы, функционирование которых зависит от pH [16, 17]. Этот эффект требует специального изучения.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Работа поддержана Российским научным фондом (грант № 18–13–00030).
Список литературы
Rozengart E.V., Basova N.E., Moralev S.N., et al. Research on cholinesterases in the Soviet Union and Russia: a historical perspective // Chemico-Biological Interactions. 2013. V. 203. № 1. P. 3–9.
Nemukhin A.V., Grigorenko B.L., Morozov D.I., et al. On quantum mechanical-molecular mechanical (QM/MM) approaches to model hydrolysis of acetylcholine by acetylcholinesterase // Chemico-Biological Interactions. 2013. V. 203. № 1. P. 51–56.
Rosenberry T.L., Mallender W.D., Thomas P.J., et al. A steric blocade model for inhibition of acetylcholinesterase by peripheral site ligands and substrate // Chemico-Biological Interactions. 1999. V. 119–120. P. 85–97.
Reed M.C., Lieb A., Nijhout H.F. The biological significance of substrate inhibition: A mechanism with diverse functions // Bioessays. 2010. V. 32. P. 422–429.
Shi L., Fu A.K.Y., Ip N.Y. Molecular mechanisms underlying maturation and maintenance of the vertebrate neuromuscular junction // Trends Neurosci. 2012. V. 35. № 7. P. 441–453.
Tai K., Bond S.D., MacMillan H.R., et al. Finite element simulations of acetylcholine diffusion in neuromuscular junctions // Biophysical Journal. 2003. V. 84. № 4. P. 2234–2241.
Hasselmo M.E. The role of acetylcholine in learning and memory // Current Opinion in Neurobiology. 2006. V. 16. № 6. P. 710–715.
Pirazzini M., Rossetto O., Eleopra R., Montecucco C. Botulinum neurotoxins: biology, pharmacology, and toxicology // Pharmacol. Rev. 2017. V. 69. P. 200–235.
Papapetropoulos S., Singer C. Botulinum toxin in movement disorders // Semin. Neurol. 2007. V. 27. № 2. P. 183–194.
Lushchekina S., Gubaydullina A., Polomskih V., et al. QM/MM of ChE-catalyzed reactions with special attention to OP inhibition // FEBS Journal. 2013. V. 280. № SI Suppl. 1. P.164–174.
Kassa J. Review of oximes in the antidotal treatment of poisoning by organophosphorus nerve agents // Journal of Toxicology: Clinical Toxicology.2002. V. 40. № 6. P. 803–816.
Варфоломеев С.Д., Семенова Н.А., Быков В.И., и др. Кинетика химических процессов в мозге человека. Моделирование BOLD-сигнала при фМРТ исследовании // Доклады Академии наук. 2019. Т. 488. № 2. С. 157–161.
Komersova A., Kovarova M., Komers K., et al. Why is the hydrolytic activity of acetylcholinesterase pH dependent? Kinetic study of acetylcholine and acetylthiocholine hydrolysis catalyzed by acetylcholinesterase from electric eel // Zeitschrift fur Naturforschung. C, Journal of Biosciences. 2018. V. 73. № 10. P. 345–351.
Aidoo A, Ward K. Spatio-temporal concentration of acetylcholine in vertebrate synaptic cleft. Mathematical and Computer Modelling. 2006. V. 44. P. 952–962.
Dunant Y., Gisiger V. Ultrafast and slow cholinergic transmission. Different involvement of acetylcholinesterase molecular forms // Molecules. 2017. V. 22. № 8. P. 1300–1315.
Li L., McNamee M.G. Modulation of nicotinic acetylcholine receptor channel by pH: a difference in pH sensitivity of Torpedo and mouse receptors expressed in Xenopus oocytes // Cellular and Molecular Neurobiology. 1992. V.12. № 2. P. 83–93.
Palma A., Li L., Chen X., et al. Effects of pH on acetylcholine receptor function // Journal of Membrane Biology. 1991. V. 120. P. 67–73.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни