Доклады Российской академии наук. Науки о жизни, 2020, T. 492, № 1, стр. 293-296
ЭПИТОПНЫЙ АНАЛИЗ МЫШИНЫХ И ХИМЕРНЫХ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, РАСПОЗНАЮЩИХ РАКОВО-ТЕСТИКУЛЯРНЫЙ АНТИГЕН PRAME
В. А. Мисюрин 1, *, Ю. П. Финашутина 1, А. А. Турба 1, М. В. Ларина 1, О. Н. Солопова 1, Н. А. Лыжко 1, Л. А. Кесаева 1, Н. Н. Касаткина 1, Т. К. Алиев 3, 1, А. В. Мисюрин 2, академик РАН М. П. Кирпичников 3, 4
1 ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России
Москва, Россия
2 ООО “Генотехнология”
Москва, Россия
3 Институт биоорганической химии имени академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
4 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
* E-mail: vsevolod.misyurin@gmail.com
Поступила в редакцию 26.12.2019
После доработки 20.02.2020
Принята к публикации 20.02.2020
Аннотация
Исследована эпитопная специфичность ряда моноклональных антител, распознающих раково-тестикулярный антиген PRAME. Антитело 5D3 связывается с фрагментом, соответствующим участку 160–180 аминокислотных остатков белка PRAME. Антитела 6H8 и F11 связываются с фрагментом, соответствующему участку 180–200 аминокислотных остатков белка PRAME. После химеризации полученные антитела сохранили способность распознавать данные фрагменты белка PRAME.
Проблема терапии онкологических заболеваний по-прежнему остается актуальной, так как даже новейшие разработки в области персонализированной медицины оказываются не самыми эффективным и не всегда позволяют полностью излечить больного. Тем не менее, возможна разработка новых способов терапии. В частности, остается малоисследованной проблема возможности создания антител для терапии, основанной на их связывании с опухолевым антигеном PRAME.
PRAME – это раково-тестикулярный антиген (РТА), экспрессия которого наблюдается при многих онкологических заболеваниях. В числе этих заболеваний – меланома, рак легких, рак молочной железы, нейробластома, острые лейкозы и многие другие [1, 2]. В отличие от большинства РТА белок PRAME находится на мембране клетки, что было доказано в нескольких исследованиях, в которых проводилась окрашивание опухолевых клеток антителами [3, 4]. Поверхностная локализация PRAME также подтверждается данными, полученными при исследовании белка OPA гонококка, который предназначен для проникновения Neisseria gonorrhoeae внутрь клеток. Так, в процессе инфицирования OPA связывается с рядом поверхностных белков, одним из которых является белок PRAME [5].
Локализация PRAME интересна тем, что у белка нет трансмембранного домена, а на поверхности отсутствуют гидрофобные участки, с помощью которых он мог бы флотировать в мембране клетки. Несмотря на это, PRAME может быть перспективной мишенью для направленной терапии. Например, Pankov [4] показал, что можно разработать антитела для терапии PRAME-экспрессирующих опухолей. Согласно этой работе, в структуре белка PRAME распознается эпитоп, включающий в себя аминокислотные остатки (а.о.) 310-331 с последовательностью RGRLDQLLRHVMNPLETLSITN.
Поскольку направленная терапия может быть неэффективной по причине иммуноредактирования опухоли, антитело, описанное в работе Pankov et al. [4], может утратить терапевтическую эффективность в результате появления мутаций в эпитопе. Таким образом, получение моноклональных антител (мАТ), распознающих другие последовательности белка PRAME, может увеличить шанс излечения больных.
Целью данного исследования являлось изучение эпитопной специфичности моноклональных мышиных и полученных на их основе химерных рекомбинантных антител по отношению к раково-тестикулярному антигену PRAME.
При выполнении работы мы использовали анти-PRAME мышиные мАТ 5D3 и 6H8, ранее полученные нашей группой с помощью иммунизации рекомбинантным белком PRAME мышей линии Balb/c [6]. По аналогичной методике нами были созданы другие антитела против белка PRAME: F11, G4, C10, B6, B2 и G2. Были получены нуклеотидные последовательности, кодирующие вариабельные домены легких и тяжелых цепей мАТ 5D3, 6H8 и F11, на основе которых были сконструированы экспрессионные векторы для продукции химерных (мышь/человек) рекомбинантных антител IgG1 изотипа. Химерные мАТ получали методом транзиентной экспрессии в клетках CHO (Chinese Hamster Ovary).
Для эпитопного анализа исследуемых антител в клетках E.coli экспрессировали фрагменты белка PRAME. Всего было получено 5 фрагментов белка PRAME, которые были экспрессированы в клетках независимо в составе 5 слитых рекомбинантных белков, каждый из которых содержал аминокислотную последовательность тиоредоксина и соответствующий фрагмент PRAME. В качестве контроля использовали клетки, экспрессирующие только тиоредоксин (Trx), и клетки, экспрессирующие N-концевой фрагмент белка PRAME (фрагмент PN, в составе которого находятся а.о. с 1-го по 220-й из первичной структуры природного белка PRAME) без тиоредоксина. N-концевой фрагмент белка был разбит на 4 приблизительно равные части с перекрыванием на 20 аминокислотных остатков. Фрагмент PN1 включал в себя а.о. природного белка PRAME 1–65, фрагмент PN2 а.о. 56–125, фрагмент PN3 а.о. белка PRAME 115–180, фрагмент PN4 включал в себя а.о. 160–222. Пятый фрагмент белка PRAME (PN4.3) представлял собой гидрофильный полипептид KRKKNVLRLCCKKLK (а.о. с 200-го по 214-й из первичной структуры природного белка PRAME), который с высокой вероятностью мог быть эпитопом для исследуемых мАТ. Эпитопный анализ на первом этапе работы проводили методом Вестерн-блот. Для этого белки, содержащиеся в клеточных лизатах E.coli, экспрессирующих фрагменты белка PRAME, разделяли в 10%-м SDS-ПААГ [7] в восстанавливающих условиях, после чего проводили электрофоретический перенос белков на PVDF мембрану Hybond-P (GE Healthcare, Великобритания). В качестве первичных антител использовали исследуемые мАТ в концентрации 3 мкг/мл. Для детекции связывания антител с антигеном использовали пероксидазный конъюгат антитела к каппа-цепи человека 4G7 (ОАО “ВЦМДЛ”, Россия) в разведении 1 : 50 000. Результаты частичного картирования эпитопов PRAME для исследуемых мАТ методом Вестерн-блот представлены в сводной табл. 1.
Таблица 1.
Узнавание фрагментов белка PRAME антителами, установленное методами Вестерн-блоттинга и иммуноферментного анализа (ИФА). “+” – зафиксировано связывание антител с фрагментом, “–” – связывание антител не зафиксировано, “н/д” – нет данных
| Фрагмент PRAME | PN | PN1 | PN2 | PN3 | PN4 | PN4.3 |
|---|---|---|---|---|---|---|
| Границы а.о. по белку | 1–220 | 1–65 | 56–125 | 115–180 | 160–222 | 200–214 |
| 5D3 | + | – | – | + | + | н/д |
| 6H8 | + | – | – | – | + | н/д |
| F11 | + | – | – | – | + | – |
| G4 | + | – | – | – | + | н/д |
| C10 | + | – | – | – | + | н/д |
| B6 | + | – | – | – | + | н/д |
| B2 | + | – | – | – | + | н/д |
| G2 | + | – | – | – | + | н/д |
| 5D3chim | + | – | – | + | + | – |
| 6H8chim | + | – | – | – | + | – |
| F11chim | + | – | – | – | + | – |
Таким образом, фрагменты белка PRAME, с которыми связываются все исследованные антитела, входят в состав фрагмента PN. При этом мАТ 5D3 связывается с фрагментами PN3 и PN4, которые содержат совпадающие аминокислотные последовательности, соответствующие участку 160–180 а.о. белка PRAME. Остальные антитела связываются с фрагментом PN4, и не связываются с фрагментом PN3. Таким образом, данные антитела могут распознавать фрагмент полипептидной цепи, соответствующей структуре 180–220 а.о. белка PRAME.
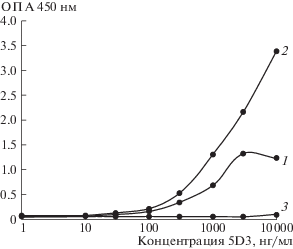
Продолжая исследование, мы проверели связывающую способность полученных антител по отношению к фрагментам белка PRAME методом непрямого ИФА. Лизаты клеток E. coli, содержащие фрагменты белка PRAME PN3, PN4 и PN4.3 сорбировали на иммунологический планшет в концентрации 1 мкг/мл. Далее на планшет наносили серии разведений антител 5D3, 6H8, F11 и других исследуемых мАТ в диапазоне концентраций от 10 до 10 000 нг/мл с шагом 3. В качестве отрицательного контроля использовали мАТ G9. Для детекции связывания мАТ использовали антивидовой пероксидазный конъюгат антител против IgG человека в разведении 1 : 75 000 (ОАО “ВНЦМДЛ”, Россия). Данный метод подтвердил результаты, полученные методом Вестерн-блот. Согласно полученным результатам (рис. 1), антитело 5D3 связывается с фрагментами PN3 и PN4 и не связывается с фрагментом PN4.3 в непрямом ИФА. Таким образом, распознаваемая антителом 5D3 аминокислотная последовательность лежит в пределах 160–180 а.о. белка PRAME.
Рис. 1.
Кривые титрования антитела 5D3 на сорбированных лизатах E.coli, экспрессирующих фрагменты PRAME. 1 – фрагмент PN3; 2 – фрагмент PN4; 3 – фрагмент PN4.3.
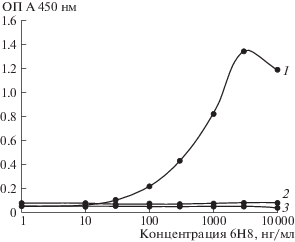
Антитела, 6H8 и F11 связываются с фрагментом PN4, и не связываются с фрагментами PN3 и PN4.3 (рис. 2). Из этого следует, что антитела 6H8 и F11 распознают фрагмент белка PRAME, соответствующий участку 180–200 а.о. Таким образом, в первичной структуре белка PRAME находятся последовательности, с которыми связываются антитела 5D3, 6H8 и F11 (рис. 3).
Рис. 2.
Кривые титрования антитела 6H8 на сорбированных лизатах E.coli, экспрессирующих фрагменты PRAME. 1 – фрагмент PN4; 2 – фрагмент PN3; 3 – фрагмент PN4.3.
Нами также показано, что химерные антитела 5D3 chim, 6H8 chim и F11 chim сохранили эпитопную специфичность после замены мышиных константных доменов мАТ на человеческие.
Несмотря на то, что была получена достаточно большая панель мАТ к раково-тестикулярному антигену PRAME, все они связываются с небольшим фрагментом белка. Это может объясняться тем, что проводилась иммунизация мышей одной линии Balb/c. Вследствие генетической однородности у мышей могло быть совсем небольшое количество генов, кодирующих вариабельные домены антител, подходящих для выработки гуморального ответа против антигена PRAME. Тем не менее, распознаваемый эпитоп отличает созданные нами антитела от других, разработанных группой Pankov et al.
Таким образом, в данной работе был проведен эпитопный анализ панели мАТ к белку PRAME. Было показано, что исследуемые антитела распознают два разных участка белка PRAME, соответствующих фрагментам 160–180 и 180–200 а.о. последовательности белка. Исследуемые мАТ могут быть в дальнейшем использованы для создания гуманизированных антител, что даст возможность для разработки на их основе иммунотерапевтического противоопухолевого препарата. Поскольку антитела связываются с разными последовательностями, они могут быть использованы как взаимозаменяемые препараты для снижения риска развития резистентности опухоли вследствие потери одного из эпитопов.
Список литературы
Мисюрин В.А. // Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2018. № 11 (1). С. 26–33.
Мисюрин В.А. // Иммунология. 2018. № 39 (1). С. 67–73.
Luetkens T., Schafhausen P., Uhlich F., Stasche T., Akbulak R., Bartels B.M., Hildebrandt Y., Gontarewicz A., Kobold S., Meyer S., Gordic M., Bartels K., Lajmi N., Cao Y., Kröger N., Bokemeyer C., Brümmendorf T.H., Atanackovic D. // LeukRes. 2010. V. 34 (12). P. 1647–55.
Pankov D., Sjostrom L., Kalidindi T., Lee S.G., Sjos-trom K., Gardner R., McDevitt M.R., O’Reilly R., Tho-rek D.L.J., Larson S.M., Veach D., Ulmert D. // Oncotarget. 2017. V. 8 (39). P. 65917–65931.
Williams J.M., Chen G.C., Zhu L., Rest R.F. // Mol. Microbiol. 1998. V. 27 (1). P. 171–86.
Финашутина Ю.П., Мисюрин А.В., Ахлынина Т.В. и др. // Российский биотерапевтический журнал. 2015. № 14 (3). С. 29–37.
Laemmli U.K. // Nature. 1970. V. 227. P. 680–685.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни



