Доклады Российской академии наук. Науки о жизни, 2020, T. 493, № 1, стр. 423-426
ПЕПТИДНЫЙ БЛОКАТОР ИОННОГО КАНАЛА TRPV1 ПРОЯВЛЯЕТ ДЛИТЕЛЬНЫЙ АНАЛЬГЕТИЧЕСКИЙ ЭФФЕКТ В МОДЕЛИ ТЕПЛОВОЙ СТИМУЛЯЦИИ
О. В. Синцова 1, В. А. Паликов 2, Ю. А. Паликова 2, А. А. Климович 1, И. Н. Гладких 1, Я. А. Андреев 3, 4, М. М. Монастырная 1, Э. П. Козловская 1, И. А. Дьяченко 2, С. А. Козлов 3, Е. В. Лейченко 1, *
1 Тихоокеанский институт биоорганической химии
им. Г.Б. Елякова Дальневосточного отделения Российской академии наук
Владивосток, Россия
2 Филиал Института биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Пущино, Московская область, Россия
3 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
4 Первый Московский государственный медицинский университет имени И.М. Сеченова Минздрава России, Институт Молекулярной медицины
Москва, Россия
* E-mail: leychenko@gmail.com
Поступила в редакцию 26.12.2019
После доработки 20.02.2020
Принята к публикации 06.03.2020
Аннотация
Одним из важнейших интеграторов болевых и воспалительных стимулов является ионный канал TRPV1, который рассматривается как перспективная терапевтическая мишень в лечении болевых состояний. В настоящей работе проведено сравнительное изучение анальгетического действия в тесте “горячая пластина” рекомбинантных аналогов пептидов Кунитц-типа из яда морской анемоны Heteractis crispa: APHC1 – модулятора TRPV1, и HCRG21 – полного блокатора TRPV1. В результате проведенных биологических испытаний показано, что полный блокатор HCRG21, несмотря на более высокое значение 50% эффективной концентрации ингибирования TRPV1, обладал равной анальгетической способностью с APHC1 при внутримышечном введении и сохранял ее в течение 13 часов наблюдения. Анальгетический эффект APHC1 в дозе 0.1 мг/кг при внутримышечном введении развивался очень быстро, за 5 мин, но длился менее 3 ч. Различия в фармакодинамическом профиле пептидов хорошо согласуются с различными механизмами их связывания с TRPV1.
В настоящее время ионные каналы являются перспективными терапевтическими мишенями для создания селективных лекарственных препаратов нового поколения. Выяснение механизмов их функционирования в норме и при патологии остается одной из актуальных задач биохимии, решение которой невозможно без использования соединений различной химической природы, способных специфически взаимодействовать с этими белками, и по возможности проявлять отличающиеся эффекты. Целенаправленный поиск новых лигандов ионных каналов как кандидатов для создания лекарственных препаратов представляет постоянный научный интерес, как для разработки методологии фундаментальных и прикладных исследований, так и для селекции наиболее безопасного и эффективного лекарственного средства.
Канал TRPV1 (transient receptor potential vanilloid type 1) является одним из важнейших интеграторов болевых и воспалительных стимулов и рассматривается как терапевтическая мишень в лечении болевых состояний разной этиологии. В организме млекопитающих он отвечает, прежде всего, за терморегуляцию и передачу болевых сигналов от периферии в мозг, и, как молекулярный сенсор, он распознает опасное нагревание выше 43°С, закисление внеклеточной среды и многочисленные агонисты различной природы [1].
Традиционные анальгетические средства по основному механизму своего действия либо подавляют воспалительные процессы, либо тормозят функционирование болевой (ноцицептивной) системы. Антагонисты TRPV1, блокируя важный рецептор и интегратор болевых стимулов на чувствительных нейронах, вызывают длительную анальгезию, поэтому их следует рассматривать как реальную альтернативу традиционным анальгезирующим средствам. К настоящему времени из природных источников выделено довольно много низкомолекулярных соединений и несколько пептидных лигандов к TRPV1, однако все они являются либо активаторами (капсаицин, резинифератоксин, VaTx1-3, DkTx, RhTx, BmP01), либо неполными ингибиторами (APHC1–APHC3, AG489) этого канала [2].
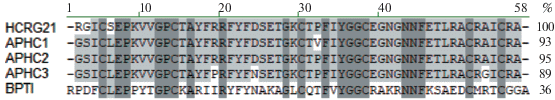
Ранее нами было установлено, что рекомбинантный аналог пептида HCRG21, ген которого был найден среди транскриптов, кодирующих пептиды Кунитц-типа морской анемоны Heteractis crispa, ингибирует сериновые протеазы: трипсин (константа ингибирования, Ki, 2.0 × 10–7 M) и химотрипсин (Ki 7.0 × 10–7 M) и блокирует на 95% индуцированные капсаицином токи, проходящие через экспрессированные в ооцитах лягушки каналы TRPV1 (IC50 6.9 ± 0.4 мкМ) [3]. Этот пептид обладает высокой структурной гомологией (до 95% идентичности) с выделенными из той же морской анемоны модуляторами TRPV1 – пептидами APHC1–APHC3 (рис. 1), которые проявляют анальгетический эффект в различных моделях стимуляции боли у лабораторных животных [4–9]. Пептиды APHC1–APHC3 и HCRG21 имеют характерную α + β укладку, стабилизированную тремя дисульфидными связями, так называемый BPTI/Кунитц-тип, впервые описанный для ингибитора сериновых протеаз из поджелудочной железы быка (BPTI – Bovine Pancreas Trypsin Inhibitor).
Рис. 1.
Множественное выравнивание аминокислотных последовательностей пептидов Кунитц-типа морской анемоны H. crispa, модуляторов TRPV1, и BPTI из Bos taurus. Выравнивание выполнено с помощью программы Vector NTI. Консервативные и подобные аминокислотные остатки (а.о.) выделены светлым оттенком серого цвета. Идентичные а.о. показаны на темно-сером фоне. Справа от последовательностей указан процент их идентичности относительно HCRG21.
Согласно данным молекулярного моделирования, пептиды APHC1 и HCRG21 имеют разные сайты связывания: APHC1 взаимодействует с TRPV1 в области внешней Р-петли [10], тогда как HCRG21 блокирует трансмембранную пору канала [3]. Блокирование поры и, как следствие, снижение проводимости ионного канала по другому механизму – является принципиально иным методическим подходом для купирования боли, несмотря на взаимодействие HCRG21 с той же молекулярной мишенью, что и APHC1.
Для изучения анальгетического эффекта мы получили рекомбинантные аналоги пептидов APHC1 и HCRG21 согласно разработанным ранее методикам [3, 11–14]. Для клонирования генов, кодирующих эти пептиды, использовали плазмиду pET32b. Пептиды получали в составе гибридного белка с тиоредоксином и полигистидиновой последовательностью для выделения целевых продуктов с помощью металл-аффинной хроматографии. Перед первым аминокислотным остатком пептидов был размещен остаток метионина для селективного расщепления гибридного белка и получения целевого продукта [15]. Обработанные бромцианом пептиды были очищены методом обращенно-фазовой ВЭЖХ. Выход целевых пептидов составил 2.0 и 5.5 мг/л культуральной среды для APHC1 и HCRG21 соответственно. Молекулярные массы полученных пептидов, по данным MALDI-TOF MS, соответствовали расчетным.
Эффективность обоих лигандов при внутримышечном способе введения была впервые оценена на животной модели “горячая пластина”, которая наиболее объективно отражает активацию канала TRPV1 теплом. Рекомбинантные пептиды в дозах от 0.01 до 1 мг/кг в объеме 0.07 мл вводили мышам линии ICR в латеральную мышцу левого бедра. Контрольным мышам вводили 1%-ный раствор PBS в том же объеме. После введения исследуемых веществ на 60-й мин животных помещали на горячую пластину Hot-Plate Analgesia Meter (Columbus Instruments, Columbus, OH, USA), заранее нагретую до 55°С. Фиксировали латентное время от момента помещения животного на горячую пластину до первого подпрыгивания. Максимальное время пребывания животного на пластине составляло 60 с.
Согласно полученным данным, анальгетическое действие пептидов в дозе 0.1 мг/кг одинаково достоверно отличалось от контроля, но время задержки времени первого подпрыгивания для модулятора APHC1 было больше. Таких же значений задержки для пептидного блокатора HCRG21 удалось добиться в дозе 0.5 мг/кг (рис. 2). При повышении дозы до 1 мг/кг наблюдалось незначительное снижение эффективности обоих пептидов.
Рис. 2.
Дозозависимое ингибирование термической ноцицепции пептидами APHC1 и HCRG21 (n = 6 для каждой группы). Результаты представлены в виде среднего значения ± s.e.; * – р <0.05, ** – р < 0.01, *** – p < 0.001 по сравнению с группой с PBS (тест Стьюдента).

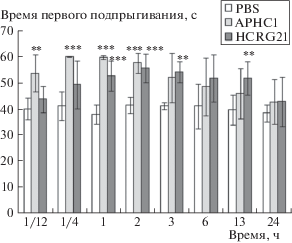
Для сравнения эффективности анальгетического действия была изучена фармакодинамика исследуемых пептидов в том же тесте при внутримышечном введении в течение 24 ч в дозе 0.1 мг/кг.
Ярко-выраженное анальгетическое действие HCRG21 начало проявляться через час после введения и сохранялось в течение 13 ч (рис. 3). В отличие от HCRG21, пептид APHC1 быстро увеличивал время первого подпрыгивания (на 34% уже на 5-й мин), но уже к 3-м ч APHC1 не оказывал достоверного анальгетического эффекта. Это можно объяснить различием измеренных в экспериментах in vitro значений полумаксимального эффекта пептидов на проводимость капсаицин-индуцированных токов через TRPV1; так EC50 для APHC1 составляло 54 нМ [12], а IC50 для HCRG21 – 6.9 мкМ [3]. Более аффинный лиганд APHC1, связываясь прочнее, достигал более быстрого эффекта (максимальный эффект на 15-й мин), тогда как анальгетическое действие полного блокатора HCRG21 развивалось в течение 1 ч (максимальный эффект 2 часа), но оно было более пролонгированным. К 24-м ч эффекты обоих пептидов практически не отличались от контроля.
Рис. 3.
Динамика развития обезболивающего действия пептидов APHC1 и HCRG21 за 24 ч (n = 6 для каждой группы). Результаты представлены в виде среднего значения ± s.e.; * – р < 0.05, ** – р < 0.01, *** – p < 0.001 по сравнению с группой с PBS (тест Стьюдента).
Таким образом, в настоящем исследовании впервые была изучена анальгетическая активность пептида HCRG21 на животных в тесте тепловой чувствительности “горячая пластина”. Данные для APHC1 в подобных тестах были уже опубликованы, но не для внутримышечного способа введения. Результаты исследования объективно отражают потенциал обоих пептидов как хороших анальгетиков. С учетом разности измеренных ранее констант в экспериментах in vitro, результаты на животной модели частично подтверждают предположение, сделанное на основе результатов электрофизиологических измерений, что при практически полном блокировании ионного канала TRPV1 можно достичь более длительного анальгетического эффекта. В свою очередь более низкое значение ЕC50 обусловливает быстрое развитие анальгетического эффекта. В итоге оба пептида удачно дополняют друг друга, и их комбинация в одном анальгетическом препарате, вероятно, приведет к очень быстрой и продолжительной анальгезии.
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
Работа выполнена в рамках проекта по гранту РНФ № 19-74-20088, авторы в работе использовали оборудование ЦКП ИБХ, поддержанного Минобрнауки России, идентификатор соглашения RFMEFI62117X0018.
Список литературы
Carnevale V., Rohacs T. // Pharmaceuticals. 2016. V. 9. P. 1–20.
Maatuf Y., Geron M., Priel A. // Toxins. 2019. V. 11. P. 1–34.
Monastyrnaya M., Peigneur S., Zelepuga E. et al. // Mar. Drugs. 2016. V. 14. P. 1–20.
Andreev Y.A., Kozlov S.A., Korolkova Y.V. et al. // Mar. Drugs. 2013. V. 11. P. 5100–5115.
Козлов С.А., Андреев Я.А., Мурашев А.Н. и др. // Биоорган. химия. 2009. Т. 35. P. 789–798.
Дьяченко И.А., Андреев Я.А., Логашина Я.А. и др. // Докл. АН. 2015. Т. 465. С. 252–254.
Дьяченко И.А., Паликов В.А., Паликова Ю.А., и др. // Биоорган. химия. 2017. Т. 43. С. 482–490.
Табакмахер В.М., Синцова О.В., Кривошапко О.Н. и др. // Докл. АН. 2015. Т. 461. С. 232–235.
Андреев Я.А., Козлов С.А., Козловская Э.П. и др. // Докл. АН. 2009. Т. 424. С. 688–691.
Nikolaev M.V., Dorofeeva N.A., Komarova M.S. et al. // PLoS ONE. 2017. V. 12. P. 1–16.
Синцова О.В., Пислягин Е.А., Гладких И.Н. и др. // Биоорган. химия. 2017. Т. 43. С. 105–112.
Andreev Y.A., Kozlov S.A., Koshelev S.G. et al. // J. Biol. Chem. 2008. V. 283. P. 23914–23921.
Кветкина А.Н., Лейченко Е.В., Юрченко Е.А. и др. // Биоорган. химия. 2018. Т. 44. С. 408–416.
Синцова О.В., Монастырная М.М., Пислягин Е.А. и др. // Биоорган. химия. 2015. Т. 41. С. 657–663.
Andreev Y.A., Kozlov S.A., Vassilevski A.A. et al. // Anal. Biochem. 2010. V. 407. P. 144–146.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


