Доклады Российской академии наук. Науки о жизни, 2020, T. 493, № 1, стр. 381-384
РОЛЬ МОЗГА В РЕГУЛЯЦИИ ПЕРИФЕРИЧЕСКИХ ОРГАНОВ-ИСТОЧНИКОВ НОРАДРЕНАЛИНА У НЕОНАТАЛЬНЫХ КРЫС: АКТИВНОСТЬ ФЕРМЕНТОВ СИНТЕЗА НОРАДРЕНАЛИНА
А. Р. Муртазина 1, Ю. О. Никишина 1, *, академик РАН М. В. Угрюмов 1
1 Федеральное государственное бюджетное учреждение науки Институт биологии развития им. Н.К. Кольцова Российской академии наук
Москва, Россия
* E-mail: zubova.y@gmail.com
Поступила в редакцию 25.03.2020
После доработки 15.04.2020
Принята к публикации 15.04.2020
Аннотация
Исследование направлено на изучение механизмов гуморальной взаиморегуляции норадреналин-продуцирующих органов у крыс в перинатальном периоде развития. Через 48 и 72 ч после введения иммунотоксина (анти-дофамин-бета-гидроксилаза-сапорин) в желудочки мозга крыс, в мозге, надпочечниках определяли активность ферментов синтеза норадреналина – тирозингидроксилазы и дофамин-бета-гидроксилазы. Было показано, что через 48 ч после введения иммунотоксина в мозг активность тирозингидроксилазы в мозге падает, при этом через 72 ч восстанавливается до уровня контроля, что указывает на то, что в выживших нейронах усиливается синтез норадреналина. В надпочечниках через 72 ч после введения иммунотоксина в мозг увеличивается активность дофамин-бета-гидроксилазы, что свидетельствует о компенсаторном увеличении скорости синтеза норадреналина в надпочечниках при ингибировании синтеза норадреналина в мозге.
В перинатальном периоде развития физиологически активные вещества играют важную роль в регуляции развития и функционирования организма в качестве индукторов развития. Синтез этих веществ и поддержание в крови их физиологически активной концентрации является необходимым условием нормального развития, сохранения гомеостаза и целостности организма [1, 2]. Одним из таких физиологически активных веществ является норадреналин (НА), который в перинатальном периоде развития – критический период морфогенеза, участвует в регуляции развития центральной нервной системы, сердечно-сосудистой и дыхательной систем [3].
НА синтезируется в нейронах головного мозга и симпатической нервной системы, а также в хромаффинных клетках надпочечников и параганглиев. Все эти органы в критический период морфогенеза могут быть источниками НА в общей системе циркуляции крови [4, 5]. На основании результатов, проведенных ранее исследований, мы предположили, что в перинатальном периоде развития поддержание физиологически активной концентрации НА в плазме крови осуществляется благодаря гуморальному взаимодействию между его центральными и периферическими источниками. Доказательством этого было сначала снижение, а затем восстановление уровня НА в крови после ингибирования его синтеза в мозге [6]. Кроме того, при вызванном снижении уровня НА в мозге, мы обнаружили увеличение его содержания и выделения в надпочечниках [6, 7]. Эти данные позволяют предположить, что одним из механизмов такой компенсации может быть усиление секреторной активности одних источников НА в ответ на снижение его синтеза в других. Поэтому мы решили оценить секреторную активность одних органов источников НА при экспериментально вызванном снижении секреции НА другими органами. Так, в нашей предыдущей работе было показано, что при дефиците синтеза НА в мозге повышается экспрессия генов основных ферментов синтеза НА – тирозингидроксилазы (ТГ) и дофамин-бета-гидроксилазы (ДБГ) в надпочечниках [8, 9]. Однако экспрессия генов не является показателем изменения содержания самого фермента и его активности.
Исходя из вышеизложенного, целью данного исследования было изучение роли мозга в гуморальной регуляции секреторной активности периферических органов-источников НА. Задачами работы явилось определение активности ТГ и ДБГ – прямого показателя скорости синтеза соответственно предшественника НА (L-дезоксифенилаланина – L-ДОФА) и самого НА, в надпочечниках и в мозге, на модели ингибирования синтеза НА в мозге неонатальных крыс.
Работа проведена на самцах крыс популяции Вистар на 2-й, 4-й и 5-й постнатальные дни жизни. День рождения крысят считался первым днем жизни. Крыс содержали в стандартных условиях вивария при свободном доступе к пище и воде. Все манипуляции с животными были проведены согласно протоколу, утвержденному комиссией по биоэтике Института биологии развития им. Н.К. Кольцова РАН, и находящемуся в соответствии с национальными и международными требованиями.
Для ингибирования синтеза НА в мозге крысятам на 2-й постнатальный день под изофлурановым наркозом в боковой желудочек мозга вводили 0.5 мкг анти-ДБГ-сапорина (гибридный молекулярный комплекс, состоящий из антител против ДБГ, связанных с цитотоксином сапорином). Контрольным животным в боковой желудочек мозга вводили 0.9% NaCl. Было использовано по 10 животных в контрольных и экспериментальных группах в эксперименте по определению активности ТГ и такое же количество животных по определению активности ДБГ.
Через 48 и 72 ч после внутрижелудочковых введений анти-ДБГ-сапорина или 0.9% NaCl у крыс после декапитации собирали одно полушарие мозга и оба надпочечника. На пробу приходился материал от одного животного.
Активность ТГ в исследуемых органах определяли по скорости превращении тирозина в L-ДОФА (in vitro), как было ранее описано в работе Brusco et al. [10]. Органы гомогенизировали в охлажденном 0.1 М фосфатном буфере. Далее к 100 мкл гомогената добавляли 50 мкл 3-дигидроксибензилгидразина (NSD-1015) (конечная концентрация 100 мкМ) и инкубировали 10 мин при 37°С. После инкубации реакцию останавливали на льду и в каждый образец добавляли по 10 мкл сульфата аммония (конечная концентрация 800 мкМ), 6-метил-5,6,7,8-тетрагидроптерин дигидрохлорида (конечная концентрация 800 мкМ), гидрохлорида тирозина (конечная концентрация 200 мкМ) (все реактивы – Sigma, США). Далее все пробы инкубировали 30 мин при 37°С. В качестве контроля использовали 100 мкл гомогената ткани каждого исследуемого образца. После инкубации реакцию останавливали на холоде и в каждый образец добавляли 100–500 пМ внутреннего стандарта – 3.4 гидробромида дигидроксибензиламина, после чего пробы центрифугировали при 16 500 g в течение 25 мин. Далее супернатант переносили в пробирки и определяли активность ТГ по накоплению L-ДОФА, содержание которого измеряли с помощью высокоэффективной жидкостной хроматографии с электрохимической детекцией.
Активность ДБГ определяли по скорости превращения тирамина в октопамин (in vitro) [11]. Тирамин, так же, как и дофамин является субстратом для ДБГ. Мозг и надпочечники гомогенизировали в 10 объемах 0.02 фосфатно-солевого буфера (рН 7.3) и центрифугировали при 16500 g в течение 1.5 ч. К полученному супернатанту добавляли 200 мкл 1 М натрий-ацетатного буфера (pH 5.0), 100 мкл 0.1 M N-этилмалеимида, 50 мкл 20 мкM сульфата меди, 50 мкл 0.2 М фумарата натрия, 50 мкл 0.2 M аскорбиновой кислоты (свежеприготовленный), 50 мкл 20 мM паргилина, 50 мкл водного раствора каталазы (1 мг/мл) и 50 мкл 0.4 M тирамина. В качестве контроля использовали две пробы – супернатант ткани, выдержанный в течение 5 мин при 95°С, в один из которых добавляли 4 нМ октопамина. После добавления в пробы смеси компонентов реакции, образцы инкубировали при 37°С в течение 45 мин при постоянном помешивании и доступе кислорода. Инкубация была остановлена добавлением 1/10 1Н HClO4, далее пробы центрифугировали при 200 g в течение 10 мин, переносили в колонки (0.5 × × 10 см) Dowex-50W-X4 (Sigma, США) (H', 200–400 mesh) и элюировали 3 Н NH2OH. Полученный в результате реакции октопамин измеряли на спектрофотометре при длине волны 360 нм (UNICO, США).
Полученные данные обрабатывали статистически с помощью программы GraphPad Prism 6, используя критерий Манна–Уитни.
В наших предыдущих исследованиях было показано, что в раннем постнатальном периоде между центральными и периферическими источниками НА существует гуморальное взаимодействие. Так при снижении синтеза НА в мозге снижается его уровень в общей системе циркуляции [6]. В то же время, в надпочечниках наблюдалось увеличение уровня НА и усиление его выделения [6, 7]. Однако механизмы, за счет которых это происходит до конца не ясны.
По результатам данной работы через 48 ч после введения иммунотоксина (анти-ДБГ-сапорина) в боковой желудочек мозга активность ТГ в мозге снижается на 32%, через 72 ч возвращается к контрольному значению (рис. 1). Эти данные свидетельствуют о том, что в мозге происходит компенсаторные механизмы, направленные на усиление синтеза НА в выживших норадренергических нейронах. При этом в надпочечниках активность ТГ остается на уровне контроля как через 48, так и через 72 ч после введения иммунотоксина в мозг (рис. 1). Стоит отметить, что в обоих исследованных органах на момент снижения НА в крови (через 48 ч после введения иммунотоксина в мозг) увеличивается экспрессия гена ТГ, однако через 72 ч повышенная экспрессия гена сохраняется только в надпочечниках. При этом содержание самих ферментов остается неизменным [8]. В данном случае стоит учесть, что изменения мРНК не всегда коррелируют с активностью фермента и его количеством, регуляция активности ТГ также зависит от продолжительности и характера стимула. Так, в работе Sun et al. показано, что у крыс при хроническом системном введении никотина (14 дней), действуя через холинергические рецепторы, приводит к устойчивому увеличению мРНК, белка и активности TГ в мозговом веществе надпочечников. Однако единичная инъекция никотина вызывала лишь небольшое и кратковременное увеличение мРНК TГ, но не самого фермента [12].
Рис. 1.
Активность тирозингидроксилазы (ТГ) в мозге и надпочечниках через 48 и 72 ч после введения 0.5 мкг анти-ДБГ-сапорина в боковой желудочек мозга крыс. * p < 0.05 различия по сравнению с контролем.
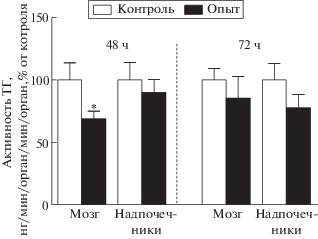
Принимая во внимание отсутствие изменения активности ТГ в надпочечниках, можно предположить, что увеличение содержания НА вероятнее всего осуществляется за счет второго важного фермента – ДБГ. Поэтому наряду с ТГ мы решили также оценить активность ДБГ. Активность ДБГ в мозге через 48 ч после введения иммунотоксина в мозг не менялась, однако, через 72 ч снижалась на 27% по сравнению с контролем (рис. 2), что является следствием дегенерации норадренергических нейронов. В надпочечниках, наоборот, при отсутствии изменений через 48 ч после введения анти-ДБГ-сапорина в мозг, через 72 ч активность ДБГ увеличилась на 17% по сравнению с контролем (рис. 2). В надпочечниках активность ДБГ через 72 ч имеет однонаправленные изменения с экспрессией гена ДБГ [9]. При этом нужно отметить, что экспрессия гена также увеличилась и через 48 ч [8]. Эти данные свидетельствуют о том, что наряду со снижением активности ДБГ в мозге, в надпочечниках, наоборот, происходит увеличение ее активности, что вероятнее всего приводит к большему накоплению и выделению НА, что мы и наблюдали в предыдущих наших экспериментах [7].
Рис. 2.
Активность дофамин-бета-гидроксилазы (ДБГ) в мозге и надпочечниках через 48 и 72 ч после введения 0.5 мкг анти-ДБГ-сапорина в боковой желудочек мозга крыс. * p < 0.05 различия по сравнению с контролем.
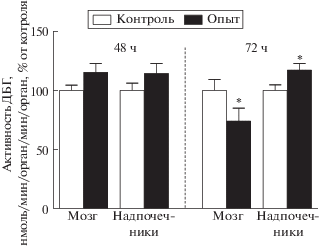
В литературе считается, что скорость-лимитирующим ферментов синтеза катехоламинов является ТГ [13]. Однако, обнаружив увеличение активности ДБГ в надпочечниках на нашей модели, мы предположили, что возможно данный фермент может принимать на себя роль скорость-лимитирующего фермента, при недостаточном уровне НА в крови. ДБГ менее изученный фермент, в отличие от ТГ, поэтому в литературе мало информации о его регуляции. Известно, что некоторые транскрипционные факторы могут принимать участие в ее регуляции. Так, транскрипционный фактор Egr1 может играть ингибирующую роль в регуляции транскрипции гена ДБГ [14]. Также существуют предположения, что в условиях, которые увеличивают активность норадренергических нейронов, увеличивается не только активность TГ, но также и активности ДБГ, которая фактически становится скорость-лимитирующим ферментом синтеза НА [15]. Поскольку ДБГ не обнаруживается в цитозоле, но локализуется в везикуле, при активации норадренергических нейронов происходит насыщение ДБГ, что приводит к большему накоплению дофамина в везикулах. Деполяризация может вызывать высвобождение дофамина, а также НА при насыщении ДБГ [13]. Увеличение активности ДБГ в надпочечниках, которое мы обнаружили на нашей модели, может свидетельствовать о том, что на уровне ДБГ может также происходить регуляция синтеза НА. Однако для получения прямых доказательств необходимо провести дополнительные исследования.
Таким образом, в проведенном исследовании показано, что при ингибировании синтеза НА в мозге неонатальных крыс происходит компенсаторное увеличение активности ДБГ в надпочечниках, что, вероятно, и приводит к повышению уровня НА в крови до нормы.
Список литературы
Lauder J.M. Neurotransmitters as growth regulatory signals: role of receptors and second messengers // Trends Neurosci. 1993. V. 16. № 6. P. 233–240.
Nguyen L., Rigo J.M., Rocher V., et al. Neurotransmitters as early signals for central nervous system development // Cell. Tissue Res. 2001. V. 305. P. 187–202.
Hildreth V., Anderson R.H., Henderson D.J. Autonomic innervation of the developing heart: origins and function // Clinical Anatomy: The Official Journal of the American Association of Clinical Anatomists and the British Association of Clinical Anatomists. 2009. V. 22. № 1. P. 36–46.
Moore R.Y., Bloom F.E. Central catecholamine neuron systems: anatomy and physiology of the norepinephrine and epinephrine systems // Annual review of neuroscience. 1979. V. 2. № 21. P. 113–168.
Huber K., Kalcheim C., Unsicker K. The development of the chromaffin cell lineage from the neural crest // Autonomic Neuroscience. 2009. V. 151. № 1. P. 10–16.
Никишина Ю.О., Муртазина А.Р., Сапронова А.Я. и др. Взаимная гуморальная регуляция эндокринных источников норадреналина в перинатальном периоде развития у крыс // Онтогенез. 2016. Т. 47. № 5. С. 287–295
Бондаренко Н.С., Дильмухаметова Л.К., Курина А.Ю. и др. Пластичность центральных и периферических источников норадреналина в онтогенезе у крыс // Биохимия. 2017. Т. 82. № 3. С. 519–527.
Муртазина А.Р., Дильмухаметова Л.К., Никиши-на Ю.О. и др. Изменение секреторной активности органов, продуцирующих норадреналин, при ингибировании его синтеза в мозге неонатальных крыс // Онтогенез. 2017. Т. 48. № 5. С. 345–351.
Муртазина А.Р., Никишина Ю.О., Дильмухамето- ва Л.К. и др. Роль мозга в регуляции периферических норадреналин-продуцирующих органов в период морфогенеза у крыс // ДАН. 2019. Т. 486. № 6. С. 748–752.
Brusco L.I. García-Bonacho M., Esquifino A.I., et al. Diurnal rhythms in norepinephrine and acetylcholine synthesis of sympathetic ganglia, heart and adrenals of aging rats: effect of melatonin // Journal of the autonomic nervous system. 1998. V. 74. № 1. P. 49–61.
Kato T., Kuzuya H., Nagatsu T. A simple and sensitive assay for dopamine-β-hydroxylase activity by dual-wavelength spectrophotometry // Biochemical medicine. 1974. V. 10. № 4. P. 320–328.
Sun B., Sterling C.R., Tank A.W. Chronic nicotine treatment leads to sustained stimulation of tyrosine hydroxylase gene transcription rate in rat adrenal medulla // Journal of Pharmacology and Experimental Therapeutics. 2003. V. 304. № 2. P. 575–588.
Fillenz M. Regulation of catecholamine synthesis: multiple mechanisms and their significance // Neurochemistry international. 1990. V. 17. № 2. P. 303–320.
Cheng S.Y., Serova L.I., Glazkova D., et al. Regulation of rat dopamine β-hydroxylase gene transcription by early growth response gene 1 (Egr1) // Brain research. 2008. V. 1193. P. 1–11.
Scatton B., Dennis T., Curet O. Increase in dopamine and DOPAC levels in noradrenergic terminals after electrical stimulation of the ascending noradrenergic pathways // Brain research. 1984. V. 298. № 1. P. 193–196.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


