Доклады Российской академии наук. Науки о жизни, 2020, T. 494, № 1, стр. 444-447
Внутриклеточный транспорт рибосом-инактивирующих белков зависит от аннексина 13
Д. В. Мальцева 1, 2, 3, *, М. П. Райгородская 2, В. Г. Згода 4, Е. А. Тоневицкий 5, Е. Н. Князев 1, **
1 Федеральное государственное бюджетное
учреждение науки Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
2 Научно-технический центр “БиоКлиникум”
Москва, Россия
3 Факультет биологии и биотехнологии, Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
4 Федеральное государственное бюджетное научное учреждение “Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича”
Москва, Россия
5 Фонд развития инновационного научно-технологического центра “Долина Менделеева”
Москва, Россия
* E-mail: dmaltseva@gmail.com
** E-mail: knyazevevg@gmail.com
Поступила в редакцию 19.03.2020
После доработки 06.04.2020
Принята к публикации 06.04.2020
Аннотация
В настоящей работе исследовалась роль мембраносвязывающего белка аннексина 13 (ANXA13) во внутриклеточном транспорте везикул, содержащих рибосом-инактивирующие белки второго типа (РИБ-II) – рицин и вискумин. Была использована модифицированная клеточная линия эпителия кишечника человека НТ29, в которой экспрессия ANXA13 была значительно снижена. Цитотоксическое действие рицина и вискумина оценивали по модификации 28S РНК рибосом. Обнаруженные различие в активности токсинов на исходной и модифицированной линиях НТ29 указывают на то, что ANXA13 играет разную роль во внутриклеточном транспорте везикул, содержащих исследуемые РИБ-II.
Эндоцитоз, механизм везикулярного транспорта различных молекул от плазматической мембраны эукариотических клеток в цитоплазму, участвует в широком спектре физиологических процессов [1]. В эукариотических клетках описано несколько различных путей эндоцитоза. Однако, несмотря на многолетнее изучение, множество деталей этого процесса остаются не выясненными [1]. Рибосом-инактивирующие белки второго типа (РИБ-II) являются классическим инструментом для выявления новых и более глубокого понимания уже известных путей внутриклеточного транспорта [1, 2]. К числу широко используемых РИБ-II относятся рицин и вискумин, которые обладают одинаковым механизмом действия и являются структурными гомологами [2–4], но цитотоксическая активность их значительно различается [5–8]. Оба белка состоят из двух цепей каталитической (А-цепи) и связывающей (В-цепи), соединенных дисульфидной связью. В-цепь связывается с гликозилированными белками и липидами, содержащими концевой остаток галактозы, на поверхности клетки. Часть связавшихся с мембраной молекул РИБ-II подвергается эндоцитозу в составе мембранных везикул и последующему ретроградному транспорту в эндоплазматический ретикулум, где происходит восстановление дисульфидной связи и транслокация А-цепи в цитоплазму. А-цепь является N-гликозидазой и необратимо модифицирует 28S РНК рибосом, что приводит к остановке белкового синтеза. Важной особенность работы с РИБ-II является возможность количественной оценки доли инактивированных в клетке рибосом с помощью ПРЦ-РВ [5].
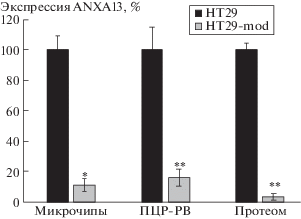
Целью настоящего исследования было оценить роль аннексина 13 (ANXA13) во внутриклеточном транспорте везикул, содержащих рицин и вискумин. ANXA13 принадлежит к семейству мембраносвязывающих белков аннексинов, которые принимают участие в везикулярном внутриклеточном транспорте и является специфическим маркером клеток эпителия кишечника [9]. Недавно с помощью стабильного нокдауна гена белка внеклеточного матрикса α5 цепи ламининов нами была получена модификация клеточной линии колоректальной аденокарциномы НТ29 (HT29-mod) [10], в которой наблюдалось сниженная экспрессия ANXA13 как на уровне мРНК (в 9.3 и в 6.3 раза по данным микрочипов и ПЦР-РВ, соответственно), так и на уровне белка (в 30.6 раза) (рис. 1). Анализ экспрессии генов c помощью микрочипов проводили также, как описано в [11], с помощью ПЦР-РВ – как описано в [12], анализ протеома – как описано в [10].
Рис. 1.
Сравнение экспрессии ANXA13 в клеточных линиях HT29 и HT29-mod по данным микрочипов, ПЦР-РВ и протеома. * p < 0.05; ** p < 0.01.
Клетки обрабатывались рицином или вискумином в течение 1 ч. Затем проводилась замена культуральной среды на свежую, не содержащую РИБ-II. Оценку доли инактивированных рибосом проводили через 1 ч после замены среды с помощью ПРЦ-РВ по методу, разработанному нами ранее [5]. Приведем основные моменты, лежащие в основе этого метода: 1) А-цепь РИБ-II гидролизует N-гликозидную связь аденозина в положении A4324 α-сарцин-рициновой петли 28S рРНК, формирую АР-сайт; 2) обратная транскриптаза в процессе синтеза кДНК встраивает напротив АР-сайт аденин, в результате чего в последовательности происходит замена тимина на аденин; 3) используя специфические праймеры, 3'-конец которых комплементарен либо исходной либо модифицированной последовательности, можно детектировать накопление сигнала модифицированных 28S рРНК; 4) для нормирования используется сигнал накопления фрагмента 28S рРНК, удаленного от места модификации. Полученные результаты показали, что в клетках линии НТ29-mod при обработке вискумином для всех используемых концентраций через 2 ч детектировалось в 3–3.5 раза больше инактивированных рибосом по сравнению с исходной линией (табл. 1). Однако, при обработке клеток рицином доля инактивированных рибосом в клетках линии HT29-mod была, наоборот, ниже, как минимум в 3.6 раза, чем в исходной линии НТ29.
Таблица 1.
Инактивация рибосом вискумином и рицином в клетках HT29 и HT29-mod
| РИБ, М | Доля инактивированных рибосом, %* | |
|---|---|---|
| HT29 | HT29-mod | |
| Вискумин | ||
| 1 × 10–9 | <0.001 | 0.002 |
| 1 × 10–8 | 0.02 | 0.07 |
| 1 × 10–7 | 0.4 | 1.2 |
| Рицин | ||
| 1 × 10–9 | 0.8 | 0.07 |
| 1 × 10–8 | 6.1 | 1.1 |
| 1 × 10–7 | 30 | 8.4 |
Одна из известных функций ANXA13 в клетках эпителия кишечника – участие в антероградном транспорте везикул от аппарата Гольджи к плазматической мембране. Полученные результаты свидетельствуют о том, что снижение экспрессии ANXA13 оказывает разнонаправленное влияние на действие вискумина и рицина. ANXA13 обладает предпочтением для связывания с участками мембраны обогащенными сфинголипидами и холестерином [9], это может определять специфичность транспорта внутриклеточных везикул, содержащих исследуемые РИБ-II [6, 13]. Аннексины, связываясь с мембраной, задают радиус кривизны образующихся везикул [9], что влияет на скорость их транспорта в цитоплазме [14]. Снижение экспрессии ANXA13 приводит к увеличению размера образующихся везикул и замедлению их транспорта. В случае вискумина, это приводит к снижению антероградного транспорта везикул и увеличению доли молекул токсина, достигших ЭПР и цитоплазмы.
В случае рицина ANXA13, по-видимому, играет минорную роль, в антероградном транспорте везикул, содержащих токсин, однако, может принимать участие в ретроградном транспорте. Изменение размера везикул, содержащих рицин, приводит к уменьшению долю молекул токсина, достигших ЭПР и цитоплазмы. Важно указать, что по данным протеома в клетках НТ29-mod также снижается экспрессия таких белков, вовлеченных в процесс внутриклеточного транспорта, как Rab1a, Rab21 и TMED2 (в 5.6, 4.4 и 11.5 раза соответственно). Нокдаун генов этих белков приводит к снижению чувствительности клеток к действию рицина [15]. Нами впервые показано, что в случае вискумина изменение экспрессии этих белков, по-видимому, играет минорную роль в транспорте везикул, содержащих токсин.
Обобщая полученные данные, можно сделать вывод, что антероградный транспорт вискумина и рицина различается. Влияние ANXA13 на транспорт мембранных везикул связано как с его структурными (размер везикул), так и рецепторными свойствами (сортировка везикул). Снижение экспрессии ANXA13, по-видимому, замедляет антероградный транспорт везикул, содержащих вискумин, что и определяет увеличение доли инактивированных в клетках рибосом. В случае рицина, роль ANXA13 в антероградном транспорте представляется минорной. Участие ANXA13 в ретроградном транспорте везикул, содержащих рицин, требует дополнительных исследований. Нельзя также исключать, что снижение экспрессии ANXA13 приводит к компенсаторной активации альтернативного пути внутриклеточного транспорта везикул, который оказывается более специфичным для везикул, содержащих вискумин.
Список литературы
Sandvig K., Kavaliauskiene S., Skotland T. // Histochem. Cell Biol. 2018. V. 150. № 2. P. 107–118.
Sandvig K., van Deurs B. // EMBO J. 2000. V. 19. № 22. P. 5943–5950.
Tonevitsky A.G., Agapov I.I., Shamshiev A.T., et al. // FEBS Lett. 1996. V. 392. № 2. P. 166–168.
Agapov I.I., Tonevitsky A.G., Moysenovich M.M., et al. // FEBS Lett. 1999. V. 452. № 3. P. 211–214.
Nikulin S.V., Mnafki N.A., Shilin S.A., et al. // Mol. Biol. 2018. V. 52. № 4. P. 583–589.
Moisenovich M., Tonevitsky A., Agapov I., et al. // Eur. J. Cell Biol. 2002. V. 81. № 10. P. 529–538.
Moisenovich M., Tonevitsky A., Maljuchenko N., et al. // Histochem. Cell Biol. 2004. V. 121. № 6. P. 429–439.
Maltseva D.V., Krainova N.A., Khaustova N.A., et al. // Bull. Exp. Biol. Med. 2017. V. 163. № 4. P. 451–455.
Gerke V., Moss S.E. // Physiol. Rev. 2002. V. 82. № 2. P. 331–371.
Maltseva D.V., Raigorodskaya M.P., Tsypina I.M., et al. // Biotekhnologiya. 2019. V. 35. № 6. P. 3–11.
Khaustova N.A., Maltseva D.V., Oliveira-Ferrer L., et al. // Biochimie. 2017. V. 142. P. 197–206.
Kudriaeva A., Galatenko V., Maltseva D., et al. // Molecules. 2017. V. 22. № 5. P. 808.
Agapov I.I., Tonevitsky A.G., Maluchenko N.V., et al. // FEBS Lett. 1999. V. 464. № 1–2. P. 63–66.
Saltzman M.W. // Drug Delivery: Engineering Principles for Drug Therapy. (Oxford University Press, 2001).
Bassik M.C., Kampmann M., Lebbink R.J., et al. // Cell. 2013. V. 152. № 4. P. 909–922.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


