Доклады Российской академии наук. Науки о жизни, 2020, T. 494, № 1, стр. 448-452
Модуляция кальций-активируемых хлорных токов в нейронах крыс новыми производными 2-аминотиофен-3-карбоновой кислоты
В. Л. Замойский 1, *, В. В. Григорьев 1, А. Ю. Аксиненко 1, член-корреспондент РАН С. О. Бачурин 1
1 Федеральное государственное бюджетное учреждение науки Институт физиологически активных веществ Российской академии наук
Московская область, г. Черноголовка, Россия
* E-mail: vzam@yandex.ru
Поступила в редакцию 10.03.2020
После доработки 19.04.2020
Принята к публикации 19.04.2020
Аннотация
Методом patch-clamp в конфигурации whole cell показано, что новые конъюгаты 2-аминотиофен- 3-карбоновой кислоты с производными адамантана в одиночных нейронах Пуркинье мозжечка крыс проявляют способность модулировать активность КАХК. Отмечено, что в зависимости от характера замещения в тиофеновом фрагменте характер влияния на КАХК меняется от эффектов ингибирования до способности потенциировать токи КАХК. Описанные соединения также являются блокаторами ифенпродильного сайта NMDA-рецептора, что может оказывать дополнительный нейропротекторный вклад в спектр биологической активности этих веществ.
Кальций-активируемые хлорные каналы (КАХК) играют важную роль в регуляции уровня мембранного потенциала нейронов, в том числе и регуляции когнитивных процессов [1]. Кроме того, существенна их роль в патогенезе ряда тяжелых заболеваний – астмы, боли, некоторых видов рака [2–5]. Эффективные модуляторы КАХК рассматриваются как перспективный класс новых терапевтических соединений для лечения этих заболеваний, а также создания новых подходов для регуляции когнитивных процессов [6]. Одним из наиболее активных блокаторов КАХК является производное 2-аминотиофенов – соединение CaCCinh-A01 [7]. Как было показано нами ранее производные 2-аминотиофен-3-карбоновой кислоты, а именно, N-аллилтиомочевины и N-бромметилтиазолины, также способны блокировать или потенцировать токи КАХК в нейронах млекопитающих [8].
Целью данной работы явилось изучение действия на токи КАХК в нейронах Пуркинье мозжечка крыс ряда оригинальных полифармакофорных соединений, представляющих собой конъюгаты 2-аминотиофен-3-карбоновой кислоты с производными адамантана, карбазола и тетрагидро-гамма-карболина, коньюгаты которых с рядом других скаффолдов показали ранее хорошие нейропротекторные свойства [9].
В результате установлено, что вновь синте-зированные соединения на основе конъюгатов 2-аминотиофен-3-карбоновой кислоты с производными адамантана проявляют способность модулировать активность КАХК. В частности, эффективность одного из новых производных превосходит активность модельного соединения CaCCinh-А01. Отмечено, что в зависимости от структуры заместителя в тиофеновом фрагменте характер влияния на КАХК меняется от эффектов ингибирования до способности потенциировать токи КАХК. Важно, что выявленные модуляторы токов КАХК являются также блокаторами ифенпродильного сайта NMDA-рецептора, что может оказывать дополнительный нейропротекторный вклад в спектр биологической активности этих веществ.
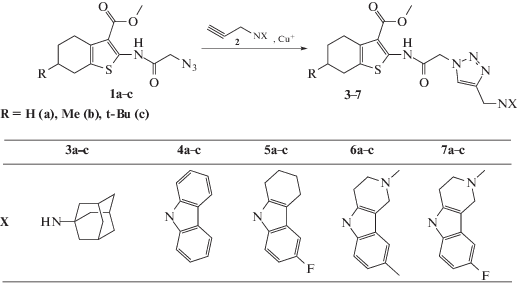
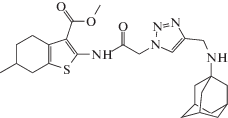
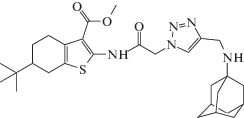
Соединения 3а–с, 4–6 (рис. 1) получены медь-катализируемой алкин-азидной “click”-реакцией N-азидоацетамидов метиловых эфиров этих кислот 1а–с с N-пропаргил-содержащими 2-аминоадамантаном, карбазолом, тетрагидрокарбазолом и гамма-карболином. Подробный синтез соединений 3а–с, 4b, 5b, 6b, влияющих на токи КАХК, а также других, представленных на схеме, описан в статье [10].
Электрофизиологические исследования осуществляли на свежевыделенных нейронах Пуркинье из мозжечка (12–15 дней) мозга крыс самцов линии Вистар (n = 20). Выделение единичных нейронов проводили ферментативно-механическим способом [11]. Трансмембранные токи отдельных нервных клеток регистрировали методом локальной фиксации потенциала (patch-clamp) в конфигурации на целой клетке (whole-cell) с помощью прибора EPC-9 (“HEKA”, Германия) [12]. Данные обрабатывали при помощи программы Pulsfit (“HEKA”, Германия).
В экспериментах при потенциале фиксации на мембране клетки –70 мВ использовали физиологический раствор, содержащий 140 mM NaCl (140 мМ NaCl, 5 мМ KCl, 2 мМ MgCl2, 2 мМ CaCl2, HEPES 10 мМ, рН 7.36, осмолярность 305 мОсм), в микропипетке – электроде – 120 mM CsCl (120 мМ CsCl, 2 мМ MgCl2, 1 мМ CaCl2, EGTA 11 мМ, HEPES 10 мМ, K2ATP 5 мМ, рН 7.2, осмолярность 285 мОсм). В ответ на нарастающие ступени деполяризующих импульсов по +10 мВ регистрировались ионные токи от целой клетки, в конце которых располагались хлорные токи.
Электрофизиологическим методом было исследовано около 20 новых производных 2-аминотиофен-3-карбоновой кислоты. Было обнаружено, что три соединения (3а, 3b и 3с) проявляют способность модулировать активность КАХК. Два соединения блокировали токи КАХК (рис. 2), причем активность соединения 3a превосходила действие модельного соединения CaCCinh-А01 (IC50 1.7 мкМ [7]), а блокирующее действие соединения 3b было лишь немного слабее (табл. 1).
Рис. 2.
Действие нового N-замещенного производного 2-аминотиофен-3-карбоновой кислоты 3a на кальций активируемые хлорные токи в нейронах Пуркинье. (а) – токи КАХК: 1 – протокол подачи прямоугольных импульсов с шагом 10 МВ при потенциале фиксации –70 мВ до значения на мембране +20 мВ; 2 – ответы клетки в контроле; 3 – ответы клетки при действии соединения 3a в концентрации 10–5 М (блокада КАХК); 4 – отмывка действия вещества. (б) – график величины блокады переноса заряда при действии соединения 3a при различных значениях мембранного потенциала.

Таблица 1.
Влияние исследованных веществ на токи КАХК
| Вещества | Эффект | Вещества | Эффект |
|---|---|---|---|
| Структура | Блокада (IC50*)/ потенциация токов КАХК | Структура | Блокада (IC50*)/ потенциация токов КАХК |
 |
1.6 ± 0.4 мкМ (n = 7) |  |
Не действует |
| Соединение 3a | Соединение 4b | ||
 |
5.4 ± 0.5 мкМ (n = 9) |  |
Не действует |
| Соединение 3b | Соединение 5b | ||
 |
Потен-циация на 35% при 10 мкМ (n = 4) |  |
Не действует |
| Соединение 3c | Соединение 6b |
На рис. 2 видно, что амплитуда хлорных токов зависит от уровня мембранного потенциала нейрона. Активация хлорных токов наблюдается при уровнях МП от –40 мВ, а при дальнейшей деполяризации резко возрастает, приближаясь к насыщению, в диапазоне МП от –10 мВ до +20 мВ. Соответственно, и блокирующее действие соединения 3a проявляется от уровня МП –40 мВ и в диапазоне МП от –10 мВ – +20 мВ величина блока мало изменяется, находясь у значения 50% от контроля (n = 7).
Соединение 3c, напротив, обладало потенцирующим действием в отношении токов КАХК – (рис. 3).
Рис. 3.
Действие нового N-замещенного производного 2-аминотиофен-3-карбоновой кислоты 3c на кальций активируемые хлорные токи в нейронах Пуркинье. (а) – интегральные токи нейрона Пуркинье в ответ на серию деполяризующих импульсов: 1 – протокол подачи прямоугольных импульсов с шагом 10 мВ при потенциале фиксации –70 мВ до значения на мембране +20 мВ; 2 – ответ клетки в контроле; 3 – действие соединения 3c в концентрации 10–5 М на ионные токи клетки (потенциация КАХК); 4 – отмывка действия вещества. (б) – график величины зарядов, переносимых КАХК, в контроле; при действии Соединения 3c и после отмывки.

Интересно, что эти три соединения одновременно блокировали сайт связывания ифенпродила NMDA-рецептора в микромолярных концентрациях, как нами ранее было показано [10]. Замена адамантильного фрагмента на карбазольный, тетрагилрокарбазольный или тетрагидрокарболиновый фрагменты (соединения 4b, 5b, 6b) приводила к полной утрате способности влиять на КАХК-вызванные токи (табл. 1), а также на способность соединений блокировать ифенпродильный сайт связывания NMDA-рецептора [10].
Таким образом установлено, что вновь синтезированные соединения на основе конъюгатов 2-аминотиофен-3-карбоновой кислоты с производными адамантана проявляют способность модулировать активность КАХК. Отмечено, что в зависимости от структуры заместителя в тиофеновом фрагменте характер влияния на КАХК меняется от эффектов ингибирования до способности потенциировать токи КАХК. Важно, что выявленные модуляторы токов КАХК являются также блокаторами ифенпродильного сайта NMDA-рецептора, что может оказывать дополнительный нейропротекторный вклад в спектр биологической активности этих веществ.
Список литературы
Huang W.C., Xiao S., Huang F., Harfe B.D. et al. // Neuron. 2012. V. 12. № 74 (1). P. 179–192.
Sondo E., Caci E., Galietta L.J. // Int. J. Biochem. Cell Biol. 2014. V. 52. P. 73–76. https://doi.org/10.1016/j.biocel.2014.03.022
Kunzelmann K., Ousingsawat J., Cabrita I., Doušová T., Bähr A., Janda M., Schreiber R., Benedetto R. // Front Pharmacol. 2019. V. 10. P. 3. doi: . eCollection 2019.https://doi.org/10.3389/fphar.2019.00003
Crottès D., Jan L.Y. // Cell Calcium. 2019. V. 82. P. 102050. Epub 2019 Jun 14.https://doi.org/10.1016/j.ceca.2019.06.004
Salzer I., Boehm S. // Int. J. Biochem. Cell Biol. 2019. V. 111. P. 37–41. https://doi.org/10.1016/j.biocel.2019.04.006
Yu Jiang, Bo Yu, Hong Yang, Tonghui Ma // Frontiers in Pharmacology. 2016. https://doi.org/10.3389/fphar.2016.00270
Bradley E., Fedigan S., Webb T., Hollywood M.A., Thornbury K.D., McHale N.G., Sergeant G.P. // Channels. Austin. 2014. V. № 4. P. 308–320.
Григорьев В.В., Замойский В.Л., Аксиненко А.В., Соколов В.Б., Бачурин С.О. // ДАН. 2018. Т. 483. № 1. С. 94–97.
Bachurin S.O., Shevtsova E.F., Makhaeva G.F., Grigoriev V.V., et al. // Sci Rep. 2017. V. 7. P. 45627. https://doi.org/10.1038/srep45627
Соколов В.Б., Аксиненко А.Ю., Горева Т.В., Епишина Т.А., Габрельян А.В., Григорьев В.В. // Журнал общей химии. 2020. Т. 90. № 1. С. 42–49.
Kaneda M., Nakamura H., Akaike N. // Neurosci. Res. 1988. V. 5. P. 299–315.
Hamill O.P., Marty A., Neher E., Sakmann B., Sig-worth F.J. // Pflugers Arch. 1981. V. 391. P. 85–100.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни