Доклады Российской академии наук. Науки о жизни, 2020, T. 494, № 1, стр. 453-457
Наноразмерные антистоксовые фосфоры для доставки противоопухолевых препаратов и тераностики солидных опухолей
Р. А. Акасов 1, 2, 3, *, П. А. Демина 1, 3, В. В. Заседателева 1, Н. В. Шолина 2, 3, Д. А. Хоченков 4, 6, А. Н. Генералова 1, 3, Дж. Сентилселван 5, Е. В. Хайдуков 3, академик РАН В. Я. Панченко 3
1 ФГБУН Институт биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук,
Москва, Россия
2 ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России
Москва, Россия
3 ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
4 ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России
Москва, Россия
5 Факультет ядерной физики, Университет Мадраса
Мадрас, Индия
6 ФГБОУ ВО “Тольяттинский государственный университет”
Тольятти, Россия
* E-mail: roman.akasov@gmail.com
Поступила в редакцию 10.04.2020
После доработки 30.04.2020
Принята к публикации 30.04.2020
Аннотация
Тераностика – область современной биомедицины, направленная на разработку препаратов, сочетающих возможности диагностики и терапии опухолей в одном агенте. Апконвертирующие нанофосфоры (НАФ) могут быть использованы для создания наноплатформы, обеспечивающей диагностическую и терапевтическую модальности. Они применяются в качестве люминесцентных маркеров в оптической визуализации биологической ткани благодаря способности к антистоксовой люминесценции, отсутствию фотодеградации и низкой токсичности. В данной статье предлагаются НАФ для оптической визуализации и доставки противоопухолевых препаратов. Для этого поверхность НАФ со структурой ядро/оболочка NaYF4:Yb3+Tm3+/NaYF4 была модифицирована полилактидом в присутствии различных стабилизаторов (декстран, поливиниловый спирт, поли-N-винилпирролидон) для получения биосовместимых нанокомплексов. Для придания терапевтической модальности в полимерную оболочку нанокомплекса был загружен противоопухолевый антибиотик доксорубицин. Эффективность загрузки составляла до 0.1 мг на 1 мг частиц и зависела от используемого стабилизатора. Была оценена токсичность нанокомплексов in vitro, а также оценено накопление в клетках. Был сделан вывод, что модификация НАФ полилактидом обеспечивает транспорт доксорубицина, позволяя сочетать диагностическую и терапевтическую модальность в одном агенте.
ВВЕДЕНИЕ
В настоящее время разработка наносистем для тераностики опухолей является одной из наиболее быстро развивающихся областей биомедицины. При этом наиболее перспективными являются мультимодальные системы, которые могут быть платформой для различных способов визуализации – например, для магнитно-резонансной томографии (МРТ), компьютерной томографии (КТ) или позитронно-эмиссионной томографии (ПЭТ)/однофотонной эмиссионной компьютерной томографии (SPECT) [1]. К числу таких мультимодальных платформ относятся апконвертирующие нанофосфоры, преимущества которых при использовании в качестве агента для тераностики активно обсуждаются в последние несколько лет [2–4].
В данной работе предлагаются НАФ, загруженные противоопухолевыми препаратами, в качестве агентов для тераностики солидных опухолей. Благодаря своей способности к антистоксовой люминесценции, НАФ хорошо подходят для использования в качестве биомаркеров при оптической визуализации патологий в глубине биологической ткани. В отличие от квантовых точек, НАФ менее токсичны и имеют стабильную узкополосную эмиссию при возбуждении в ближнем инфракрасном диапазоне. Ранее НАФ уже использовали для доставки различных противоопухолевых агентов, в том числе доксорубицина [5], куркумина [6] и цисплатина [7]. Однако, важным остается вопрос о роли функционализированной поверхности НАФ, которая должна способствовать накоплению препарата в опухолях и его контролируемому высвобождению [8]. В данной работе в качестве биодеградируемого биосовместимого покрытия предлагается полиэфир молочной кислоты (полилактид, ПЛА), который характеризуется низкой токсичностью и отсутствием воспалительной реакции in vivo. Целью данной работы была оценка эффективности модификации поверхности НАФ со структурой ядро/оболочка NaYF4:Yb3+Tm3+/NaYF4 с помощью ПЛА в присутствии различных стабилизаторов (декстран, поливиниловый спирт, поли-N-винилпирролидон) для загрузки и контролируемого высвобождения противоопухолевых препаратов на примере противоопухолевого антибиотика доксорубицина (DOX).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
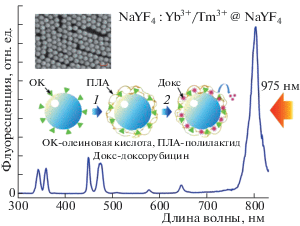
Синтез НАФ на основе матрицы NaYF4 проводили в соответствии с ранее описанным протоколом [9]. Продуктом синтеза были гидрофобные монодисперсные НАФ (75 ± 5 нм) со структурой ядро/оболочка (β-NaYF4:18% Yb3+, 0.8% Tm3+/NaYF4). Загрузка DOX проходила в две стадии. Сначала поверхность НАФ модифицировали с помощью ПЛА методом замены растворителя (НАФ диспергировали в хлороформе, смешивали с D, L-полилактидом (Мср 18000-24000), смесь озвучивали и выдерживали при перемешивании в течение часа). Затем дисперсию НАФ при перемешивании и ультразвуковой обработке по каплям добавляли к 1 мл дистиллированной воды, содержащей стабилизаторы: декстран (Д), поливиниловый спирт (ПВС) или поли-N-винилпирролидон (ПВП). Полученные НАФ-ПЛА демонстрировали высокую коллоидную стабильность в водной среде. На втором этапе к НАФ-ПЛА, полученным в присутствии стабилизаторов, добавляли ацетон и вводили водный раствор DOX на 1 ч. При этом загрузка DOX составляла 0.089, 0.086 и 0.1 мг на 1 мг частиц для НАФ-Д (101 ± 9 нм), НАФ-ПВС (92 ± 7 нм) и НАФ-ПВП (85 ± 5 нм), соответственно (в скобках приведены размеры нанокомплексов в PBS рН 7.0). Спектрофотометрический анализ при длине волны 480 нм показал отсутствие DOX в надосадочной жидкости после трех циклов очистки, а также через неделю после получения образцов. Однако DOX может высвобождаться из таких частиц in vitro и in vivo путем ферментативной деструкции ПЛА. Схема модификации НАФ и загрузки DOX показана на рис. 1.
Рис. 1.
Схема модификации НАФ в присутствии ПЛА и последующая загрузка DOX. Спектр фотолюминесценции НАФ при длине волны возбуждения 975 нм и изображение НАФ, полученное методом сканирующей электронной микроскопии (СЭМ). Масштабный отрезок – 100 нм.
Возможность внутриклеточной визуализации НАФ была продемонстрирована с использованием эпилюминесцентного апконверсионного микроскопа (рис. 2). Было показано, что НАФ могут быстро (в течение 30 мин) связываться с мембранами клеток аденокарциномы молочной железы человека SK-BR-3, при этом чувствительность метода позволяет детектировать в т.ч. сигнал одиночных НАФ, как это было показано ранее [10].
Рис. 2.
Антистоксовая фотолюминесцентная микроскопия, демонстрирующая локализацию НАФ в клетках аденокарциномы молочной железы человека SK-BR-3. Слева – люминесцентная фотография в апконверсионном канале детектирования, центр – фазовый контраст, справа – наложение двух фотографий.

Было показано, что НАФ, не загруженные противоопухолевыми препаратами, не вызывали значительной токсичности (24 ч) ни в модели опухолевых (глиома C6, U-87 MG), ни в культуре нормальных (макрофаги RAW 264.7) клеток во всем диапазоне исследованных концентраций (70–80% выживаемости при 0.2 мг/мл). При этом НАФ, загруженные DOX, демонстрировали значительную токсичность, и значения IC50 на линии клеток глиомы крысы С6 после 24 ч инкубации составляли 0.09 ± 0.02 мг/мл, 0.04 ± 0.01 мг/мл и 0.03 ± 0.01 мг/мл для НАФ-Д, НАФ-ПВС и НАФ-ПВП соответственно. Было показано, что инкубация (16 ч) клеток глиобластомы человека U-87 MG с 0.05 мг/мл НАФ, загруженных DOX, приводила к развитию апоптоза, причем процент апоптотических клеток составлял ~10%, 20% и 30% для НАФ-Д, НАФ-ПВС и НАФ-ПВП соответственно. Уровень апоптоза оценивали с помощью окрашивания клеток флуоресцентным красителем Annexin V-FITC, позволяющего оценивать уровень фосфатидилсерина на поверхности клеток, что является маркером ранней стадии апоптоза. Это коррелировало с данными по цитотоксичности для каждого из вариантов модификации НАФ. Также было показано, что частицы НАФ-ПВП, загруженные DOX, накапливались в клетках (как в опухолевых U-87 MG и C6, так и в макрофагах RAW 264.7) более активно, чем НАФ-Д или НАФ-ПВС (рис. 3). Это коррелирует с данными по цитотоксичности и развитию апоптоза в U-87 MG клетках. При этом наибольший уровень накопления НАФ был показан для клеток человеческой глиобластомы U-87 MG, а наименьший – для макрофагов RAW 264.7. Это означает, что использованные типы покрытий могут понижать нецелевой захват наночастиц макрофагами по сравнению с опухолевыми клетками, что должно усиливать накопление наночастиц в опухолях.
Рис. 3.
Верхняя панель – накопление НАФ, загруженных DOX в клетках U-87 MG, C6 и RAW 264.7, 60 мин инкубации, проточная цитометрия. Нижняя панель – накопление НАФ, загруженных DOX, в клетках С6 после 1 ч и 24 ч инкубации. Флуоресцентная микроскопия, ядра клеток показаны синим (краситель Hoechst), доксорубицин – красным.

ВЫВОДЫ
Апконвертирующие нанофосфоры были предложены в качестве носителя для доставки противоопухолевых препаратов. Был разработан способ покрытия поверхности НАФ полилактидом в сочетании с различными стабилизаторами (декстран, поливиниловый спирт, поли-N-винилпирролидон) для повышения биосовместимости НАФ. Противоопухолевый препарат доксорубицин был загружен в оболочку НАФ, противоопухолевая активность такого комплекса была оценена in vitro. Было показано, что НАФ, модифицированные ПЛА в присутствии поли-N-винилпирролидона, показали наиболее высокий уровень накопления в опухолевых клетках и, как следствие, наиболее высокую токсичность. Разработанный комплекс НАФ-ПЛА-DOX может быть предложен как агент для тераностики солидных опухолей.
Список литературы
Generalova A.N., Chichkov B.N., Khaydukov E. V. Multicomponent nanocrystals with anti-Stokes luminescence as contrast agents for modern imaging techniques // Advances in Colloid and Interface Science. 2017. V. 245. P. 1–19.
Muthu M.S., Mehata A.K., Viswanadh M.K. Upconversion nanotheranostics: Emerging designs for integration of diagnosis and therapy // Nanomedicine. 2017. V. 12. № 6. P. 577–580.
Su X. et al. CuS as a gatekeeper of mesoporous upconversion nanoparticles-based drug controlled release system for tumor-targeted multimodal imaging and synergetic chemo-thermotherapy // Nanomedicine Nanotechnology, Biol. Med. 2017. V. 13. № 5. P. 1761–1772.
Zhang Z. et al. Modularly Assembled Upconversion Nanoparticles for Orthogonally Controlled Cell Imaging and Drug Delivery // ACS Appl. Mater. Interfaces. 2020. V. 12. № 11. P. 12549–12556.
Feng L. et al. Multifunctional mesoporous ZrO 2 encapsulated upconversion nanoparticles for mild NIR light activated synergistic cancer therapy // Biomaterials. 2017. V. 147. P. 39–52.
Reddy K.L. et al. Amine-functionalized, porous silica-coated NaYF 4 :Yb/Er upconversion nanophosphors for efficient delivery of doxorubicin and curcumin // Mater. Sci. Eng. C. 2019. V. 96. P. 86–95.
Xu J. et al. Charge convertibility and near infrared photon co-enhanced cisplatin chemotherapy based on upconversion nanoplatform // Biomaterials. 2017. V. 130. P. 42–55.
Sedlmeier A., Gorris H.H. Surface modification and characterization of photon-upconverting nanoparticles for bioanalytical applications // Chemical Society Reviews. 2015. V. 44. № 6. P. 1526–1560.
Generalova A.N. et al. PEG-modified upconversion nanoparticles for in vivo optical imaging of tumors // RSC Adv. 2016. V. 6. № 36. P. 30089–30097.
Wang F. et al. Microscopic inspection and tracking of single upconversion nanoparticles in living cells // Light Sci. Appl. 2018. V. 7. № 4. P. 18007–18007.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


