Доклады Российской академии наук. Науки о жизни, 2020, T. 494, № 1, стр. 458-462
Действие низких и средних доз тонкого сканирующего пучка протонов на органы кроветворения при тотальном облучении мышей
Член-корреспондент РАН В. Е. Балакин 1, О. М. Розанова 2, *, Е. Н. Смирнова 2, Т. А. Белякова 1, **, А. Е. Шемяков 1, 2, С. И. Заичкина 2, С. С. Сорокина 2, А. Р. Дюкина 2
1 Физико-технический центр Федерального государственного бюджетного учреждения науки Физический институт им. П.Н. Лебедева Российской академии наук
Протвино, Россия
2 Федеральное государственное бюджетное учреждение науки Институт теоретической и экспериментальной биофизики Российской академии наук
Пущино, Россия
* E-mail: rozanova.iteb@gmail.com
** E-mail: belyakovata@lebedev.ru
Поступила в редакцию 27.04.2020
После доработки 08.05.2020
Принята к публикации 11.05.2020
Аннотация
Изучено действие тонкого сканирующего пучка протонов в диапазоне доз 0.1–1.5 Гр на индукцию цитогенетических повреждений в костном мозге, продукцию активных форм кислорода (АФК) в цельной крови и состояние лимфоидных органов при тотальном облучении мышей. Облучение проводилось на протонном синхротроне “Прометеус” (ФТЦ ФИАН, Протвино) в пике Брэгга с энергией протонов 90–116 МэВ. Было обнаружено, что при облучении мышей протонами с использованием технологии тонкого сканирующего пучка в диапазоне низких и средних доз величина относительной биологической эффективности излучения по критерию цитогенетических нарушений равнялась 1.15; выявлены различия в патофизиологическом действии на лимфоидные органы и индукции АФК клетками крови по сравнению с действием рентгеновского излучения.
Изучение биологической эффективности тяжелых заряженных частиц высоких энергий в области низких и средних доз является актуальным для решения проблем ядерной медицины и космической биологии, а также для понимания фундаментальных механизмов развития цито- и генотоксических эффектов. Основным преимуществом пучков протонов, как и других ускоренных частиц, на котором основано их применение в терапии опухолей, является специфика их дозового распределения: относительной низкой дозой на входе и наличием пика Брэгга – максимального энерговыделения в конце пробега частицы на заранее заданной глубине, непосредственно в опухоли, что позволяет не повреждать окружающие здоровые ткани [1]. Но наряду с возможностью точной локализации основной энергии излучения величина относительной биологической эффективности (ОБЭ) протонов ниже, чем, например, у ионов углерода, и находится в диапазоне 0.6–1.8 [1, 2]. Международной комиссией по радиационным единицам и измерениям (ICRU) для клинического применения протонов в настоящее время рекомендовано значение ОБЭ, равное 1.1 [3]. Эта величина основана на многочисленных данных, полученных при облучении in vitro культур нормальных и опухолевых клеток с помощью методов, чувствительность которых зачастую требует применения высоких доз облучения, и полученные результаты трудно интерпретировать и экстраполировать для практических задач протонной терапии (ПТ), чаще всего использующей при фракционированном облучении стандартные дозы конвенциальной радиотерапии 1.5–2 Гр. Использование методов молекулярной биологии в ряде работ по исследованию действия протонов продемонстрировало также, что часто реализация одинакового конечного биологического эффекта осуществляется за счет сложного взаимодействия многих факторов: первичных инициирующих повреждений, активации разных сигнальных путей и механизмов, способов взаимодействия частиц с живым веществом и реализаций этих событий в регистрируемый критерий [4]. Для того чтобы понять, как первичные реакции через разные сигнальные пути формируют не только клеточные, но и, что более актуально для практики, тканевые и организменные ответы, необходимы исследования, полученные при облучении животных in vivo.
В последние годы в мире и нашей стране появились центры ПТ, использующие новую технологию облучения тонким сканирующим пучком протонов, которая позволяет облучать мишени с субмиллиметровой точностью, улучшает 3D конформацию дозы и снижает вклад нейтронов. Это позволяет уменьшить интегральную лучевую нагрузку на тело пациента в сравнении с другими методами протонной и фотонной лучевой терапии, что напрямую связано с уменьшением риска осложнений и развития рецидивов [5].
Целью настоящей работы было исследование действия тонкого сканирующего протонного пучка (ТСПП) в пике Брэгга в диапазоне доз 0.1–1.5 Гр на индукцию цитогенетических повреждений в костном мозге, продукцию активных форм кислорода (АФК) в цельной крови и состояние лимфоидных органов при тотальном облучении мышей in vivo относительно рентгеновского излучения (РИ).
В работе использовали 2-месячных самцов белых нелинейных мышей популяции SHK (24–28 г), которые содержались в стандартных условиях вивария ИТЭБ РАН. Все манипуляции проводили согласно нормативно-правовым актам о порядке экспериментальной работы с использованием животных [6], а план экспериментов был одобрен Комиссией ИТЭБ РАН по биологической безопасности и биоэтике (протокол № 4 от 5.04.2018). Мышей облучали на протонном синхротроне “Прометеус” (ФТЦ ФИАН, Протвино Московской области). Анестезированные золетил-ксилазиновым наркозом мыши помещались в поле облучения с точностью позиционирования до 1 мм. Облучаемый объем тела мыши определяли по томограмме с помощью трехмерной программы планирования, в среднем он составлял 65.4 см3. Мышей облучали в пике Брэгга в диапазоне доз 0.1–1.5 Гр (число частиц 1.28 × 109–1.97 × 1010) при мощности дозы 0.1–1 Гр/мин на расстоянии 75 см от источника облучения. Энергия протонов на выходе из ускорителя в режиме тонкого сканирующего пучка составляла 90–116 МэВ. Контролировали дозу клиническим дозиметром на основе алмазного детектора (ИФТП, Россия) и дозиметрической пленкой (EBT2, США). Мышей группы положительного контроля облучали рентгеновским излучением на установке РУТ (200 кВ, 2 кэВ/мкм, 1 Гр/мин) в тех же дозах и условиях (ЦКП “Источники излучения” ИБК, Пущино). В каждом эксперименте был контроль, учитывающий транспортировку, наркотизацию и имитацию облучения животных. В каждой группе было 5–14 мышей. Через 28 ч после облучения животных выводили из эксперимента методом декапитации и производили забор органов и тканей. Время 28 ч было определено экспериментально в наших предыдущих работах для регистрации максимального уровня хромосомных повреждений в эритроцитах костного мозга с учетом длительности стадий эритропоэза и радиационной задержки клеточного цикла [7]. Критерием уровня цитогенетических повреждений служил процент полихроматофильных эритроцитов (ПХЭ) с микроядрами (МЯ) в костном мозге бедренной кости мышей. У этих же животных определяли индекс массы тимуса и селезенки, как отношение абсолютного веса органа к среднему весу животного в группе. Уровень продукции АФК в цельной крови, полученной при декапитации, мышей измеряли методом люминол-зависимой, зимозан-индуцированной хемилюминесценции (ХЛ) с помощью 12-канального прибора CHEMILUM-12. Определяли значения светоплощади под кривой при спонтанной и индуцированной ХЛ (Sсп, Sинд), а также индекс активации как отношение Sинд/Sсп. Достоверность различий между группами оценивали с помощью непараметрического критерия U Манна–Уитни. Вероятность ошибки p < 0.05 считали достаточной для вывода о статистической значимости различий.
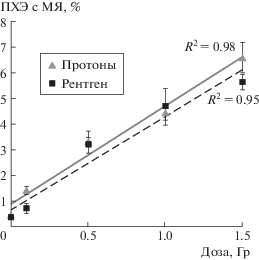
Было обнаружено (рис. 1), что уровень ПХЭ с МЯ в костном мозге при всех дозах протонного изучения был близок к РИ и коэффициент ОБЭ, вычисленный по равноэффективным дозам, равнялся 1.15. Величина ОБЭ оказалась близка к значениям, определенным в этом же диапазоне доз для протонных пучков других энергий и конфигураций, полученных на культурах клеток или другими методами [8, 9]. В большинстве работ этот коэффициент вычислен относительно гамма-излучения [5], поэтому с учетом ОБЭ рентгеновского излучения относительно гамма-излучения по критерию хромосомных нарушений, ОБЭ ТСПП может быть выше. Полученный показатель является важной характеристикой действия протонного пучка на стволовые клетки костного мозга и свидетельствует о высокой эффективности используемой технологии.
Рис. 1.
Дозовые зависимости индукции полихроматофильных эритроцитов с микроядрами в костном мозге мышей при облучении тонким сканирующим пучком протонов и рентгеновским излучением.
На рис. 2 видно, что при действии ТСПП уменьшение индекса массы тимуса начиналось уже при дозе 0.5 Гр по сравнению с РИ, при котором уменьшение массы органа происходило только при дозе 1.5 Гр. Индекс массы селезенки снижался при облучении ТСПП уже в дозе 0.1 Гр в отличие от РИ. Патофизиологическое действие протонов на лимфоидные органы при облучении мышей изучено менее детально, чем гамма- и рентгеновского излучений, и связь молекулярных механизмов с тканевыми эффектами до конца не выяснена. В работе [10] исследовали гистологическими и иммунохимическими методами тимус, селезенку и костный мозг при тотальном облучении мышей равноэквивалентными дозами гамма-излучения 1.1 и 7 Гр, а для протонов 1.0 и 6.4 Гр. Было продемонстрировано, что гамма-излучение и протоны запускают клеточную гибель в органоспецифической манере; кроме того протоны индуцируют больше повреждений ДНК, а профили экспрессии генов имеют уникальные паттерны в селезенке, но не в других органах. Индукция апоптоза также сильно варьировала в зависимости от дозы и ткани, а клеточная гибель в костном мозге была значительно ниже у облученных протонами животных.
Рис. 2.
Индексы массы тимуса (а) и селезенки (б) мышей, облученных тонким сканирующим пучком протонов в пике Брэгга и рентгеновским излучением в диапазоне доз 0.1–1.5 Гр (* – статистически значимые отличия относительно необлученного контроля; && – статистически значимые отличия относительно рентгеновского излучения (p < 0.05)).

Известно, что повышенный уровень АФК в организме является признаком окислительного стресса, который может привести к различным повреждениям. При исследовании спонтанной продукции АФК клетками крови мышей в отдаленные сроки после облучения (через 28 ч), когда регистрировались цитогенетические повреждения, не было обнаружено различий между исследуемыми видами облучения, но индекс активации у мышей, облученных протонами в дозах 0.1–1 Гр, был выше, чем при действии РИ, у которого этот показатель не отличался от необлученного контроля (рис. 3). Этот факт указывает на стимуляцию резервных возможностей нейтрофилов к генерации АФК при действии низких доз протонов, что свидетельствует о повышенном напряжении антиоксидантной системы. В работе [11] были получены похожие данные об индукции АФК в период до 24 ч после облучения в пике Брэгга протонами с энергией 250 МэВ в более высоких дозах в 1–10 Гр на культуре предшественников нервных клеток. Было показано, что уровень АФК увеличивается в 3 раза быстрее на 1 Гр дозы к 6 и 24 ч после облучения протонами по сравнению с РИ. Показано, что в ранние сроки после облучения РИ и протонами при облучении высокими дозами, регистрируются наиболее существенные различия не только в продукции АФК, но и увеличении скорости апоптоза, повышения количества двунитевых разрывов ДНК, экспрессии ключевых для радиочувствительности генов [5, 12], что запускает каскад событий, приводящих к гибели клеток, мутагенезу и канцерогенезу. Полученные нами данные указывают на участие антиоксидантной системы в формировании цитогенетических эффектов при облучении животных in vivо, начиная с очень малых доз облучения, а сохранение высокого индекса активации свидетельствует о влиянии АФК на отдаленные последствия.
Рис. 3.
Дозовая завиcимоcть индекса активации ХЛ в цельной кpови мышей при облучении тонким сканирующим пучком протонов и рентгеновским излучением (* – статистически значимые отличия относительно своего необлученного контроля; && – статистически значимые отличия относительно рентгена (p < 0.05)).

Таким образом, при тотальном облучении мышей ТСПП в пике Брэгга в диапазоне низких и средних доз была определена величина ОБЭ по критерию цитогенетических нарушений в эритроцитах костного мозга, равная 1.15; выявлены существенные различия в патофизиологическом действии на лимфоидные органы и индукцию АФК клетками крови по сравнению с действием РИ. Данные позволяют оценить дозовую нагрузку на органы и ткани системы кроветворения при облучении животных малыми и терапевтическими дозами протонов, а также демонстрируют возможности технологии ТСПП и систем планирования на первом отечественном протонном синхротроне “Прометеус”. Полученные результаты помогут оптимизировать, с учетом рассчитанного ОБЭ, планируемую дозу облучения, с большей точностью подходить к оценке поглощенных доз. Дальнейшие исследования на опухолевых моделях у животных будут способствовать развитию протонной терапии с использованием современной технологии ТСПП для разработки новых схем радиотерапии, в том числе гипофракционирования, что позволит повысить эффективность лечения и снизить риск отдаленных последствий.
Список литературы
Paganetti H., Blakely E., Carabe-Fernandez A., et al. Report of the AAPM TG-256 on the relative biological effectiveness of proton beams in radiation therapy // Medical Physics. 2019. V. 46 (3). P. 53–78.
Luhr A., Neubeck C., Krause M., et al. Relative biological effectiveness in proton beam therapy – Current knowledge and future challenges // Clinical and Translational Radiation Oncology. 2018. V. 9. P. 35–41.
Хмелевский Е.В. Лучевая терапия рака простаты: фотоны, протоны, или тяжелые ионы? // Радиационная онкология и ядерная медицина. 2013. № 1. С. 28–33.
Held K.D., Kawamura H., Kaminuma T., et al. Effects of charged particles on human tumor cells // Frontiers in Oncology. 2016. V. 6. Article 23.
Иванов А.А., Бычкова Т.М., Никитенко О.В. и др. Радиобиологические эффекты протонов // Медицинская радиология и радиационная безопасность. 2019. Т.64. № 3. С. 19–31.
Директива 2010/63/eu Eвpопейcкого парламента и Совета Eвpопейcкого союза от 22 сентября 2010 г. по охране животных, иcпользуемыx в научныx целяx. Rus-LASA “НП объединение специалистов по работе с лабораторными животными”, рабочая группа по переводам и изданию тематической литературы, CПб, 2012.
Клоков Д.Ю. Закономерности формирования радиационного адаптивного ответа в клетках костного мозга мышей in vivo // Дис. ... кандидата биологических наук: 03.00.01 / Моск. гос. ун-т им. М. В. Ломоносова. Биол. фак. Москва, 2000. С. 103
Tommansino F., Durante M. Proton Radiobiology // Cancers. 2015. 7. P. 353–381.
Calugaru V., Nauraye C., Noel G., Giocanti, N., et al. Radiobiological characterization of two therapeutic proton beams with different initial energy spectra used at the Institut Curie Proton Therapy Center in Orsay // Int. J. Radiat. Oncol. Biol. Phys. 2011. V. 81 (4). P. 1136–1143.
Finnberg N., Wambi C., Ware JH., et al. Gamma-radiation (GR) triggers a unique gene expression profile associated with cell death compared to proton radiation (PR) in mice in vivo // Cancer Biology & Therapy. 2008. V. 7 (12). P. 2023–2033.
Giedzinski E., Rola R., Fike JR. et al. Efficient production of reactive oxygen species in neural precursor cells after exposure to 250 MeV protons // Radiation Research. 2005. V. 164 (4). P. 540–544.
Naranga H., Kumara A., Bhat N., et al. Effect of proton and gamma irradiation on human lung carcinoma cells: Gene expression, cell cycle, cell death, epithelial–mesenchymal transition and cancer-stem cell trait as biological end points // Mutation Research. 2015. V. 780. P. 35–46.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


