Доклады Российской академии наук. Науки о жизни, 2020, T. 494, № 1, стр. 532-536
Повышенное содержание белка ядрышка SURF6 В активированных лимфоцитах доноров и в лимфоцитах больных лимфопролиферативными заболеваниями
А. А. Моралева 1, М. В. Малышева 1, С. В. Хайдуков 1, О. В. Зацепина 1, *
1 Федеральное государственное бюджетное
учреждение науки Институт биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
* E-mail: zatsepina_olga@mail.ru
Поступила в редакцию 16.06.2020
После доработки 29.06.2020
Принята к публикации 29.06.2020
Аннотация
Пролиферация клеток млекопитающих обычно сопровождается повышением содержания ядрышковых белков, что позволяет рассматривать такие белки в качестве потенциальных активационных маркеров. Для экспериментальной проверки этого предположения мы изучили экспрессию ядрышкового фактора процессинга рРНК SURF6 в нормальных (покоящихся) лимфоцитах периферической крови доноров, лимфоцитах, активированных к пролиферации in vitro, а также в образцах крови больных лимфопролиферативными заболеваниями (ЛПЗ). Двумя методами – иммунофлуоресценцией и на иммуноблотах – мы впервые показали, что белок SURF6 не выявляется в нормальных лимфоцитах, но регулярно обнаруживается в лимфоцитах после ФГА-активации и при ЛПЗ. Уровень экспрессии SURF6 у больных коррелировал с агрессивностью заболевания, определяемой по содержанию Ki-67-позитивных лимфоцитов. Эти результаты позволяют рассматривать ядрышковый белок SURF6 в качестве возможного активационного маркера лимфоцитов при заболеваниях системы крови.
Ядрышко является ключевой клеточной органеллой, служащей для образования рибосом. Как правило, в опухолевых клетках ядрышки обладают повышенной функциональной активностью, которая позволяет обеспечить более высокие потребности пролиферирующих клеток в синтезе белка. Хорошо известно, что активация ядрышек сопровождается увеличением их размеров и содержания в них белков [1, 2]. Эти фенотипические особенности ядрышек используются в клинической практике для оценки пролиферативного потенциала злокачественно трансформированных клеток [3]. На сегодняшний день основным маркером пролиферации клеток человека является ядрышковый белок Кi-67, известные функции которого связаны с биогенезом рибосом и организацией хроматина и который, по не выясненным пока причинам, в основном маркирует клетки на стадии репликации ДНК, т.е., в S-фазе клеточного цикла [4]. Однако развитие персонифицированной медицины и необходимость более точной диагностики опухолей разной этиологии требуют поиска дополнительных активационных маркеров опухолевых клеток. В онкогематологии в качестве таких маркеров были предложены ядрышковые белки NPM1 (В23, нуклеофозмин) и нуклеолин (С23). Однако в отличие от Ki-67, эти белки присутствуют в ядрышках не только опухолевых, но и многих нормальных клеток, что затрудняет оценку пула патологических лимфоцитов традиционными методами микроскопического анализа [5, 6].
Белок SURF6 млекопитающих – это жизненно необходимый ядрышковый фактор процессинга рРНК, повышенное содержание которого активирует клеточную пролиферацию [7–9]. Интересно, что дрожжевой гомолог SURF6, белок Rrp14, помимо участия в биогенезе рибосом влияет на способность дрожжевых клеток к делению, хотя молекулярные механизмы этого влияния остаются невыясненными [10, 11]. Неупорядоченная первичная структура и высокий позитивный заряд молекулы SURF6 способствуют его взаимодействию с NPM1, что, по мнению некоторых авторов, является ключевым условием формирования и функционирования ядрышка и его отдельных субдоментов [12, 13]. Поэтому можно ожидать, что содержание SURF6 будет изменяться при активации, бласттрансформации и дедифференцировке клеток. С целью проверки этого предположения, мы изучили содержания SURF6 на иммуноцитохимическом уровне и иммуноблотах с использованием двух специфических антител [14, 15] в лимфоцитах человека разных типов: нормальных, или покоящихся, активированных к пролиферации фитогемагглютинином (ФГА) in vitro, и нативных лимфоцитах, полученных от больных лимфопролиферативными заболеваниями (ЛПЗ). Полученные результаты впервые показали, что при определенных условиях белок ядрышка SURF6 не выявляется в нормальных лимфоцитах, но обнаруживается в активированных лимфоцитах, а также в лимфоцитах больных ЛПЗ, т.е. может служить новым активационным маркером лимфоцитов.
Лимфоциты выделяли из периферической крови по стандартной методике. Их активацию ФГА, иммуноцитохимическое окрашивание и проточную цитофлуориметрию производили, как описано нами ранее [5, 7, 9]. При постановке иммуноблотов на каждую дорожку наносили лизаты из примерно 5 × 105 клеток в стандартном буфере Лэммли. После переноса белков на нитроцеллюлозную мембрану (диаметр пор 0.22 мкм), ее инкубировали с поликлональными кроличьими [14] или моноклональными мышиными [15] антителами к SURF6 человека. Контролем нагрузки (loading control) служили моноклональные мышиные антителами к актину (“Merck”, Германия; каталожный номер MAB1501R). Мембрану инкубировали с антителами к иммуноглобулинам кролика или мыши, конъюгированными с пероксидазой хрена (“Merck”; каталожный номер AC111P). Во всех экспериментах антитела разводили в буфере TBS-T (20 мM Трис-HCl, 150 мM NaCl, 0.05% Твин-20, pH 7.6) до одинаковых рабочих концентраций; окрашивание длилось 1 ч при комнатной температуре. Места связывания антител выявляли с помощью набора Pierce ECL Western Blotting Substrate (“Thermo Fisher Scintific”, США, каталожный номер 32209) и рентгеновской пленки HyperFilm ECL (“Amersham Pharmacia Biotech”, Великобритания, GE28-9068-37), следуя рекомендациям производителя. Окраску на Ki-67 производили согласно [2]. Иммортализованные клетки Т-лимфобластной лейкемии человека линии Jurkat выращивали, следуя рекомендациям поставщика (“БиолоТ”, Санкт-Петербург), и использовали в качестве контроля. Всего нами были изучены нативные лимфоциты, полученные от восьми практически здоровых доноров и пяти больных ЛПЗ, образцы которых были предоставлены ФГБУ “НМИЦ гематологии” Минздрава России.
На рис. 1а, б представлены типичные варианты иммуноцитохимического окрашивания лимфоцитов периферической крови доноров антителами к SURF6 [15] до активации (а) и через 48 ч после активации ФГА (б). На рис. 1в показана окраска антителом к SURF6 [14] лимфоцитов больного с диагнозом мантийная зона селезенки. Видно, что антитела не окрашивают ядрышки в покоящихся лимфоцитах (а), но отчетливо метят ядрышки в активированных лимфоцитах (б), а также в лимфоцитах больного ЛПЗ (в). Более того, использованные антитела метили ядрышки лимфоцитов в образцах периферической крови всех онкобольных, случайным образом отобранных для анализа. Однако в зависимости от диагноза число SURF6-позитивных лимфоцитов у пациентов варьировало от 10% до 60% (табл. 1). Из таблицы также видно, что у всех больных число SURF6-позитивных лимфоцитов превышает число Ki-67-позитивных лимфоцитов, хотя между этими двумя параметрами наблюдается прямая корреляция. Эти наблюдения свидетельствуют в пользу того, что число SURF6-позитивных лимфоцитов у больных ЛПЗ отражает агрессивность течения заболевания, традиционно определяемую по числу Ki-67-позитивных лимфоцитов.
Рис. 1.
Иммуноцитохимическое окрашивание антителами к SURF6 лимфоцитов периферической крови донора до активации (а), лимфоцитов донора через 48 ч после активации ФГА (б) и лимфоцитов больного ЛПЗ с диагнозом лимфома майтийной зоны селезенки (в). Стрелками указаны ядрышки. Масштабная линия – 20 мкм.

Таблица 1.
Среднее число SURF6- и Ki-67-позитивных лимфоцитов (в %) в периферической крови доноров до ФГА-активации (0 ч), через 48 ч после ФГА-активации (48 ч), а также у больных разными формами ЛПЗ, n – число доноров.
| Происхождение лимфоцитов | SURF6 | Ki-67 |
|---|---|---|
| Доноры, 0 ч (n = 8) | <3 | <1 |
| Нормальные ФГА-активированные лимфоциты (48 ч) (n = 8) | 53 | 35 |
| Хронический лимфолейкоз, начальная стадия | 18 | 2 |
| Волосатоклеточный лейкоз | 10 | 3 |
| Лимфома маргинальной зоны селезенки | 23 | 3 |
| Хронический лимфолейкоз, прогрессирующая стадия | 52 | 7 |
| Лимфома мантийной зоны селезенки | 60 | 13 |
Сходные результаты были получены при анализе содержаний SURF6 на иммуноблотах (рис. 2). На рисунке 2 видно, что в идентичных условиях SURF6 не выявляется в нормальных лимфоцитах (дорожка 0 ч), но прекрасно виден в клетках Jurkat, активированных лимфоцитах (дорожка 48 ч), а также в лимфоцитах больных ЛПЗ (дорожки 1–5).
Рис. 2.
Содержание белка SURF6 на иммуноблотах лимфоцитов периферической крови донора до активации (дорожка 0 ч), лимфоцитов донора через 48 ч после активации ФГА (дорожка 48 ч) и лимфоцитов больных ЛПЗ (дорожки 1–5), где 1 – лимфома мантийной зоны селезенки, 2 – хронический лимфолейкоз на начальной стадии, 3 – волосатоклеточный лейкоз, 4 – хронический лимфолейкоз на прогрессирующей стадии, 5 – лимфома маргинальной зоны селезенки. На крайней дорожке слева показано положение SURF6 клетках линии Jurkat. Актин использовали в качестве контроля нагрузки. На все дорожки нанесены лизаты из примерно 5×105 лимфоцитов.
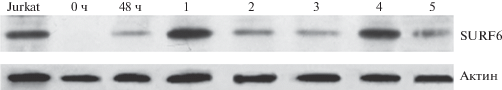
Также, как и при иммуноцитохимическом окрашивании, на иммуноблотах содержание SURF6 у больных коррелировало с числом Ki-67 позитивных лимфоцитов (рис. 2). При визуальной оценке, наиболее высокое содержание SURF6 наблюдалось в лимфоцитах больного лимфомой мантийной зоны селезенки (дорожка 1; 13% Ki-67+ лимфоцитов) и более низкое – при хроническом лимфолейкозе (дорожка 2; 2% Ki-67+ лимфоцитов). Следует подчеркнуть, что окрашивание образцов разными антителами к SURF6 [14, 15] приводило к одинаковым результатам – в лизатах нормальных лимфоцитов SURF6 не выявлялся, а в лизатах лимфоцитов больных или активированных лимфоцитов его визуализация не представляла труда.
Таким образом, двумя методами – иммунофлуоресценцией и на иммуноблотах и с использованием двух специфических антител мы показали, что проявление SURF6 в ядрышках является признаком бластной трансформации лимфоцитов. Существенным преимуществом SURF6 перед другими ядрышковым белками – потенциальными активационными маркерами лимфоцитов человека [5], является его более низкий уровень экспрессии в нормальных клетках, что облегчает идентификацию патологических, т.е. SURF6-позитивных, лимфоцитов в образцах пациентов с ЛПЗ. Выявление SURF6 в сыворотке крови может быть использовано для ранней (дооперационной) диагностики онкологических заболеваний, особенно при труднодоступности опухоли или отсутствии ее клинических проявлений.
В дополнительные материалы включены два рисунка (рис. 3 и рис. 4).
Рис. 3.
Факс-анализ распределения нормальных лимфоцитов по основным фазам клеточного цикла (G0, G0/G1, S и G2/M) до активации (а) и через 48 ч после активации ФГА (б); (в) – график, отображающий число лимфоцитов в S-фазе на разные сроки ФГА-активации. На (а, б) вертикальные оси – число клеток, горизонтальные оси – содержание ДНК, где n – гаплоидное содержание ДНК. На (в) вертикальная ось – число клеток в S-периоде (в %), горизонтальная ось – время после ФГА-активации (в часах). Указаны средние значения и стандартные ошибки определения средних значений

Рис. 4.
Содержание белка SURF6 на иммуноблотах в лимфоцитах четырех доноров до ФГА-активации (дорожки 0 ч), через 48 часов после ФГА-активации (дорожки 48 ч). На крайней дорожке справа показано положение SURF6 клетках линии Jurkat. Актин использовали в качестве контроля нагрузки. На все дорожки нанесены лизаты из примерно 5×105 лимфоцитов. Блот проявлен моноклональными антителами к SURF6 человека [15].

Рис. 3 характеризует распределение донорских лимфоцитов по основным фазам клеточного цикла в контроле (без активации) и после активации ФГА.
На рис. 4 показаны иммуноблоты лимфоцитов четырех доноров до и через 48 ч после активации.
Список литературы
Kalousek I., Otevřelová P., Röselová P. Expression and translocation of major nucleolar proteins in relation to the transcriptional activity of the nucleolus // J. Appl. Biomed. 2005. V. 3. № 4. P. 175–186.
Dergunova N.N., Bulycheva T.I., Artemenko E.G., et al. A major nucleolar protein B23 as a marker of proliferation activity of human peripheral lymphocytes // Immunology Letters. 2002. V. 83. № 1. P. 67–72.
Orsolic I., Jurada D., Pullen N., et al. The relationship between the nucleolus and cancer: Current evidence and emerging paradigms // Seminars in cancer biology. 2016. V. 37–38. P. 36–50.
Sun X., Kaufman P.D. Ki-67: more than a proliferation marker // Chromosoma. Springer Science and Business Media Deutschland GmbH, 2018. V. 127. № 2. P. 175–186.
Дейнеко Н.Л. Булычева Т.И., Григорьев А.А., и др. Экспрессия онкомаркерного белка B23/нуклеофозмина в различных опухолевых клетках // Иммунология. 2015. Т. 36. № 2. С. 153–158.
Marcel V., Catez F.B., Caroline M., et al. Expression Profiling of Ribosome Biogenesis Factors Reveals Nucleolin as a Novel Potential Marker to Predict Outcome in AML Patients // PLOS ONE. 2017. V. 12. № 1. P. e0170160.
Моралева А.А., Малышева М.В., Магоулас Х., и др. Ранняя экспрессия белка ядрышка SURF-6 в лимфоцитах селезенки мыши, активированных к пролиферации in vitro // Бюллетень Экспериментальной Медицины и Биологии. 2009. Т. 147. № 5. С. 507–511.
Polzikov M., Zatsepina O., Magoulas C. Identification of an evolutionary conserved SURF-6 domain in a family of nucleolar proteins extending from human to yeast // Biochem. Biophys. Res. Commun. 2005. V. 327. № 1. P. 143–149.
Moraleva A., Magoulas C., Polzikov M., et al. Involvement of the specific nucleolar protein SURF6 in regulation of proliferation and ribosome biogenesis in mouse NIH/3T3 fibroblasts // Cell Cycle. 2017. V. 20. №16. P. 1979–1991.
Oeffinger M., Fatica A., Rout M.P., et al. Yeast Rrp14p is required for ribosomal subunit synthesis and for correct positioning of the mitotic spindle during mitosis // Nucleic acids research. 2007. V. 35. № 4. P. 1354–1366.
Sanghai Z.A. et al. Modular assembly of the nucleolar pre-60S ribosomal subunit // Nature. 2018. V. 556. № 7699. P. 126–129.
Ferrolino M.C., Mitrea D.M., Michael J.R, et al. Compositional adaptability in NPM1-SURF6 scaffolding networks enabled by dynamic switching of phase separation mechanisms // Nature Communications. 2018. V. 9. № 1. P. 5064.
Smetana K. Structural features of nucleoli in blood, leukemic, lymphoma and myeloma cells // Eur. J. Histochem. 2002. V. 46. № 2. P. 125–132.
Magoulas C., Zatsepina O.V., Jordan P.W. et al. The SURF-6 protein is a component of the nucleolar matrix and has a high binding capacity for nucleic acids in vitro // European journal of cell biology. 1998. V. 75. № 2. P. 174–83.
Polzikov M.A., Kordyukova M.Y., Zavalishina L.E., et al. Development of novel mouse hybridomas producing monoclonal antibodies specific to human and mouse nucleolar protein SURF-6 // Hybridoma. 2012. V. 31. № 1. P. 48–53.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


