Доклады Российской академии наук. Науки о жизни, 2020, T. 494, № 1, стр. 527-531
Ноотропное средство ноопепт активирует транскрипционный фактор HIF-1
Л. Ф. Зайнуллина 1, Т. В. Иванова 2, С. В. Садовников 2, Ю. В. Вахитова 1, *, академик РАН С. Б. Середенин 1
1 Федеральное государственное бюджетное научное учреждение “Научно-исследовательский институт фармакологии имени В. В. Закусова”
Москва, Россия
2 Институт биохимии и генетики – обособленное структурное подразделение Федерального государственного бюджетного научного учреждения Уфимского федерального исследовательского центра Российской академии наук
Уфа, Россия
* E-mail: juvv73@gmail.com
Поступила в редакцию 19.05.2020
После доработки 28.05.2020
Принята к публикации 29.05.2020
Аннотация
Изучено влияние ноопепта (этиловый эфир N-фенилацетил-L-пролил-глицина) на ДНК-связывающую активность HIF-1 в клетках линии SH-SH5Y и исследованы механизмы стабилизации транскрипционного фактора. Показано, что ноопепт увеличивает как базальную, так и стимулированную различными по механизму действия миметиками гипоксии ДНК-связывающую активность HIF-1. Механизм стабилизации кислород-чувствительной субъединицы HIF1α при действии ноопепт включает ингибирование HIF-1 пролилгидроксилазы, на что косвенно указывают данные, полученные с использованием репортера ODD-Luc, и позитивный эффект на содержание белка HIF1α. Выявлено, что действие ноопепта сопровождается изменениями экспрессии генов, которые относятся к различным метаболическим путям и находятся под контролем транскрипционного фактора HIF-1.
ВВЕДЕНИЕ
Индуцируемый гипоксией фактор – 1 (HIF-1) – транскрипционный активатор, который координирует консервативный адаптивный клеточный ответ на снижение уровня кислорода посредством регуляции экспрессии генов, вовлеченных в процессы ангиогенеза, пролиферации, эритропоэза, метаболизма глюкозы, поддержания рН, апоптоза и миграции [1]. HIF-1 является гетеродимером, состоящим из двух субъединиц – кислород-чувствительной субъединицы HIF-1α и конститутивно-экспрессирующейся HIF-1β. Гипоксия способствует возрастанию уровня HIF-1α, его димеризации с HIF-1β, мобилизации ко-активаторов (р300/СВР) и связыванию этого комплекса с последовательностью HRE (hypoxia-response element) в регуляторных областях генов-мишеней. В условиях нормоксии зависимое от кислорода гидроксилирование остатков пролина (Pro402, Pro564) субъединицы HIF-1α пролилгидроксилазами (PHD) является необходимым условием для связывания белком фон Хиппеля–Линдау (VHL) – компонентом убиквитин-протеин лигазы Е3. Убиквитинилированный HIF-1α становится мишенью для деградации 26S протеосомами. Кроме того, при нормальном содержании кислорода аспарагин-гидроксилаза (FIH, фактор ингибирования HIF-1) гидроксилирует аспарагиновый остаток (Asn803) С-терминального домена трансактивации (C-TAD) HIF-1α, что блокирует его взаимодействие с ко-активатором транскрипции p300/CBP и снижает транскрипционную активность HIF-1. Таким образом, в условиях нормоксии ферменты PHD и FIH инактивируют HIF-1α, подавляя зависимую от HIF-1 экспрессию генов-мишеней. В условиях гипоксии активность PHD и FIH снижается, что приводит к уменьшению деградации и стабилизации HIF-1α и запуску транскрипции зависимых от него генов [1].
К настоящему времени компоненты HIF-1-зависимого сигнального пути рассматриваются в качестве мишеней фармакотерапевтического воздействия для лечения таких распространенных заболеваний как ишемическая болезнь сердца, атеросклероз, онкологические и нейродегенеративные заболевания. Отметим, однако, что при различных патологических процессах повышение активности HIF-1 может иметь как позитивное, так и негативное функциональное значение, и этот факт принимается во внимание при разработке фармакологических подходов к коррекции HIF-1 при конкретном заболевании. В частности, ингибиторы HIF-1 – зависимого сигнального пути интенсивно исследуются в качестве противораковых агентов и средств терапии легочной гипертензии и ряда неспецифических заболеваний легких, в то время как активация HIF-1 – регулируемого пути представляется эффективной нейропротекторной стратегией для лечения и/или предупреждения ишемических заболеваний сердца, анемий, ишемических инсультов и нейродегенеративных заболеваний [2, 3].
Интерес в качестве нейропротективных агентов представляют линейные и циклические пролин-содержащие пептиды, отдельные представители которых используются в клинической практике (“Ноопепт”, [4]), а другие – в частности, активный метаболит ноопепта и эндогенный регулятор тревоги и памяти – цикло-L-пролилглицин [5], замещенный дипептид Gly-Pro – исследуются в настоящее время. Не так давно показано, что ноопепт обладает способностью увеличивать как базальную, так и индуцированную миметиком гипоксии ДНК-связывающую активность HIF-1 [6]. Ранее в исследованиях, выполненных под руководством Островской Р.У., на модели гипобарической гипоксии было показано, что предварительное введение ноопепта (0.5 мг/кг) мышам увеличивало количество выживших животных с 15 до 44% [7], что свидетельствует о наличии у препарата антигипоксических свойств. В целом, имеющиеся литературные и собственные экспериментальные данные позволяют предположить, что ноопепт и другие пролин-содержащие соединения могут повышать устойчивость к гипоксии за счет способности воздействовать на компоненты HIF-1 – зависимого сигналинга, обуславливая тем самым один из механизмов нейропротекции. В данной работе проведено изучение механизмов HIF-1 – позитивного действия ноопепта.
Ранее эффект ноопепта на ДНК-связывающую активность HIF-1 был показан в клетках эмбриональной почки человека HEK293, а в качестве фармакологического миметика гипоксии использовали CoCl2 [6]. В данной работе изучение влияния ноопепта на активность транскрипционного фактора HIF-1 проведено в нейроноподобных клетках SH-SY5Y в присутствии различных по механизму действия фармакологических миметиков гипоксии – дефероксамина (ДФО) и диметилоксалилглицина (ДМОГ). Как известно, ДФО является хелатором железа, ингибирует пролилгидроксилазу, стабилизируя тем самым HIF-1α. [8]. Аналог 2-оксоглутарата ДМОГ подавляет гидроксилирование HIF-1α за счет конкуренции с эндогенным кофактором пролилгидроксилазы 2-оксоглутаратом [9]. Известно также, что ДФО и ДМОГ ингибируют активность FIH [8]. Люциферазная конструкция для анализа активности HIF-1 содержит 4 копии консенсусной последовательности 5' ACGTG 3', являющейся сайтом связывания для белка HIF-1α (конструкция HRE-Luc; Panomics, США) [10]. Как следует из данных, представленных на рис. 1а, ноопепт в базальных условиях способствовал повышению HIF-1-зависимой активности, в среднем, на 60%. В условиях имитации состояния гипоксии ДФО инкубация клеток SH-SY5Y с ноопептом приводила к индукции люциферазы, в среднем, на 40%, а в случае использования ДМОГ – на 16%. Таким образом, полученные результаты подтверждают способность ноопепта увеличивать как базальную, так и стимулированную различными по механизму действия миметиками гипоксии ДНК-связывающую активность HIF-1.
Рис. 1.
Влияние ноопепта на активность репортерных конструкций HRE-Luc и HIF1-ODD-Luc in vitro (a) клетки SH-SY5Y (0.2 × 106 клеток/мл) транзиентно транcфицировали репортерной конструкцией HRE-Luc с использованием “Lipofectamine 2000”. Через 6 ч после трансфекции добавляли ноопепт (10–4 М) и инкубировали 18 ч, далее вносили ДФО (10–4 М) или ДМОГ (10–3 М) и совместно инкубировали в течение 6 ч, после чего детектировали люциферазную активность (“Dual Luciferase Reporter Assay System”). В качестве контроля приняты значения люминесцентного сигнала в группах “нормоксия”, “ДФО”, “ДМОГ” без ноопепта. Данные представлены в виде среднего арифм. ± станд. ошибка среднего. Сравнение экспериментальных групп проводили с использованием парного t-критерия Стьюдента для зависимых выборок (N = 3, n = 9; * – p < 0.05 по отношению к контролю). (б) клетки SH-SY5Y транзиентно транcфицировали репортерной конструкцией HIF1-ODD-Luc. Через 6 ч после трансфекции добавляли ноопепт (в концентрациях 10–6–10–4 М) и инкубировали 24 ч. В качестве контроля приняты значения люминесцентного сигнала в группе без ноопепта. Данные представлены в виде среднего арифм. ± станд. ошибка среднего. Сравнение экспериментальных групп проводили с использованием парного t-критерия Стьюдента для зависимых выборок (N = 3, n = 9; * – p < 0.05 по отношению к соответствующему контролю).
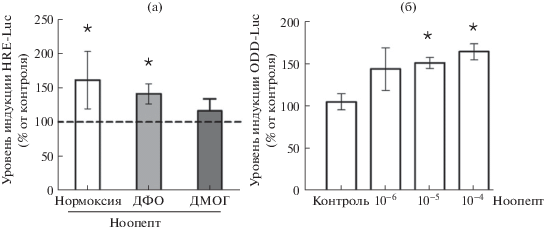
С целью изучения механизмов HIF-1 – позитивного эффекта ноопепта, нами использована репортерная конструкция HIF1-ODD-Luc (Addgene, США), которая позволяет проводить поиск ингибиторов пролилгидроксилазы (PHD2), стабилизаторов HIF-1. Данный репортер представляет собой гибридный белок, состоящий из белка люциферазы и С-концевого фрагмента кислородзависимого домена деградации HIF-1α (ODD HIF-1α; 530–653 а.о.), который содержит остатки пролинов, подвергающиеся гидроксилированию пролилгидроксилазой. Принцип действия тест-системы основан на индукции генерации люминесцентного сигнала при стабилизации HIF1-ODD-Luc при действии ингибиторов HIF пролилгидроксилазы [11]. При оценке влияния ноопепта на активность репортера HIF1-ODD-Luc показано (рис. 1б), что соединение зависимо от концентрации, увеличивало амплитуду люминесцентного сигнала репортера с максимумом эффекта при концентрации 100 мкМ на 60%. Полученные данные подтверждают стабилизацию HIF-1 при действии ноопепта и, в качестве возможного механизма, позволяют предположить ингибирующую активность препарата в отношении пролилгидроксилазы.
Далее проведено изучение влияния ноопепта на уровень мРНК гена и белка HIF-1α и на содержание белков PHD2 (HIF-пролилгидроксилаза 2) и FIH (фактор, ингибирующий HIF-1) в модели гипоксии in vitro, индуцированной дефероксамином. Установлено, что инкубация с ноопептом на фоне действия ДФО не приводила к изменению уровня мРНК гена HIF-1A при сравнении с эффектом индуктора (рис. 2а). Отмечено незначительное, статистически недостоверное увеличение содержания мРНК гена HIF-1A при инкубации клеток с ноопептом. Анализ эффектов ноопепта на содержание белков HIF-1α, PHD2 и FIH проводили методом вестерн-блот анализа. Как следует из данных, представленных на рис. 2б, в условиях моделируемой in vitro гипоксии ноопепт повышал уровень белка HIF-1α, в среднем, на 25%, при этом влияния препарата на содержание белка PHD2 не выявлено (рис. 2в). В аналогичных условиях ноопепт приводил к уменьшению относительного содержания белка FIH, в среднем, на 33% (рис. 2г).
Рис. 2.
Влияние ноопепта на уровень мРНК гена HIF1-α и относительное содержание белков HIF-1α, PHD2 и FIH (а). К клеткам SH-SY5Y после 48 ч культивирования добавляли ДФО (10–4 М) и инкубировали в течение 6 ч, затем производили смену среды на содержащую ноопепт (10–4 М) и продолжали инкубацию в течение 4 ч, после чего проводили выделение мРНК. Уровень мРНК целевого гена был нормализован к уровню мРНК гена HPRT. Данные представлены в виде медианы с учетом 5-й и 95-й процентилей (n = 3; * – p < 0.05 по отношению к контролю, принятому за единицу). Сравнение экспериментальных групп проводили с использованием t-критерия Вилкоксона. (б, в, г) К клеткам SH-SY5Y добавляли ноопепт (10–4 М) и инкубировали 24 ч. За 6 ч до окончания времени инкубации с ноопептом к клеткам добавляли дефероксамин (10–4 М) и продолжали совместную инкубацию в течение 6 ч, после чего выделяли белки. Значение содержания целевых белков были нормализованы к уровню β-тубулина. Данные представлены в виде среднего арифм. ± станд. ошибка среднего (N = 3; n = 9; * – p < 0.05 по отношению к контролю). Сравнение экспериментальных групп проводили с использованием парного t-критерия Стьюдента для зависимых выборок (N = 3, n = 9; * – p < 0.05).

Для изучения влияния ноопепта на транскрипционную активность HIF-1 был проведен анализ экспрессии отдельных генов (VEGFA, PDK1, BNIP3), находящихся под контролем этого транскрипционного фактора и участвующих в обеспечении адаптации клеток в условиях гипоксии. Анализ полученных данных показал, что предобработка клеток ноопептом (20 ч) с последующей инкубацией с ДФО (4 ч) приводила к повышению уровня мРНК генов VEGFA и PDK1 по сравнению с группой “ДФО”; отмечено также незначительное увеличение уровня мРНК гена BNIP3, однако отличия были статистически не достоверны.
Рис. 3.
Влияние ноопепта на уровень мРНК генов-мишеней транскрипционного фактора HIF-1. Клетки SH-SY5Y культивировали в присутствии ноопепта (10–4 М) 20 ч, далее вносили ДФО (10–4 М) и совместно инкубировали в течение 4 ч. Уровень мРНК целевых генов нормализовали к уровню мРНК гена HPRT (ОТ-ПЦР в режиме реального времени по методу сравнения пороговых циклов [12; “REST Tool V. 2.0.7”; “Corbertt Research”, CША]. Данные представлены в виде медианы с учетом 5-й и 95-й процентилей (N = 2, n = 6; * – p < 0.05 по отношению к контролю, принятому за единицу; # – p < 0.05). Сравнение экспериментальных групп проводили с использованием t-критерия Вилкоксона.

Таким образом, впервые показано, что HIF-1 – позитивный эффект пролин-содержащего дипептида ноопепта реализуется за счет стабилизации кислород-регулируемой субъединицы HIF-1α и усиления транскрипционной активности этого транскрипционного фактора. На способность ноопепта стабилизировать HIF-1α указывает повышение содержания соответствующего белка и индукция репортера HIF1-ODD-Luc. Как известно, стабилизации HIF-1α недостаточно для транскрипционной активации генов, регулируемых HIF-1. Аспарагин-гидроксилаза FIH гидроксилирует остаток Asn803 HIF-1α, что блокирует связывание ко-активаторов транскрипции p300/CBP с HIF-1α и предотвращает формирование функционального транскрипционного комплекса [13]. Полученные данные свидетельствуют о том, что ноопепт, вероятно, способствует трансактивации HIF-1, поскольку установлено повышение уровня мРНК генов, контролируемых этим транскрипционным фактором. Косвенно на это указывает и снижение уровня белка FIH, ингибирование которого сопряжено с подавлением транскрипционной активности, опосредованной HIF-1 [14].
Стабилизация HIF-1α является патогенетически обоснованной стратегией цитопротекции. На данный момент в литературе имеются сведения о новых ингибиторах PHD2 и индукторах HIF-1, обладающих нейропротекторными свойствами, однако большинство из них пока не используются в качестве лекарственных средств [15]. Для многих таких соединений показано ингибирование PHD2 и FIH, следствием чего является стабилизиция HIF-1α и запуск HIF-1 – зависимых компенсаторных процессов, вовлеченных в механизмы нейропротекции. Лекарственное средство ноопепт наряду с ноотропными свойствами проявляет выраженную нейропротективную активность, установленную на различных моделях повреждений in vivo и in vitro, и обусловленную сочетанием антиоксидантных и антиапоптотических свойств, ингибирующим действием в отношении потенциал-зависимых кальциевых каналов и высвобождения глутамата, а также способностью усиливать экспрессию нейротрофинов [7]. Наличие в механизмах фармакологического действия ноопепта способности стабилизировать HIF-1α позволяет частично обосновать его ноотропные, нейропротективные и антидиабетические свойства.
Список литературы
Semenza G. // Cell. 2012. V. 148. № 3. P. 399–408. https://doi.org/10.1016/j.cell.2012.01.021
Merelli A., Rodríguez J.C.G., Folch J., et al. // Curr. Neuropharmacol. 2018. V. 16. № 10. P. 1484–1498. https://doi.org/10.2174/1570159X16666180110130253
Nagel S., Talbot N.P., Mecinovic J., et al. // Antioxid. Redox. Signal. 2010. V. 12. P. 481–501. https://doi.org/10.1089/ars.2009.2711
Gudasheva T.A., Rozantsev G.G., Vasilevich N.I., et al. // Eur. J. Med. Chem. 1996. V. 31. № 2. P. 151–157. https://doi.org/10.1016/0223-5234(96)80448-X
Gudasheva T.A., Boyko S.S., Ostrovskaya R.U., et al. // FEBS Letters. 1996. V. 391. № 1-2. P. 149–152. https://doi.org/10.1016/0014-5793(96)00722-3
Вахитова Ю.В., Садовников С.В., Борисевич С.С. и др. // Acta Naturae. 2016. Т. 8. № 1. С. 90–98. https://doi.org/10.32607/20758251-2016-8-1-82-89
Островская Р.У., Гудашева Т.А., Воронина Т.А. и др. // Эксп. Клин. фармакол. 2002. Т. 65. № 5. С. 66–72. https://doi.org/10.30906/0869-2092-2002-65-5-66-72
Schofield C.J., Ratcliffe P.J. // Nat. Rev. Mol. Cell Biol. 2004. V. 5. № 5. P. 343–354. https://doi.org/10.1038/nrm1366
Cummins E.P., Seeballuck F., Keely S.J. // Gastroenterology. 2008. V. 134. № 1. P. 156–165. https://doi.org/10.1053/j.gastro.2007.10.012
Semenza G.L., Jiang B.H., Leung S.W., et al. // J. Biol. Chem. 1996. V. 271. P. 32529–32537. https://doi.org/10.1074/jbc.271.51.32529
Smirnova N.A., Rakhman I., Moroz N., et al. // Chem. Biol. 2010. V. 17. P. 380–391. https://doi.org/10.1016/j.chembiol.2010.03.008
Livak K.J., Schmittgen T.D. // Methods. 2001. V. 25. № 4. P. 402–408. https://doi.org/10.1006/meth.2001.1262
Freedman S.J., Z.-Y.J. Sun, Poy F., et al. // Proc. Natl. Acad. Sci. U S A. 2002. V. 99. P. 5367–5372. https://doi.org/10.1073/pnas.082117899
Sim J., Cowburn A.S., Palazon A., et al. // Cell Metab. 2018. V. 27. № 4. P. 898-913. https://doi.org/10.1016/j.cmet.2018.02.020
Davis C.K., Jain S.A., Bae O.N., et al. // Front. Cell Dev. Biol. 2019. V. 6. 175. https://doi.org/10.3389/fcell.2018.00175
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


