Доклады Российской академии наук. Науки о жизни, 2020, T. 494, № 1, стр. 500-503
Экспрессия протеинкиназ RIPK-1 и RIPK-3 в клетках волосяного фолликула мыши и человека
Е. И. Моргун 1, 2, *, Е. Д. Позднякова 3, член-корреспондент РАН Е. А. Воротеляк 2
1 Федеральное государственное автономное образовательное учреждение высшего образования “Московский физико-технический институт (государственный университет)”
г. Долгопрудный, Россия
2 Федеральное государственное бюджетное учреждение науки Институт биологии развития им. Н.К. Кольцова Российской академии наук
Москва, Россия
3 Московский государственный университет
имени М.В, Ломоносова
Москва, Россия
* E-mail: lady.morgun2016@yandex.ru
Поступила в редакцию 19.05.2020
После доработки 22.05.2020
Принята к публикации 25.05.2020
Аннотация
Исследована экспрессия регуляторов клеточной гибели протеинкиназ RIPK-1 и RIPK-3 в структурах волосяного фолликула мыши и человека. Обнаружены RIPK-1+ клетки во внутреннем корневом влагалище и RIPK-3+ клетки в наружном и внутреннем корневом влагалище, дермальной папилле и интерфолликулярном эпидермисе на стадии анагена и катагена волосяного фолликула мыши. Интенсивность экспрессии RIPK-1 в раннем анагене была слабой и значительно увеличивалась по мере приближения зрелого анагена и катагена. Также RIPK-1+ и RIPK-3+ клетки обнаружены в волосяном фолликуле человека. Предполагается, что маркеры некроптоза играют в жизнедеятельности волосяного фолликула роль, не связанную с запрограммированной клеточной гибелью, и могут иметь неизученные на данный момент функции и принимать участие в неканонических сигнальных каскадах.
Волосяной фолликул (ВФ) – мини-орган млекопитающих, структура которого подвержена на протяжении жизни циклическим изменениям. Во время фазы телогена ВФ пребывает в состоянии метаболического покоя в виде небольшой группы клеток, в период фазы роста – анаген – его кератиноциты пролиферируют и дифференцируются, формируя полноценный ВФ, а в катагене происходит частичная регрессия структуры ВФ. Запрограммированная клеточная гибель является неотъемлемой частью нормальной жизнедеятельности ВФ. Так, инволюция волосяной луковицы в катагене происходит путем апоптоза кератиноцитов [1], а волосяной стержень формируется благодаря особому типу клеточной гибели – ороговению, которому подвергаются клетки внутреннего корневого влагалища [2]. Однако, механизмы этих процессов до сих пор до конца неизвестны: изучены далеко не все компоненты сигнальных путей апоптоза [3] и ороговения [2], а также их точки пересечения. В связи с этим, мы исследовали ВФ на предмет экспрессии маркеров еще одного типа программируемой клеточной гибели – некроптоза, участниками которого являются RIPK-1 (Receptor interacting protein kinase-1) и RIPK-3 (Receptor interacting protein kinase-3) [4]. В неактивном состоянии RIPK-1 в составе многокомпонентных белковых комплексов может способствовать выживанию клетки. В результате, например, ингибирования IKKα/β- и TBK1/IKKε-зависимого фосфорилирования, становится возможным реализация киназной активности RIPK-1, что приводит к клеточной гибели [5]. Активность RIPK-3 зависит от RIPK-1, но данных в пользу того, что RIPK-1 фосфорилирует RIPK-3, нет. Вероятно, RIPK-1 и RIPK-3 активируются путем аутофосфорилирования, однако детали данного процесса не изучены [4, 6]. Целью работы была детекция паттерна экспрессии RIPK-1 и RIPK-3 в клетках ВФ мыши и человека. В эксперименте были использованы 18 самцов мышей линии С57b/6 в возрасте 6–8 недель. Синхронизацию цикла ВФ проводили путем депиляции воском стандартного участка кожи спины животного на стадии телогена [7]. Все манипуляции с мышами осуществляли под общим наркозом и с одобрения Комиссии по биоэтике ИБР РАН. Мышей выводили из эксперимента на 0, 5, 7, 10, 18, 25 сутки после депиляции. Кожа человека была получена после операции по круговой подтяжке лица из МНИОИ им. П.А. Герцена с информированного согласия пациентов. Все образцы кожи заливали в OCT, затем замораживали. Криосрезы получали на криостате модели SM1900 (Leica Microsystems), затем их окрашивали гематоксилин-эозином. Иммуногистохимическое исследование проводили с помощью антител против RIPK-1 (ABIN 127073, Antibodies-online), RIPK-3 (AV31513, Sigma), Keratin 15 (Krt15) (ab52816, Abcam) и Versican (ab19345, Abcam) на серийных срезах. Специфичность антител подтверждали окрашиванием контрольных тканей по рекомендации производителя или данным литературы (положительный контроль) и препаратов без первых антител (отрицательный контроль). Препараты анализировали на микроскопах моделей BZ-9000E (Keyence) и IX73 (Olympus). Стадию цикла ВФ определяли согласно методике Muller-Rover [1].
Гистологический анализ показал, что ВФ находились в телогене на 0 и 25 сутки, в раннем анагене на 5 сутки, в зрелом анагене на 7 и 10 сутки, а в катагене на 18 сутки.
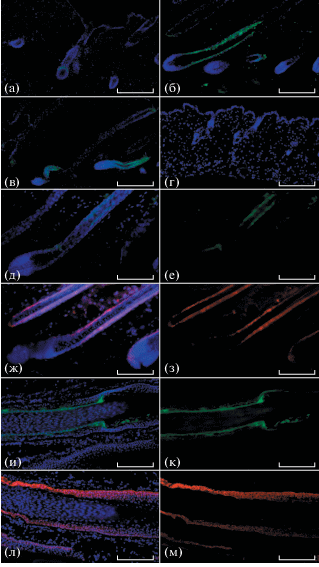
Было обнаружено, что в клетках ВФ мыши экспрессия RIPK-1 в раннем анагене была выражена слабо (рис. 1а); значительно усиливаясь по мере наступления зрелого анагена (рис. 1б) и последующего перехода ВФ в катаген (рис. 1в). В телогене экспрессии RIPK-1+ в кератиноцитах не выявлено (рис. 1г). Анализ серийных срезов, окрашенных антителами против RIPK-1 и против маркера наружного корневого влагалища Krt15 показал, что RIPK-1+ клетки находились во внутреннем корневом влагалище ВФ (рис. 1д– 1з). Также при анализе серийных срезов была обнаружена экспрессия RIPK-1 в кератиноцитах внутреннего корневого влагалища ВФ человека (рис. 1ж– 1м).
Рис. 1.
ВФ мыши, окрашивание антителами против RIPK-1, (а – ранний анаген, б – зрелый анаген, в – катаген, г – телоген); ВФ мыши на стадии среднего анагена, серийные срезы, окрашивание антителами против RIPK-1 (д – с DAPI, е – без DAPI) и против Krt15 (ж – с DAPI, з – без DAPI); ВФ человека, серийные срезы, окрашивание антителами против RIPK-1 (и – с DAPI, к – без DAPI) и против Krt15 (л – с DAPI, м – без DAPI). Масштабные отрезки: а, б, в, г, и, к, л, м – 200 мкм; д, е, ж, з – 100 мкм.
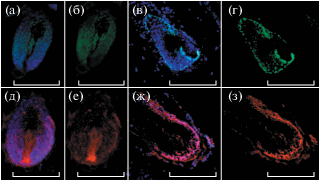
Экспрессию RIPK-3 в ВФ мыши также наблюдали на стадиях анагена (рис. 2а и 2б) и катагена (рис. 2в). В телогене RIPK-3+ кератиноцитов обнаружено не было (рис. 2г). Анализ серийных срезов, окрашенных антителами против RIPK-3, Krt15 и против маркера дермальной папиллы (мезенхимный регулятор цикла ВФ) – Versican [8], подтвердил наличие RIPK-3+ клеток в наружном и внутреннем корневых влагалищах (рис. 2д–2з), а также в дермальной папилле (рис. 3а, 3б, 3д, 3е). Кроме того, экспрессия RIPK-3 присутствовала в интерфолликулярном эпидермисе (ИФЭ) (рис. 2а и 2в). Экспрессия RIPK-3 была обнаружена в клетках ВФ не только мыши, но и человека в том числе в дермальной папилле (рис. 3в, 3г, 3ж, 3з).
Рис. 2.
ВФ мыши, окрашивание антителами к RIPK-3, (а – ранний анаген, б – зрелый анаген, в – катаген, г – телоген); ВФ мыши на стадии раннего анагена, серийные срезы, окрашивание антителами против RIPK-3 (д – с DAPI, е – без DAPI) и антителами против Krt15 (ж – с DAPI, з – без DAPI). Масштабные отрезки: а, б, в, г – 200 мкм; д, е, ж, з – 100 мкм.
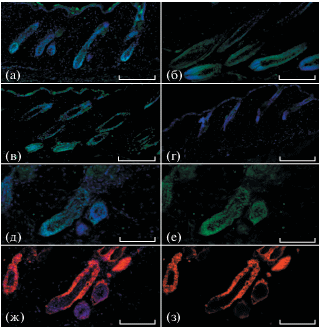
Рис. 3.
ВФ мыши на стадии среднего анагена, серийные срезы, окрашивание антителами против RIPK-3 (а – с DAPI, б – без DAPI) и антителами против Versican (д – с DAPI, е – без DAPI); ВФ человека, серийные срезы, окрашивание антителами RIPK-3 (в – с DAPI, г – без DAPI) и антителами против Versican (ж – с DAPI, з – без DAPI). Масштабные отрезки: а, б, д, е – 100 мкм; в, г, ж, з – 200 мкм.
Таким образом, экспрессия RIPK-1 и RIPK-3 была выражена не только в катагене, характеризующемся массовой гибелью кератиноцитов, но и на протяжении всей фазы роста – анагена. Кроме того, экспрессия RIPK-3 была обнаружена в кератиноцитах наружного корневого влагалища, которым не свойственно ороговение, а также в фибробластах дермальной папиллы – мезенхимальной структуры, которая не подвергается какому-либо типу клеточной гибели на протяжении всего цикла ВФ в норме [9]. Мы предполагаем, что RIPK-1 и RIPK-3 могут играть роли, не связанные напрямую ни с процессом ороговения при формировании стержня волоса, ни с циклическим апоптозом кератиноцитов.
Известно, что, помимо активации некроптоза, RIPK-1 и RIPK-3 имеют и другие функции [10, 11].
Исходя из данных литературы, мы допускаем, что RIPK-1 и RIPK-3 в клетках ВФ мыши могут юбыть компонентами сигнальных каскадов Wnt или BMP. Известно, что путь Wnt/β-катенин играет ключевую роль в развитии и обеспечении циклических изменений ВФ: лиганд Wnt10b, секретируемый клетками дермальной папиллы, приводит к телоген-анагеновому переходу [12]. В то же время есть данные, что другой лиганд семейства Wnt – Wnt3a ингибирует экспрессию генов ripk1 и ripk3 в культуре мышиных ретинальных ганглионарных клетках [13]. Возможно, экспрессия RIPK-1 и RIPK-3 в клетках ВФ имеет сходный механизм регуляции. В то же время, мы обнаружили экспрессию RIPK-3 не только в ВФ, но и в кератиноцитах ИФЭ, которые, наряду с клетками ВФ, являются мишенями для BMP-лигандов, способствующих пребыванию ВФ в телогене, а также переходу из анагена в катаген [14], поэтому мы предполагаем, что белки семейства BMP могут участвовать в регуляции RIPK-3.
Таким образом, в коже мыши и человека впервые обнаружена экспрессия протеинкиназ RIPK-1 и RIPK-3, которые могут играть не изученные роли в жизнедеятельности ВФ. Предполагается проведение исследований RIPK-1 и RIPK-3 с точки зрения их участия в различных сигнальных каскадах, обеспечивающих циклические изменения ВФ.
Список литературы
Müller-Röver S., Foitzik K., Paus R. et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages // Journal of Investigative Dermatology. 2001. V. 117 (1). P. 3–15. https://doi.org/10.1046/j.0022-202x.2001.01377.x
Eckhart L., Lippens S., Tschachler E., et al. Cell death by cornification // Biochimica et Biophysica Acta (BBA) – Molecular Cell Research. 2013. V. 1833 (12). P. 3471–3480. https://doi.org/10.1016/j.bbamcr.2013.06.010
Tong X. Keratin 17 modulates hair follicle cycling in a TNF -dependent fashion // Genes Dev. 2006. V. 20 (10). P. 1353–1364. https://doi.org/10.1101/gad.1387406
Raju S., Whalen D., Mengistu M. et al. Kinase domain dimerization drives RIPK3-dependent necroptosis // Sci. Signal. 2018. V. 11 (544). P. eaar2188. https://doi.org/10.1126/scisignal.aar2188
Delanghe T, Dondelinger Y, Bertrand M. RIPK1 Kinase-Dependent Death: A Symphony of Phosphorylation Events // Trends Cell Biol. 2020; V. 30. № 3. P. 189–200. https://doi.org/10.1016/j.tcb.2019.12.009
Cho Y., Challa S., Moquin D. et al. Phosphorylation-Driven Assembly of the RIP1-RIP3 Complex Regulates Programmed Necrosis and Virus-Induced Inflammation // Cell. 2009. V. 137. № 6. P. 1112–1123. https://doi.org/10.1016/j.cell.2009.05.037
Paus R., Stenn K., Link R. Telogen skin contains an inhibitor of hair growth // British Journal of Dermatology. 1990. V. 122. № 6. P. 777–784. https://doi.org/10.1111/j.1365-2133.1990.tb06266.x
Yang C., Cotsarelis G. Review of hair follicle dermal cells // J Dermatol Sci. 2010. V. 57. № 1. P. 2–11. https://doi.org/10.1016/j.jdermsci.2009.11.005
Krause K., Foitzik K. Biology of the hair follicle: the basics // Semin Cutan Med Surg. 2006. V. 25. № 1. P. 2–10. https://doi.org/10.1016/j.sder.2006.01.002
Lin Y. RIP1-Mediated Signaling Pathways in Cell Survival and Death Control // Necrotic Cell Death. 2014. P. 23–43. https://doi.org/10.1007/978-1-4614-8220-8_2
Orozco S., Oberst A. RIPK3 in cell death and inflammation: the good, the bad, and the ugly // Immunol Rev. 2017. V. 277. № 1. P. 102–112.
Wu P., Zhang Y., Xing Y. et al. Correction to: The balance of Bmp6 and Wnt10b regulates the telogen-anagen transition of hair follicles // Cell Communication and Signaling. 2020. V. 18. № 1. https://doi.org/10.1186/s12964-020-0508-2
Udeh A., Dvoriantchikova G., Carmy T., et al. Wnt signaling induces neurite outgrowth in mouse retinal ganglion cells // Exp Eye Res. 2019. V. 182. P. 39–43. https://doi.org/10.1016/j.exer.2019.03.004
Botchkarev V., Sharov A. BMP signaling in the control of skin development and hair follicle growth // Differentiation. 2004. V. 72. № 9-10. P. 512–526. https://doi.org/10.1111/j.1432-0436.2004.07209005.x
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


