Доклады Российской академии наук. Науки о жизни, 2020, T. 494, № 1, стр. 522-526
Генетическое своеобразие сибирского лесного северного оленя (Rangifer tarandus valentinae Flerov, 1932) Кузнецкого Алатау
А. А. Васильченко 1, М. В. Холодова 2, А. И. Баранова 2, С. В. Найденко 2, академик РАН В. В. Рожнов 2, *
1 Государственный природный заповедник
“Кузнецкий Алатау”
Междуреченск, Россия
2 Институт проблем экологии и эволюции
им. А.Н. Северцова Российской академии наук
Москва, Россия
* E-mail: rozhnov.v@gmail.com
Поступила в редакцию 19.05.2020
После доработки 27.05.2020
Принята к публикации 28.05.2020
Аннотация
Впервые показано своеобразие алтае-саянской популяции сибирского лесного северного оленя Кузнецкого Алатау (Rangifer tarandus valentinae), которое проявляется в существовании уникальных митохондриальных линий, отсутствии признаков интрогресии мтДНК домашних оленей, а также в низком уровне генетического разнообразия. В исследованной выборке выявлено всего две замены нуклеотидов (обе транзиции), нуклеотидное разнообразие составило 0.00151 ± 0.00136 (почти на порядок ниже, чем у большинства популяций диких северных оленей России и сопоставимо с таковым лишь в отдельных группировках дикого северного оленя Норвегии и Шпицбергена), гаплотипическое – 0.615 ± 0.102.
Дикий северный олень Евразии (Rangifer tarandus Linnaeus, 1758) является реликтом ледникового времени, имеет обширный ареал и в прошлом был широко распространен от островных арктических и тундряных экосистем на севере континента до горно-таежных экосистем Центральной Азии. Внутривидовая структура северного оленя в связи с таким широким ареалом и разнообразием местообитаний в последнее время вызывает большой интерес, но единое мнение о ней до сих пор не сформировалось.
Многие популяции северного оленя испытывают сильный антропогенный пресс и некоторые из них занесены в Красную книгу Российской Федерации [1]. Среди них – алтае-саянская популяция сибирского лесного северного оленя, R. t. valentinae Flerov, 1932, сведений о современном состоянии которой крайне мало, а представления о таксономическом статусе противоречивы.
В Алтае-Саянском регионе в XVIII–XIX вв. лесной северный олень был широко распространен в горно-таежной зоне Западной Сибири, Алтая, Восточного и Западного Саяна. В настоящее время его ареал фрагментирован, разделен на отдельные островные участки [2]. Горная система Кузнецкий Алатау является неотъемлемой и единой частью Алтае-Саянской горной страны и соединяется с ней через Абаканский хребет. Поэтому можно с уверенностью предположить, что в XVIII–XIX вв. ареал сибирского северного оленя был единым. Он охватывал Кузнецкий Алатау, горную Шорию и Абаканский хребет, Западный Саян, простирался на восток и захватывал южные хребты в верховьях Енисея, Тувы и Монголии, на востоке по Хамар-Дабану выходил к хребту Улан-Бургасы и далее на восток закрывал собой весь север Читинской области, хребет Кодар, водоразделы и хребты вдоль рек Витим, Муя, Чара, Калор, Усть-Каренга.
Горная система Кузнецкого Алатау является самым западным участком ареала сибирского лесного северного оленя. В прошлом вид был распространен здесь довольно широко (особенно в горной Шории, Хакассии и на Абаканском хребте), в горной системе Кузнецкого Алатау олени обитали во всех горно-таежных типах угодий с высотами от 500 м над уровнем моря, а численность животных превосходила сегодняшнюю в десятки раз. В настоящее время сибирский лесной северный олень встречается главным образом в границах заповедника “Кузнецкий Алатау” и его окрестностях (рис. 1а). Существенная трансформация крупного стада произошла из-за чрезмерного давления со стороны человека [3].
Рис. 1.
Современное распространение сибирского лесного северного оленя в Алтае-Саянском экорегионе (а) и схема размещения его группировок в Кузнецком Алатау (б).

Заповедник Кузнецкий Алатау представляет собой сложную систему горных массивов, разобщенных глубокими речными долинами, в результате чего здесь можно выделить несколько в разной степени изолированных группировок северного оленя (рис. 1б). Самая крупная группировка заповедника, центральная, занимает обширную территорию, включающую горный массив Каным и Белый Голец, вершины гор Соловей, Круглая, Столовая, Крестовая, хребты между истоками рек Средняя Терсь, Изас, Кривая, Шат, Верхняя Терсь, хребет Чёрный Ворон, водоразделы между реками Верхняя Терсь, Чек-Су, Белая Уса, истоки реки Чёрный Июс, горный массив с выдающейся вершиной горы Бобровой, истоки рек Избасы, Бобровая, Саргая.
Вторая группировка, северная, обитает на горах Чемодан, Становой, Пестрая, Церковная, Заяц, на возвышенностях между реками Кия и Средняя Терсь, гряде гор с вершинами Большая Зелёная, Плоская, на горах между реками Тайдон, Растай и Нижняя Терсь. Третья группировка, южная, населяет восточные склоны Кузнецкого Алатау – массив Поднебесные Зубья, хребет Хартас, горы Хазыр-Тырен, истоки рек Белый Июс, Харатас, Большой и Малый Казыры, Пихтерек, Тюхтерек, горы Пустасхыл и Унгур.
Строительство дорог, движение техники, добыча полезных ископаемых, неорганизованный туризм, браконьерская охота – все эти факторы влияют на все большее разделение южной и центральной группировок северного оленя. Железнодорожная ветка Новокузнецк–Абакан отделила популяцию Кузнецкого Алатау от западной саянской популяции северного оленя. Одним из путей перехода северных оленей из центральной группировки в южную являлось место слияния рек Уса и Белая Уса, где в настоящее время добываются марганцевые руды. Вдоль р. Шатай построена технологическая дорога для вывозки марганцевых руд, которая препятствует передвижению оленей. В течение 20 лет идет активная добыча золота на Верхне-Усинском золотоносном месторождении – по р. Уса на протяжении 45 км от р. Тамуяс до р. Базан и на протяжении 30 км по рекам Базан, Собака, Яковлевка. Огромный антропогенный пресс испытывает южная группировка северного оленя на Поднебесных Зубьях: тысячи туристов посещают это место в течение всего года. Активно развивается снегоходный туризм в районе п. Приисковый, чему способствует раннее выпадение снега и его масса: так называемые рейдеры катаются со стороны Хакасии по хребту Кузнецкий Алатау на юг в сторону Большого Каныма на расстоянии 30–40 км. Район горы Бобровая в зимнее время фактически утерян как стации обитания для северных оленей. По рекам Черный и Белый Июс, Пихтерек и Тюхтерек, Бель-Су и Тумуяс активно опромышляются охотугодья.
Таким образом, статус территориально изолированной в течение последних ста лет популяции лесного северного оленя, населяющей горный массив Кузнецкий Алатау, остается неясным. В связи с этим целью настоящей работы является оценка генетического разнообразия и выявление родственных связей этой популяции с другими популяциями дикого северного оленя России на основании анализа полиморфизма контрольного региона мтДНК.
Образцы для молекулярно-генетического анализа представлены экскрементами, собранными в зимний период от отдельных особей диких северных оленей на территории заповедника “Кузнецкий Алатау”. Кроме того, в работе использованы образцы крови, полученной от одного дикого оленя из заповедника “Кузнецкий Алатау” и от двух домашних оленей из Республики Тыва, содержащихся в экспозиции Экоцентра заповедника.
Для выделения ДНК использовали наборы QIAmp DNA Mini Kit (для образцов крови) и QIAmp Fast DNA Stool Mini Kit для экскрементов (Qiagen, Германия). Полимеразную цепную реакцию (ПЦР) проводили с праймерами L15394 (прямой) и H15947 (обратный), ранее применявшимися для амплификации левого гипервариабельного фрагмента контрольного региона (D-петли) мтДНК северного оленя [4]. Определение нуклеотидных последовательностей проводили методом автоматического секвенирования на генетическом анализаторе AB 3500 (Applied Biosystems, США) с использованием набора BigDye Terminator 3.1 (Applied Biosystems, США) с прямым и обратным праймерами, использованными в ПЦР. Выравнивание последовательностей проводили вручную с помощью программы Bioedit 7.0.9 [5]. Для статистической обработки данных, построения медианных сетей и деревьев использовали программы MEGA 7 [6], Arlequin 3.5.1.2 [7] и Network 4.6.1.3 [8]. Для сравнения были использованы размещенные в базе данных GenBank гомологичные последовательности мтДНК диких и домашних северных оленей из базы GenBank (ncbi), выбранные с помощью опции BLAST среди наиболее сходных по нуклеотидному составу. Филогенетические деревья строили для гаплотипов длиной 466 п.н. и 417 п.н., поскольку большинство гаплотипов северного оленя Евразии, в том числе и важные для данной работы гаплотипы домашних тувинских оленей, были короче 466 п.н.
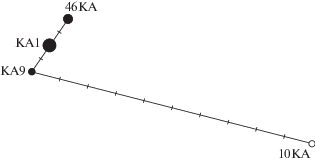
Получено 16 нуклеотидных последовательностей (сиквенсов) контрольного региона мтДНК длиной 466 п.н. – 14 для диких и две для домашних оленей. Выявлено четыре гаплотипа – три для диких (KA1, KA9, KA46) и один (KA10) для домашних северных оленей (номера в GenBank MN125055-MN125058). Все гаплотипы встречались у нескольких особей: KA1 у восьми, KA9 у двух, KA46 у четырех и KA10 у двух. Анализ филогенетических отношений между описанными гаплотипами показал близкое сходство между гаплотипами диких северных оленей при существенных их отличиях от гаплотипов домашних тувинских оленей (рис. 2).
Рис. 2.
Медианная сеть гаплотипов по контрольному региону мтДНК (466 п.н.) северных оленей – диких из Кузнецкого Алатау (черные круги) и домашних из Республики Тыва (незакрашенный круг). Диаметр кругов пропорционален числу особей с данным гаплотипом, мутации отмечены черточками на ветвях сети.
Филогенетический анализ с привлечением гаплотипов контрольного региона мтДНК (417 п.н.) из Генбанка (GenBank, ncbi), ранее опубликованных для диких и домашних северных оленей из разных частей ареала R. tarandus в Евразии [4, 9–13], показал следующее (рис. 3).
Рис. 3.
Дерево филогенетических отношений между гаплотипами контрольного региона мтДНК (417 п.н.) северного оленя Кузнецкого Алатау (обозначены кружками: дикие черными, домашние незакрашенным) и домашних и диких оленей из других частей ареала. Метод Neighbor-Joining, модель Tamura-Nei, в узлах ветвления указаны значения коэффициентов бутстреп-анализа (550 повторов) превышающие 50%.

Гаплотип KA9 относится к одному из наиболее широко распространенных среди диких и домашних северных оленей гаплотипов. Он обнаружен у диких и домашних оленей Кольского п-ова, диких оленей из Республики Коми и с п-ова Таймыр, причем как у современных, так и в исторических образцах (Музей “Ледяная пещера” в Хатанге, изолят № 1113, датировка около 400 лет) [11]. Заслуживает внимания тот факт, что среди домашних северных оленей Тывы и Забайкалья гаплотипов, идентичных или близких КА9, не обнаружено. Это позволяет предположить отсутствие интрогрессии мтДНК тувинских домашних оленей в популяцию диких оленей Кузнецкого Алатау.
Гаплотипы KA1 и KA46 дикого северного оленя Кузнецкого Алатау уникальны. Идентичных гаплотипов в базе GenBank, содержащей более 2100 сиквенсов D-петли мтДНК R. tarandus, не обнаружено. На NJ дереве, построенном для сиквенсов длиной 466 п.н. (не приводится) эти два гаплотипа с высокой степенью бутстреп-поддержки (80%) формируют отдельный кластер. Для более коротких сиквенсов (417 п.н.) на NJ дереве этот кластер сохраняется, но в него также включается близкий гаплотип (JN570801), описанный для исторического образца северного оленя с Таймыра (Музей “Ледяная пещера” в Хатанге, изолят № 1107, датировка около 200 лет) [11]. Следует отметить, что гаплотипы KA1 и KA46 близки к гаплотипам как диких северных оленей лесного экотипа с Кольского п-ова и из Финляндии, так и домашних оленей из этих регионов, составляющих сестринский к ним кластер.
Гаплотип КА10, описанный для домашних тувинских северных оленей, кластеризовался с гаплотипами домашних оленей из Республики Тыва и Забайкалья [9, 13].
Полученные значения показателей генетической изменчивости для выборки диких северных оленей Кузнецкого Алатау оказались низкими по сравнению с большинством других популяций дикого R. tarandus: в исследованной нами выборке выявлено всего две замены нуклеотидов (обе транзиции), нуклеотидное разнообразие составило 0.00151 ± 0.00136, гаплотипическое – 0.615 ± ± 0.102. Значение нуклеотидного разнообразия оленей Кузнецкого Алатау по контрольному региону мтДНК оказалось почти на порядок ниже, чем у большинства популяций диких северных оленей России, относящихся как к тундровому, так и к лесному экотипу [4, 10–12, 14]. Уровень генетического разнообразия оленей Кузнецкого Алатау сопоставим лишь с таковым в отдельных группировках дикого R. tarandus Норвегии и Шпицбергена [12, 15]. Низкий уровень нуклеотидного и гаплотипического разнообразия алтае-саянской популяции может быть результатом длительной изоляции при низкой численности или формирования ее от ограниченного числа животных-основателей. Значение коэффициента Таджимы (D = 0.321) свидетельствует о снижении численности исследованной популяции.
Таким образом, своеобразие популяции дикого северного оленя Кузнецкого Алатау проявляется в существовании уникальных митохондриальных линий, в отсутствии признаков интрогресии мтДНК домашних оленей, а также в низком уровне генетического разнообразия. Все это указывает на необходимость особо строгих мер по сохранению алтае-саянской популяции сибирского лесного северного оленя и дальнейшего изучения ее генетического разнообразия, увеличивая выборку образцов и расширяя набор молекулярно-генетических маркеров.
Список литературы
Красная книга Российской Федерации (животные). М.: АСТ-Астрель. 2001. 862 с.
Васильченко А.А., Смирнов М.Н. // Известия Самарского научного центра Российской академии наук. 2010. Т. 12. № 1 (5). С. 1271–1275.
Соколов Г.А. // Дикий северный олень. (Бюл. НИИСХ Крайнего севера). 1976. С. 88-90.
Flagstad Ø., Røed K.H. // Evolution. 2003. V. 57. P. 658–670.
Hall T.A. // Nucl. Acids Symp. Ser. 1999. V. 41. P. 95–98.
Kumar S., Stecher G., Tamura K. // Molecular Biology and Evolution. 2016. V. 33. P. 1870–1874.
Excoffier L., Laval G., Schneider S. // Evol. Bioinform. Online. 2005. V. 1. P. 47–50.
Bandelt H.-J., Forster P., Rohl A. // Molecular Biology and Evolution. 1999. V. 16. № 1. P. 37–48.
Кол Н.В., Королев А.Л., Захаров И.А. // Генетика. 2006. Т. 42. № 1. С. 110–112.
Королев А.Н., Мамонтов В.Н., Холодова М.В., Баранова А.И. и др. // Зоол. журн. 2017. Т. 96. № 1. С. 1–13.
Lorenzen E.D., Nogués-Bravo D., Orlando L., Weinstock J. et al. // Nature. 2014. V. 479 (7373). P. 359–64.
Kvie K.S., Heggenes J., Røed K.H. // Ecol. Evol. 2016. V. 6 (13). P. 4347–4358.
Anderson D.G., Kvie K.S., Davydov V.N., Roed K.H. // Ecol. Evol. 2017. V. 7 (17). P. 6790–6802.
Холодова М.В., Колпащиков Л.А., Кузнецова М.В., Баранова А.И. // Известия РАН. Сер. биол. 2011. № 1. С. 52–60.
Røed K.H., Flagstad O., Nieminen, M., Holand Ø., et al. // Proc. R. Soc. B. 2008. V. 275. P. 1849–1855.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


