Доклады Российской академии наук. Науки о жизни, 2020, T. 495, № 1, стр. 598-601
ВЛИЯНИЕ ФАКТОРА ДИФФЕРЕНЦИРОВКИ HLDF in vitro НА ИНВАЗИВНУЮ КАРЦИНОМУ МОЛОЧНОЙ ЖЕЛЕЗЫ НЕСПЕЦИФИЧЕСКОГО ТИПА
А. И. Аутеншлюс 1, 2, *, И. П. Жураковский 1, 2, К. И. Давлетова 1, 2, А. П. Богачук 3, академик РАН В. В. Ляхович 2, член-корреспондент РАН В. М. Липкин 3
1 ФГБОУ ВО “Новосибирский государственный медицинский университет”
Новосибирск, Россия
2 “Научно-исследовательский институт молекулярной биологии и биофизики” – структурное подразделение ФГБНУ ФИЦ ФТМ
Новосибирск, Россия
3 ФГБУН “Институт биоорганической химии имени академиков М. М. Шемякина и Ю. А. Овчинникова” Российской академии наук
Москва, Россия
* E-mail: lpciip@211.ru
Поступила в редакцию 15.06.2020
После доработки 28.07.2020
Принята к публикации 29.07.2020
Аннотация
Исследование проводили на образцах инвазивной карциномы молочной железы неспецифического типа от 36 больных в возрасте от 48.0 до 62.8 лет. Влияние HLDF на инвазивную карциному молочной железы неспецифического типа заключалось в снижении относительного содержания низкодифференцированных клеток и в увеличении относительного содержания высокодифференцированных клеток. HLDF не обладал цитотоксическим эффектом, приводящим к гибели низкодифференцированных клеток, а способствовал приобретению ими более высокой степени дифференцировки. Более выраженный эффект влияния HLDF наблюдался в более агрессивных формах неоплазий, дающих метастазы, что позволяет рассматривать данный фактор дифференцировки как кандидата для применения в дифференцировочной терапии злокачественных новообразований.
Фактор дифференцировки, выделенный из культуральной среды клеток линии HL-60 (линия клеток промиелоцитарного лейкоза человека), получивший название “Human Leukemia Differentiation Factor”, или “HLDF”, представляет собой гликозилированный белок с молекулярной массой 8.2 кДа, содержащий 54 аминокислотных остатка [1, 2]. HLDF индуцирует дифференцировку клеток HL-60 в фенотипически зрелые гранулоциты. Этот фактор дифференцировки обнаруживается в организме человека в норме и при патологии [3–5].
Известно, что среди опухолевых клеток выделяют низкодифференцированные клетки (НДК), умереннодифференцированные клетки (УДК) и высокодифференцированные клетки (ВДК). Причем злокачественность опухоли напрямую сопряжена с НДК: чем их больше, тем выше степень злокачественности [6, 7]. Исходя из сведений о том, что HLDF индуцирует дифференцировку клеток, было решено изучить возможность проявления этой его функции при раке молочной железы человека. Целью исследования являлось изучение HLDF на инвазивную карциному молочной железы неспецифического типа.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом исследования служили образцы опухолей 36 женщин в возрасте от 48.0 до 62.8 лет с инвазивной карциномой молочной железы неспецифического типа. От каждой опухоли брали по два образца объемом 8 мм3, один из которых помещали в культуральный флакон с 1 мл питательной среды DMEM-F12, содержащей 20 мкг/мл HLDF (предоставленного Институтом биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН) [8], другой, контрольный, – в питательную среду без HLDF. Больным, образцы опухоли которых использовались в исследовании, до операции не проводили никакого лечения.
После инкубации при 37°С в течение 72 ч образцы опухолей извлекали из среды и фиксировали в 10% растворе формалина. Из залитых в парафин объектов делали серийные срезы толщиной 7 мкм, которые окрашивали гематоксилином Гаррисона и эозином. Морфометрический анализ осуществлялся на базе микроскопа Микмед-6, цифровой камеры DCM510 и программного обеспечения ImageJ 1.42g (Национальный институт здоровья, США).
Исследование проводилось двумя независимыми патоморфологами, которые не были информированы о том, какие образцы опухоли были инкубированы с HLDF. Для каждого образца опухоли морфологические признаки оценивали по 8 микрофотографиям (площадь каждой – 95 578 мкм2), суммарная тестируемая площадь составила 764 624 мкм2. Определение степени дифференцировки клеток проводилось на основании анализа клеточного и ядерного полиморфизма и способности клеток к структурообразованию [6, 7].
Статистическую обработку результатов исследования проводили с использованием программного пакета для статистической обработки SPSS v 17.0 for Windows. Для сравнения зависимых групп применяли критерий Вилкоксона. Различия между значениями сравниваемых параметров расценивали как статистически значимые при р < 0.05. Полученные в ходе исследования данные представлены как медиана (Me) и интерквартильный размах (Q1; Q3).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Контрольные образцы опухолей, культивирование которых осуществлялось без добавления в среду HLDF, имели типичное для инвазивной карциномы неспецифического типа строение с формированием гнезд, кластеров и трабекул, клетки опухоли были вариабельны по своему строению (рис. 1а). Сравнительные данные морфометрического анализа образцов опухолей обработанных и необработанных HLDF представлены в табл. 1.
Рис 1.
Инвазивная карцинома молочной железы неспецифического типа (а) культивирование которой осуществлялось без добавления в среду HLDF: типичное строение с формированием гнезд, кластеров и трабекул, выраженный клеточный и ядерный полиморфизм, среди опухолевых клеток большое количество НДК (стрелками показаны крупные клетки с полиморфными, вариабельными по размеру и форме ядрами с заметными ядрышками); (б) культивирование которой осуществлялось с добавлением в среду HLDF: типичное строение с формированием гнезд, кластеров и трабекул, менее выраженный клеточный и ядерный полиморфизм, среди опухолевых клеток значительно меньшее количество НДК (стрелками показаны мелкие клетки с мономорфными мелкими ядрами с четким контуром и равномерным распределением хроматина). Окраска гематоксилином и эозином, ув. ×400.
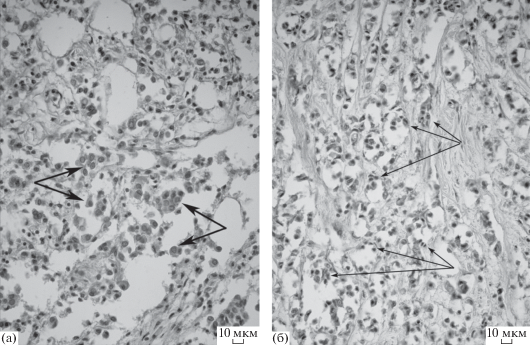
Таблица 1.
Данные морфометрического анализа образцов опухоли пациентов с инвазивной карциномой молочной железы неспецифического типа
| Признак/группа | Культивирование без HLDF n = 36 | Культивирование с HLDF n = 36 |
|---|---|---|
| Общее количество митозов на 1000 опухолевых клеток | 5.7 (3.0; 9.8) | 5.3 (2.1; 7.6) |
| Количество физиологических митозов на 1000 опухолевых клеток | 3.9 (2.1; 6,3) | 4.2 (1.7; 6.5) |
| Количество патологических митозов на 1000 опухолевых клеток | 2.0 (0.4; 3.7) | 0.9 (0.0; 2.7) |
| Общее количество опухолевых клеток на тестируемой площади | 1626.0 (1215.8; 2891.0) | 1857.0 (1482.0; 2776.5) |
| Содержание НДК относительно всех опухолевых клеток, в % | 13.7 (5.4; 21.9) | 3.2 (1.4; 5.3) р1–2 = 0.000001 |
| Содержание УДК относительно всех опухолевых клеток, в % | 70.0 (64.0; 78.4) | 67.6 (60.4; 76.4) |
| Содержание ВДК относительно всех опухолевых клеток, в % | 14.2 (7.2; 20.1) | 27.2 (16.9; 36.5) р1–2 = 0.00027 |
При изучении образцов опухолей, культивирование которых осуществлялось с добавлением в среду HLDF, обращал на себя внимание меньший клеточный и ядерный полиморфизм клеток опухоли, значительно реже выявлялись клеточные элементы, ядра которых имели укрупненные ядрышки (рис. 1б).
Добавление HLDF в среду влияло только на соотношение клеток с различной степенью дифференцировки, приводя к снижению относительного содержания НДК и увеличению относительного содержания ВДК. Следовательно, потенциально возможно применение HLDF в дифференцировочной терапии рака молочной железы.
Учитывая, что показатель ядерного полиморфизма является одним из критериев, определяющих степень злокачественности карциномы наряду со способностью к структурообразованию и митозами, было решено обратить более пристальное внимание именно на НДК, обладающих более выраженными признаками как ядерного полиморфизма, так и нарушения структурообразования. Был введен индекс влияния – ИВ HLDF НДК, который равен отношению относительного содержания НДК в образцах опухоли культивируемой без HLDF, к относительному содержанию НДК в образцах, культивируемых с HLDF.
Все пациенты были разделены на две группы – с высокой реакцией на HLDF, заключающейся в том, что относительное количество НДК уменьшилось в 1.6 и более раз и – с отсутствием, или низкой реакцией на HLDF ИВ HLDF НДК менее чем в 1.6 раза. В группу пациентов с высокой реакцией вошло 28 больных, ИВ HLDF НДК у них составил 6.06 (3.24; 11.68). В группу пациентов с низкой реакцией вошло 8 больных, ИВ HLDF НДК у них был равен 1.11 (0.88; 1.57). Морфометрическая оценка клеточного состава образцов опухолей, культивированных без добавления HLDF, показала, что относительное содержание НДК и ВДК отличается между группами, которые в дальнейшем характеризовались высокой или низкой реакцией на HLDF. Так, при высокой реакции клеточный состав опухоли был следующим: НДК – 17.36 (7.59; 23.38), ВДК – 10.13 (6.69; 15.72), а при низкой – НДК – 5.14 (2.36; 8.56), ВДК – 24.46 (13.85; 36.39), рНДК = 0.004, рВДК = = 0.015. Следовательно, высокая реакция клеток опухоли на HLDF связана с более высоким количеством НДК и с более низким количеством ВДК.
Анализ данных клинического обследования пациентов этих групп показал, что все 14 пациентов, имеющих метастазы в регионарные лимфатические узлы, относились к группе с высокой реакцией на HLDF, т.е. образцы наиболее агрессивных опухолей показали более сильную ответную реакцию на воздействие изучаемого фактора дифференцировки.
Таким образом, HLDF способствует приобретению НДК более высокой степени дифференцировки. Более выраженный эффект влияния HLDF наблюдается в более агрессивных формах неоплазий, дающих метастазы, что позволяет рассматривать фактор дифференцировки HLDF как кандидата для применения в дифференцировочной терапии злокачественных новообразований.
Список литературы
Kostanyan I.A., Astapova M.V., Starovoytova E.V., et all. A New Human Leukemia Cell 8.2 Kda Differentiation Factor: Isolation And Primary Structure // FEBS Lett. 1994. V. 356. № 2-3. P. 327–329. https://doi.org/10.1016/0014-5793(94)01306-3
Костанян И.А., Астапова М.В., Старовойтова Е.В. и др. Новый фактор дифференцировки из культуральной среды клеток линии HL-60, обработанных ретиноевой кислотой. Выделение и определение первичной структуры // Биоорган. химия. 1995. Т. 21. С. 243–248. (In Russ).
Sosnina A.V., Morozov D.V., Varaksin N.A., et all. Human leukemia differentiation factor (HLDF) controls the cytokine-producing function of blood cells in gastric adenocarcinomas // Dokl. Biol. Sci. 2014. V. 454. P. 72–74. https://doi.org/10.1134/S0012496614010207
Ковязин В.А., Щелокова Е.Е., Костанян И.А. и др. Проапоптотический фактор HLDF в нормальном, гиперпластическом и опухолевом эндометрии // Архив патологии. 2007. Т. 69. № 3. С.23–26.
Соснина А.В., Михайлова Е.С., Аутеншлюс А.И. и др. Классы и субклассы антител к фактору дифференцировки HLDF и пептидам гапонина, взаимосвязь их уровня с патогистологическими параметрами аденокарцином толстой кишки // Иммунология. 2012. Т. 33. № 2. С. 92–94.
Франк Г.А., Завалишиная Л.Э., Пожарисский К.М. Рак молочной железы. Практическое руководство для врачей. М.: Практическая медицина; 2014. (In Russ).
Elston C.W., Ellis I.O. Pathological prognostic factors in breast cancer. The value of histological grade in breast cancer: experience from a large study with long-term follow-up // Histopathology.1991. V. 19. № 5. P.403–410. https://doi.org/10.1111/j.1365-2559.1991.tb00229.x
Freeman A. E., Hoffman R. M. In vivo-like growth of human tumors in vitro // PNAS. 1986. V. 83. № 2694–2698. https://doi.org/10.1073/pnas.83.8.2694
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


