Доклады Российской академии наук. Науки о жизни, 2020, T. 495, № 1, стр. 590-597
ВАРИАБЕЛЬНОСТЬ И ФИЛОГЕНИЯ ПАРАЛОГОВ ФИТОИНСИНТАЗЫ PSY1 И PSY2 У РАЗЛИЧНЫХ ВИДОВЫХ КОМПЛЕКСОВ РОДА CAPSICUM
А. В. Щенникова 1, Е. А. Дьяченко 1, Г. И. Ефремов 1, М. А. Филюшин 1, *, Е. З. Кочиева 1
1 Институт биоинженерии, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
Москва, Россия
* E-mail: michel7753@mail.ru
Поступила в редакцию 01.06.2020
После доработки 04.07.2020
Принята к публикации 04.07.2020
Аннотация
Идентифицированы гомологи генов PSY1 и PSY2, кодирующие изоформы фитоинсинтаз у видов Capsicum – C. baccatum, C. chinense, C. frutescens, C. tovarii, C. eximium и C. chacoense. Выявлен высокий консерватизм функционально значимых областей фитоинсинтаз у анализируемых видов перца. Показано, что кластеризация видов перца только по PSY1 соответствует традиционной филогении, при этом C. eximium входит в комплекс Purple corolla, а C. chacoense равноудален от клад Annuum и Baccatum. Обнаружено отсутствие значимых отличий PSY1 и PSY2 желтоплодного C. chinense от фитоинсинтаз красноплодных образцов. Определено, что желтая окраска плода C. chinense может быть следствием низкой экспрессии PSY1 и повышенной транскрипции PSY2. Таким образом, продемонстрировано, что приобретенная окраска плода сохраняет строгие филогенетические ограничения, однако они могут быть преодолены в результате искусственного отбора на активность фитоинсинтазы PSY1.
Цветовая гамма окраски сочного плода существующих растений менее разнообразна, чем окраска цветков, но при этом очень широка и часто даже превосходит возможности человека по ее восприятию. Одна из наиболее документированных гипотез возникновения и адаптивного значения окраски основана на ее роли в привлечении животных для распространения семян, так как отражательная способность плода, к примеру, в красной части спектра увеличивает хроматический контраст с листьями и позволяет визуально ориентированным птицам обнаружить спелые плоды [1]. Млекопитающие оказывают более слабое избирательное давление, чем птицы, так как используют предпочтительно осязание или обоняние, при этом трихроматическое цветовое зрение (способность отличать красный от зеленого) приматов могло возникнуть как адаптация для обнаружения красных плодов [1].
Две другие известные гипотезы о причинах разнообразия окраски плодов предполагают, что она определяется: (1) филогенетическими ограничениями и строго сохраняется внутри таксономических единиц разного порядка; (2) адаптивной реакцией растения на абиотические факторы, когда отражательная способность плода и листа сходна и обусловлена светоотражающими пигментами [1]. Так, содержание каротиноидов в сочных плодах-ягодах видов Vaccinium меняется в зависимости от климатической зоны произрастания, что указывает на важность фотозащиты не только для листьев, но и для плодов [2].
Одной из моделей для исследования адаптивного разнообразия окраски плода может служить перец Capsicum, который относится к семейству Solanaceae и объединяет более 35 видов [3]. Пять видов Capsicum одомашнены и культивируются во всем мире (C. annuum, C. chinense и C. frutescens) или преимущественно в Латинской Америке (C. pubescens и C. baccatum). Эти и еще несколько близкородственных видов образуют отдельную филогенетическую кладу, представители которой отличаются от других видов Capsicum количеством хромосом (2n = 24) и красной окраской плода [3]. Плоды дикорастущих образцов этих видов распространяются исключительно птицами [4]. Спелые плоды сортов перца, благодаря влиянию доместикации и искусственного отбора, кроме традиционно красной, могут иметь желтую, оранжевую, розовую, цвета слоновой кости и фиолетовую окраску [5]. Пигментация определяется содержанием и соотношением каротиноидов, хлорофиллов и антоцианов, при этом в неспелых плодах доминируют хлорофиллы, а в спелых – каротиноиды [5].
Каротиноиды представляют собой группу разнообразных природных пигментов, которые участвуют в фотосинтезе и выработке фитогормонов и сигнальных молекул для роста, развития и защиты растений [2, 6]. Биосинтез каротиноидов осуществляется на мембранах пластид – хлоропластов, хромопластов и амилопластов [5]. В процессе созревания плода перца хлоропласты замещаются хромопластами, в которых формируются глобулы для накопления синтезируемых каротиноидов, и плод начинает менять зеленую окраску на желтую, оранжевую или красную в зависимости от соотношения типов каротиноидов [7]. В красных плодах перца каротиногенез идет до образования ксантофиллов – капсантина и капсорубина [8].
Первым этапом синтеза каротиноидов является конденсация двух молекул геранилгеранилпирофосфата при участии фитоинсинтазы PSY с образованием фитоина в активном центре PSY [7]. Накопление и активность PSY в хромопластах модулируются на посттрансляционном уровне шаперонными белками Orange и Hsp70 в координации со стромальным Clp-протеазным комплексом [7].
У растений известно от одной до трех изоформ PSY, гены которых различаются по специфичности их транскрипции к различным органам и тканям, а также ролью в процессах развития [6]. У сортов Capsicum на сегодняшний день известно две изоформы с преимущественной локализацией в пластидах листа (PSY2) и плода (PSY1) [5, 8]. Предполагается, что начало использования первичных каротиноидов в качестве вторичных метаболитов было адаптивным для многих видов [9]. Конвергентные дупликации гена PSY, специфичного для фотосинтезирующих тканей, с последующей диверсификацией функции могли способствовать эволюции тканеспецифичного каротиногенеза, индивидуального как для фотосинтезирующих, так и для нефотосинтезирующих органов [9].
Целью данного исследования стала идентификация и характеристика генов PSY1 и PSY2, кодирующих две изоформы фитоинсинтазы у видов Capsicum, включая оценку их межвидовой вариабельности и филогении. В работе были использованы образцы шести видов Capsicum – одомашненных C. baccatum (сорт Визирь), C. chinense (сорт Жгучий король) и C. frutescens (сорт Tabasco), и дикорастущих C. tovarii, C. eximium и C. chacoense (табл. 1). Данные виды охватывают пять из шести выделяемых субклад красноплодных перцев. Зрелые плоды выбранных образцов имеют красную окраску, за исключением образца C. chinense сорт Жгучий король, спелый плод которого темно-желтый.
Таблица 1.
Характеристики гомологов генов PSY1 и PSY2 у видов Capsicum
| Вид Capsicum (сорт/ NCBI ID/ каталожный номер) | Ген | Ген/кДНК (п. н.)/ белок, а. о. | Замещения а. о.** | PSY2 vs. PSY1*** | |
|---|---|---|---|---|---|
| общие | специфические | ||||
| C. baccatum L. (PBC81; CM008446.1:19444825-19449400 / CM008444.1:141318038-141337266)* | PSY1 | 2846/1260/419 | V40G, C59W, R91Q, D194G | A92T, V93M, K105R, D119E, P124K, V127P, L128I, N131T, G143S, L158M, D163E, R166K, Q193A, I205V, R224K, V236I, W224R, M249L, I315V, G329D, Q358E, A364T, S368A, K383R, R398K, L409I, T410A, R417K, P422-S427del, L429del | E121D, A200G |
| PSY2 | 2994/1299/432 | V15F, G60D, D65G, Q113H | |||
| C. baccatum L. (Визирь / MT507259; MT507265) |
PSY1 | 2846/1260/419 | V40G, R91Q, D194G | E121D, A200G | |
| PSY2 | 2994/1299/432 | ||||
| C. chinense Jacq. (PI159236; CM008434.1:12099868-12105776 / CM008432.1:150147614-150156089)* | PSY1 | 2844/1260/419 | E121D | ||
| PSY2 | 2998/1299/432 | ||||
| C. chinense Jacq. (Pimenta da Neyde / MT313936; MT313941) |
PSY1 | 2885/1260/419 | E121D | ||
| PSY2 | 2998/1299/432 | ||||
| C. chinense Jacq. (Жгучий король / MT507261; MT507267) | PSY1 | 2844/1260/419 | D13E, R62G | E121D | |
| PSY2 | 2998/1299/432 | M39T, M249L, T430A | |||
| C. frutescens L. (Tabasco / MT507262; MT507268) | PSY1 | 2858/1260/419 | D13E, R62G | S219C | |
| PSY2 | 2991/1296/431 | M39T, S426C | |||
| C. frutescens L. (Самоцвет / MT313935; MT313940) | PSY1 | 2844/1260/419 | A40G, C59W | E121D | |
| PSY2 | 2985/1299/432 | M39T, N186T, T430A | |||
| C. tovarii Eshbaugh, P.G.Smith & Nickrent (MT507260; MT507266) | PSY1 | 2858/1260/419 | V40G, C59W, T65S, R91Q, D115E, S213C | S219C | |
| PSY2 | 2991/1296/431 | G60D, D65G, S428del | |||
| C. eximium Hunz. (MT507263; MT507269 / TGRC cat. # 21502) | PSY1 | 2857/1260/419 | V40G, R91Q, A187T | E121D, Q193T | |
| PSY2 | 2980/1299/432 | T430A | |||
| C.chacoense Hunz. (MT507264; MT507270 / TGRC cat. # 21572) | PSY1 | 2841/1260/419 | R91Q, A328S | E121D, A334S | |
| PSY2 | 2962/1299/432 | G60D, D65G, A390S | |||
Последовательности гомологов PSY1 и PSY2 амплифицировали на геномной ДНК образцов анализируемых видов с ранее разработанными нами праймерами (CaPSY1F 5’-TCAGAATGTCTGTTGCCTTG-3’, CaPSY1R 5’-TCCTGATTTCATGTTCTTGTAGA-3’; CaPSY2F 5’-AGCATGTCTGTTGCTTTGTTG-3’, CaPSY2R 5’-CTTCATTCATGTCTTTGYTAGTG-3’)
(полимераза LongAmp® Hot Start Taq DNA Polymerase, New England Biolabs, USA; условия: 94°C 10 мин, 36 циклов (94°C 40 с, 56°C 40 с, 65°C 4 мин), 65°C 7 мин). Полученные последовательности секвенировали (ABI Prism 3730 DNA Analyzer, Applied Biosystems, USA) и анализировали (MEGA 7.0, https://www.megasoftware.net/, NCBI-CDD, http://www.ncbi.nlm.nih.gov/; PROVEAN, http://provean.jcvi.org/).
Для каждого из исследуемых видов перца были определены полногеномные последовательности (начиная с ATG) PSY1 и PSY2, полиморфизм которых оценивали в сравнении с C. annuum (cv. Zunla 1) PSY1 (Gene ID: 107868281) и PSY2 (Gene ID: 107859651). Кроме идентифицированных PSY1 и PSY2 видов перца, из NCBI с помощью BLAST-n были извлечены геномные последовательности PSY1 и PSY2 C. baccatum (isolate PBC81) и C. chinense (isolate PI159236). Также, для сравнительного анализа были использованы полученные ранее последовательности PSY1 и PSY2 видов C. chinense (сорт Pimenta da Neyde) и C. frutescens (сорт Самоцвет).
Размер генов PSY1 и PSY2 варьировал (табл. 1), и между собой гомологи различались 142 (5.90%) и 107 (3.57%) SNPs, четверть которых – 38 (26.76%) и 26 (24.30%) – находилась в кодирующей части PSY1 и PSY2, состоящей из 6 экзонов. Самыми вариабельными оказались экзоны I и III у PSY1 – 20 и 11 (52.63% и 28.95% всех экзонных замен) и I и VI у PSY2 – 14 и 8 (53.85% и 30.77%).
Кодируемые белки PSY1 и PSY2 исследуемых видов перца имели размер 419 и 432 а. о., соответственно, кроме PSY2 C. tovarii и C. frutescens сорт Tabasco (431 а. о.) (табл. 1). Все они входили в суперсемейство ферментов биосинтеза изопреноидов и содержали консервативный домен head-to-head (HH)-IPPS (PSY1, 81–418 а. о.; PSY2, 86–435 а. о.) с функционально значимыми участками, не имеющими каких-либо полиморфизмов (рис. 1). На N-конце белков был предсказан транзитный пептид с инвариантным сайтом расщепления (PSY1 – V/Q, 74 а. о., PSY2 – V/N, 80 а. о.) (рис. 1), ответственный за транслокацию ферментов в пластиды [10]. Белки PSY1 и PSY2 содержали 13 и 12 замещений а. о. соответственно (табл. 1). Последовательности PSY1 были идентичны PSY2 на 82%; основные различия заключались в двух вставках (S58LNAG(D)LRY65; S426SS(-)LAK(N)T432) у PSY2 и одной (D32SS34) – у PSY1 (рис. 1).
Рис. 1.
Сравнительное выравнивание последовательностей идентифицированных гомологов PSY1 и PSY2 образцов видов Capsicum. P1 – PSY1, P2 – PSY2, Cexi – C. eximium, Ctov – C. tovarii, Ccha – C. chacoense, Cchi – C. chinense (Жгучий король), Cfru_Tab – C. frutescens (Tabasco), Cbac – C. baccatum (Визирь). Розовый фон – аспартат-богатые субстрат Mg2+-связывающие сайты (DXXXD), светло-зеленый – активный сайт, синие и красные стрелки – каталитические а. о. и субстрат-связывающие карманы, зеленая стрелка – сайт расщепления транзитного пептида, рамкой – остатки, важные для уровня активности PSY1 и PSY2.
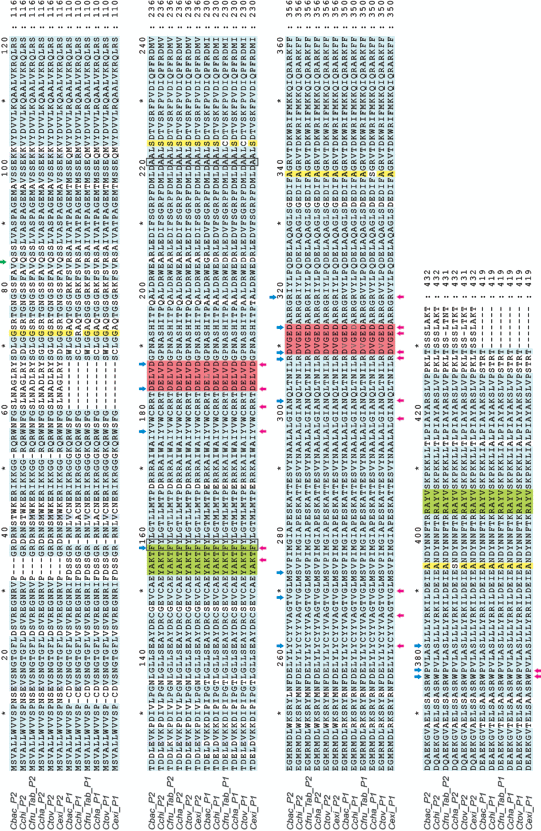
Выявленный консерватизм функционально-значимых участков предполагает корректный фолдинг зрелой части всех идентифицированных фитоинсинтаз PSY1 и PSY2 видов перца, а также способность взаимодействовать с правильными белковыми партнерами и осуществлять предписанные каталитические функции. Сопоставимое количество замещений а. о. в последовательностях PSY1 и PSY2 предполагает ко-эволюцию генов, кодирующих эти изоформы, а N-концевые индели в области транзитного пептида PSY1 и PSY2 могут определять специфичность транслокации ферментов (хлоропласты или хромопласты).
Между консервативными доменами анализируемых гомологов PSY1 и PSY2 было найдено 33 замещения а. о. и две делеции, в том числе замещения, специфичные (в сравнении с C. annuum) для образцов вида C. baccatum (A200G) и для всех анализируемых образцов (E121D), за исключением C. frutescens (Tabasco) и C. tovarii. Ранее для видов и сортов томата было показано, что существуют два замещения а. о., которые определяют различия в уровне активности между фитоинсинтазами PSY1 и PSY2, а именно, замещения N136Y и G198A в последовательности PSY1 приводили к существенному росту активности фермента, которая становилась сопоставима с эффективностью PSY2 [10]. Кроме того, остаток фенилаланина F135 по соседству с тирозином Y136 значительно повышал каротиногенную активность PSY2 томата [10]. Интересно, что все исследуемые гомологи не только PSY2, но и PSY1 видов перца, имели в позиции, соответствующей N136Y томата, остаток тирозина, соседствующий с фенилаланином (F147Y148 и F153Y154, соответственно), а в позиции, соответствующей G198A томата, – остаток аланина (A210 и A216 соответственно) (рис. 1). Это подтверждает то, что мутация Y136N могла возникнуть у PSY1 томата при эволюционном разделении родов Capsicum и Solanum, которое произошло предположительно 19 млн лет назад [11], и до расхождения генома томата и картофеля [10]. Также, это говорит о том, что эффективность фитоинсинтаз PSY1 и PSY2 видов перца в каротиногенезе может иметь сопоставимый уровень, что должно обеспечивать не только достаточную фотозащиту растений, но и высокое содержание каротиноидов в перикарпе плода перца и соответствующую яркую окраску.
Был проведен филогенетический анализ, основанный на сравнении кодирующих последовательностей PSY1 и PSY2 видов Capsicum в сравнении с другими видами растений. На полученной дендрограмме отдельные клады сформировали PSY-последовательности Amborella trichopoda (общепринятого предшественника всех двудольных) и однодольных Zea mays и Oryza sativa (рис. 2). Гомологи PSY1 и PSY2 Solanaceae сгруппировались в два больших кластера, базальную ветвь к которому занял PSY Arabidopsis thaliana (рис. 2). Внутри каждого кластера виды Solanaceae легли в соответствии с филогенией основных родов [11].
Рис. 2.
Филогения видов перца, основанная на кодирующих последовательностях гомологов PSY1 и PSY2, изучаемых образцов видов перца (MEGA 7.0, метод ближайших соседей, модель Kimura 2, бутстрэп 1000). Для сравнения использованы последовательности PSY1 и PSY2 C. annuum cv. Zunla-1 (NC 029980.1:c205334820-205328571; NC 029978.1:142877052-142881261), C. chinense isolate PI159236 (CM008434.1:12099868-12105776; CM008432.1:150147614-150156089), C. baccatum isolate PBC81 (CM008446.1:19444825-19449400; CM008444.1:141318038-141337266), Solanum melongena (RGBGZ01079994.1; RGBGZ01072332.1), S. tuberosum (XM 006343240.2; XM 015309093.1), S. lycopersicum cv. Red Setter (EF534740.1; EU021055.1), Nicotiana tomentosiformis (XM 009588947.3), N. tabacum (XM 016644373.1; HM345582.1), Arabidopsis thaliana (NM 001343484.1), Amborella trichopoda (XM 006853316.3, XM 011629187.2), Zea mays (NM 001114652.2; NM 001114645.1; XM 020541422.1), Oryza sativa (AJ715786.1; AK073290.1), Picea sitchensis (EF676374.1).

Примечательно, что образцы видов перца только в случае PSY1 разместились на дендрограмме в соответствии с показанной для них ранее филогенией [12, 13] (рис. 2). Это может быть связано с тем, что классификация видов перца основана большей частью на морфологических характеристиках, в том числе плода, с окраской которого связана активность PSY1 [3]. В PSY1-кластере базальная ветвь представлена C. eximium, относящимся к кладе Purple corolla. Далее следует C. tovarii (Tovarii clade), объединившийся с C. frutescens (сорт Tabasco). Самый эволюционно молодой – субкластер, состоящий из группы образцов клад Baccatum, Annuum (C. annuum, C. frutescens (Самоцвет) и C. chinense), и вида C. chacoense (рис. 2).
В случае PSY2 базальная ветвь также представлена C. eximium, при этом кластеризации образцов по видам и кладам не наблюдается (рис. 2).
Расположение C. eximium на дендрограмме (кластер PSY1) соответствует работам, в которых C. eximium считается отдельным видом или входит в комплекс Purple corolla вместе с видами C. pubescens, C. cardenasii и C. tovarii [3] (рис. 2).
Интересно расположение вида C. chacoense между образцами клад Annuum и Baccatum (рис. 2). Существуют разные мнения по поводу филогении C. chacoense. Так, этот вид считают наиболее близким кладам Purple corolla или Baccatum, либо приписывают равное родство с Annuum, Baccatum и Pubescens и говорят о том, что C. chacoense может быть предшественником трех основных групп Capsicum [3]. Полученная нами дендрограмма наиболее согласуется с последней гипотезой.
Ранее было показано, что видам клады Annuum соответствует непропорционально большое количество генов, прошедших позитивную селекцию в процессе диверсификации рода Capsicum, что, вероятно, отражает сотни лет искусственного отбора, которым подвергались эти виды, в том числе, для улучшения качественных характеристик плода, включая окраску [3, 5]. В изучаемую выборку образцов видов, которые в норме должны формировать красные плоды, был включен желтоплодный образец – C. chinense (Жгучий король). Анализ PSY1 и PSY2 C. chinense показал отсутствие каких-либо значимых структурных отличий от фитоинсинтаз красноплодных образцов.
Оценка содержания хлорофиллов и каротиноидов (проведена согласно [8]) в перикарпе плода желтоплодного C. chinense и красноплодного C. baccatum (Визирь) показала, что суммарные количества хлорофиллов/каротиноидов в неспелых зеленых плодах этих образцов сопоставимы – 36.69/12.02 и 38.17/10.44 мкг/г сырой массы соответственно. В спелых плодах C. baccatum/C. chinense содержание хлорофиллов значительно снизилось (1.52/4.60 мкг/г), в то время как содержание каротиноидов в красных плодах C. baccatum повысилось в 5 раз (51.05 мкг/г), а в желтых плодах C. chinense (13.63 мкг/г) не изменилось.
Определение профиля экспрессии PSY1 и PSY2 (проведено согласно [8]) в перикарпе неспелых и спелых плодов образцов C. baccatum и C. chinense обнаружило транскрипты обоих генов во всех анализируемых тканях (рис. 3).
Рис. 3.
Профиль экспрессии PSY1 и PSY2 в листьях (L) и плодах (неспелых (MF); бланжевых (IR); спелых (RF)) образцов видов C. chinense (сорт Жгучий король) и C. baccatum (Визирь). Значения транскрипции генов, достоверно различающиеся (рvalue < 0.05) от такового во всех других тканях одного образца, отмечены звездочками.
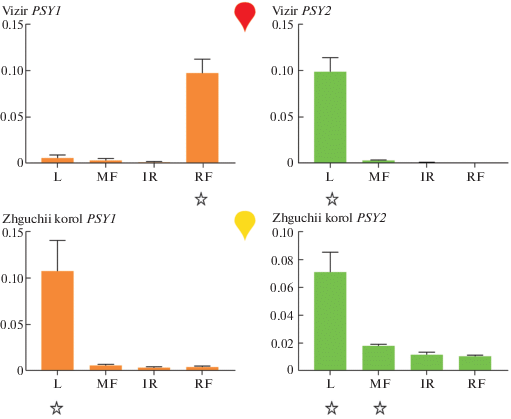
В спелом плоде уровень экспрессии PSY1 был значительно выше (~в 10 раз) у C. baccatum в сравнении с C. chinense, тогда как для PSY2 наблюдалась противоположная картина. Можно предположить, что темно-желтая окраска плода C. chinense вызвана пониженным уровнем экспрессии PSY1 и повышенной транскрипцией PSY2, для которого ранее была показана способность частично возмещать дефицит PSY1 в хромопластах [14]. Замена традиционной для вида красной пигментации спелого плода на желтую наглядно демонстрирует последствия искусственной селекции сортов перца и может быть приобретенным следствием различий в транскрипционной или посттрансляционной регуляции активности PSY1, как это было показано для томата [5, 7].
Адаптационная эволюция видов перца связана со способностью растения к защите от фото-стресса в фотосинтезирующих тканях, в том числе за счет каротиноидов как первичных метаболитов, синтез которых опосредован PSY2 [1, 3]. Дальнейшая эволюция видов перца направлена на повышение эффективности распространения семян, с чем связано приобретение плодами красной окраски и использования каротиноидов как накапливаемых вторичных метаболитов [1, 3]. Появление вторичного каротиногенеза перца может быть связано с дупликацией PSY-предшественника и неофункционализацией дупликата – гена PSY1, кодирующего изоформу фитоинсинтазы, специфичную для хромопластов. В пользу данного предположения говорит полученная нами филогения видов Capsicum, где современной таксономии соответствует разделение, основанное именно на PSY1, но не на PSY2. Таким образом, приобретенная окраска плода сохраняет строгие филогенетические ограничения, однако искусственный отбор (селекция сортов одомашненных видов) может преодолеть их, в том числе с помощью изменения активности PSY1.
Список литературы
Valenta K., Kalbitzer U., Razafimandimby D., et al. // Sci. Rep. 2018. V. 8. P. 14302.
Karppinen K., Zoratti L., Sarala M., et al. // BMC Plant Biol. 2016. V. 16. Article 95.
Carrizo García C., Barfuss M.H., Sehr E.M., et al. // Ann. Bot. 2016. V. 118. P. 35–51.
Levey D.J., Tewksbury J.J., Cipollini M.L., Carlo T.A. // Oecologia. 2006. V. 150. P. 61–68.
Berry H.M., Rickett D.V., Baxter C.J., et al. // J. Exp. Bot. 2019. V. 70. P. 2637–2650.
Stauder R., Welsch R., Camagna M., et al. // Front. Plant Sci. 2018. V. 9. Article 255.
D'Andrea L., Rodriguez-Concepcion M. // Front. Plant Sci. 2019. V. 10. Article 1071.
Филюшин М.А., Джос Е.А., Щенникова А.В., Кочие-ва Е.З. // Физиология растений. 2020. Т. 67. № 6. С. 644–653.
Busch M., Seuter A., Hain R. // Plant Physiol. 2002. V. 128. P. 439–453.
Cao H., Luo H., Yuan H., et al. // Plant Physiol. 2019. V. 180. P. 1988–2003.
Särkinen T., Bohs L., Olmstead R.G., Knapp S. // BMC Evol. Biol. 2013. V. 13. Article 214.
González-Pérez S., Garcés-Claver A., Mallor C., et al. // PLoS One. 2014. V. 9. Article e116276.
Lee H.Y., Ro N.Y., Jeong H.J., et al. // BMC Genet. 2016. V. 17. Article 142.
Jang S.J., Jeong H.B., Jung A., et al. // J. Exp. Bot. 2020. Article eraa155.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


