Доклады Российской академии наук. Науки о жизни, 2021, T. 496, № 1, стр. 94-98
ТЕРМОВАКЦИНАЦИЯ – ТЕРМОГЕЛИОКС КАК СТИМУЛЯТОР ИММУННОГО ОТВЕТА. КИНЕТИКА СИНТЕЗА АНТИТЕЛ И С-РЕАКТИВНОГО БЕЛКА ПРИ КОРОНАВИРУСНОЙ ИНФЕКЦИИ
Член-корреспондент РАН С. Д. Варфоломеев 1, 5, С. В. Журавель 2, А. А. Панин 3, Л. В. Шогенова 4, В. И. Быков 5, С. Б. Цыбенова 5, *, А. М. Рябоконь 5, 6, И. И. Уткина 2, П. В. Гаврилов 2, А. Г. Чучалин 4
1 Московский государственный университет
имени М.В. Ломоносова, Институт физико-химических основ функционирования сети нейронов и искусственного интеллекта
Москва, Россия
2 Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского
Москва, Россия
3 ООО “Медтехинновации”
Москва, Россия
4 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Москва, Россия
5 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
6 Московский государственный университет
имени М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: s.tsybenova@gmail.com
Поступила в редакцию 06.10.2020
После доработки 15.10.2020
Принята к публикации 16.10.2020
Аннотация
Показана высокая эффективность использования термогелиокса (ингаляции высокотемпературной смесью гелия и кислорода) при лечении пациентов, пораженных COVID-19. Экспериментально исследована динамика накопления IgG, IgM и С-реактивного белка (СРБ) у больных с коронавирусной инфекцией в “рабочей” и контрольной группах. Показано, что термогелиокс интенсифицирует синтез антител IgG, IgM и СРБ, при этом элиминирует период индукции на кинетических кривых синтеза специфических антител в форме IgG и переводит в быструю фазу синтез СРБ. Результаты эксперимента подтверждают полученные ранее данные на основе анализа кинетической модели развития коронавирусной инфекции в организме человека.
Борьба с коронавирусной инфекцией – чрезвычайно острая проблема, требующая разработки новых методов, расширяющих диапазон возможностей современной терапии и профилактики [1]. Применяемые в настоящее время антивирусные и общеукрепляющие терапевтические средства зачастую недостаточно эффективны и приводят к глубокому поражению многих систем организма и часто к смерти пациента [2]. Большие надежды возлагаются на создание синтетических вакцин, действующих на уровне синтеза антител, специфически взаимодействующих с теми или иными белками вируса.
Нами разработана новая методика борьбы с коронавирусным поражением организма, основанная на использовании термогелиокса (ингаляции высокотемпературной смесью гелия и кислорода). Проведены клинические испытания на базе отделения реанимации и интенсивной терапии НИИ скорой помощи им. Н.В. Склифосовского. В клинику поступали пациенты средней и высокой тяжести поражения коронавирусом (20–50% поражения легких). Подавляющее большинство больных имеют сопутствующие заболевания: артериальная гипертония различной степени, хронический обструктивный бронхит, ХОБЛ, ишемическая болезнь сердца, атеросклероз нижних конечностей, бронхиальная астма, язвенная болезнь желудка и др. Результаты клинических испытаний в высшей степени положительны. Как правило, на 2–3-и сутки использования термогелиокса с применением медицинского аппарата “Гелиокс-экстрим” (ООО “Медтехинновации”) у пациента не обнаруживается вирус, определяемый по стандартной методике полимеразной цепной реакции (ПЦР), и возникает устойчивый антительный ответ. Эти эффекты были предсказаны на основе кинетической модели, включающей динамику роста и размножения вируса в организме, динамику поражения вирусом клеток-реципиентов, эффекты термодеструкции вирусов и динамику антительного ответа. Теоретический анализ предсказывает потенциальные эффекты термовакцинации – выработку антител на белки разрушенных вирусных частиц [3–5].
На основе изучения белкового состава конденсата выдыхаемого воздуха пациента показана безопасность применения термогелиокса [6, 7]. Нами проведено экспериментальное исследование кинетики накопления специфических антител (IgG, IgM) у пациентов, пораженных коронавирусом. В исследование были включены 60 пациентов с COVID-19, поделенные на две равные группы. В первую (“рабочую”) группу (N = 30) вошли пациенты, которым в стандартный протокол лечения COVID-19 была включена терапия термогелиоксом, во вторую (контрольную) группу 2 (N = 30) – пациенты, получавшие стандартную терапию согласно временным методическим рекомендациям Минздрава России.
Из 60 пациентов, включенных в исследование, 28 (46.7%) были медицинскими работниками. В “рабочей” группе соотношение мужчины/женщины – 17/13, а в контрольной группе – 16/14 соответственно. В обеих группах пациенты были сопоставимы по полу, p – 0, 403 – точный критерий Фишера. Средний возраст пациентов в исследовании составлял 56.7 года (45 лет; 61 год). При этом в “рабочей” группе – 58 лет (45 лет; 59.5 года), а в контрольной – 55 лет (46 лет; 66 лет). Пациенты были сопоставимы по возрасту, p – 0.537 (критерий Манна–Уитни). Объем поражения легких на момент включения в исследование составлял: в “рабочей” группе – 25.2% (21%, 42.5%), в контрольной – 26% (25%, 41.7%). При этом средняя длительность заболевания в “рабочей” группе составляла 2 дня (1 и 4), в контрольной – 3 дня (1 и 5). Общая характеристика клинических симптомов пациентов обеих групп включала в себя: ощущение потери обоняния и вкуса, насморк, чувство нехватки воздуха, одышку, слабость, повышение температуры, головную боль, боль в мышцах и в горле, сухой кашель.
Лечение пневмонии, вызванной вирусом SARS – CoV 2, проводили всем пациентам, включенным в протокол исследования № 11–20 от 20.04.2020, одобренный этическим комитетом по биомедицинской этике НИИ СП им. Н.В. Склифосовского ДЗМ, в период с 21 апреля по июнь 2020 года включительно.
Всем пациентам проводили забор мазка со слизистой полости носа и ротоглотки для выявления РНК коронавируса SARSCoV-2 методом ПЦР (детектирующий амплификатор CFX-96 “REAL TIME” (Bio-Rad, США)) [8–10]; компьютерная томография (КТ) легких [11]; забор венозной крови для анализа содержания иммуноглобулинов IgG (п/кол.) и IgM (п/кол.) к шиповому S-белку поверхности коронавируса SARS-CoV-2 по стандартной методике иммуноферментного анализа (ИФА) (иммунохемилюминесцентный анализатор, Mindray 6000, США) [10]. ИФА-тестирование на наличие IgG помогает детектировать контакт иммунной системы организма с вирусом, если с момента заражения прошло 2 нед.
Статистическая обработка полученных данных проводилась с использованием программного пакета SPSS 17.0 (SPSS Inc., USA). Использовались методы непараметрической статистики с применением U-критерия Манна–Уитни (сравнение 2 независимых переменных), точный критерий Фишера. Различия считались статистически значимыми при p <0.05.
На рис. 1 представлена динамика изменения количества пациентов в контрольной и “рабочей” группах с положительным тестом РНК коронавируса SARSCoV-2 по времени. В “рабочей” группе отмечалось статистически достоверное снижение количества пациентов с положительным тестом РНК коронавируса SARSCoV-2. По нашим наблюдениям, в “рабочей” группе больных COVID-19, получавшей ингаляции термогелиоксом, отрицательный результат ПЦР определялся на третий день, а у некоторых больных отрицательный результат определялся уже в первые сутки после начала терапии. На фоне стандартной терапии в контрольной группе положительная реакция на РНК коронавируса выявлялась от семи дней до четырех недель с начала заболевания, в отдельных случаях и дольше (рис. 1).
Полученные результаты демонстрируют, что использование термогелиокса эффективно стимулирует синтез антител, как типа иммуноглобулина G, так и типа иммуноглобулина M. В клинику поступает часть больных с уже сформировавшимся высоким уровнем IgG и IgM. Как в “рабочей”, так и в контрольной группе таких больных около 25%. Для кинетического анализа оказались пригодны данные с полным набором измерения уровня антител (4 измерения: при поступлении, на 3-и, 7-е сутки и при выписке). На рис. 2 и 3 приведены экспериментальные данные по динамике накопления IgG в контрольной (рис. 2) и “рабочей” группе (рис. 3). Видно принципиальное различие в кинетике иммунного ответа.
Рис. 2.
Динамика накопления IgG к шиповому S-белку поверхности коронавируса SARS-CoV-2 в контрольной группе при стандартном лечении (приведены типичные кривые).

Рис. 3.
Динамика накопления IgG к шиповому S-белку поверхности коронавируса SARS-CoV-2 в “рабочей” группе при лечении термогелиоксом (приведены типичные кривые).
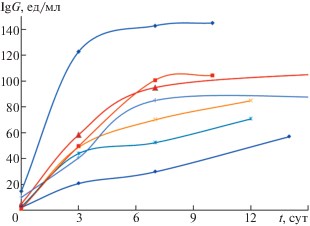
При лечении пациентов контрольной группы без использования ингаляций термогелиоксом в течение первых трех суток синтез антител IgG практически блокирован (период индукции на кинетической кривой накопления IgG). Использование термогелиокса (4 ингаляционных процедур по 15 мин с 15-минутным перерывом) пациентам “рабочей” группы элиминирует период индукции и включает синтез иммуноглобулина G с первого момента применения процедуры. Следует отметить, что приблизительно 30% пациентов поступают в клинику с уже завершенным этапом активации иммунного ответа (на кинетических кривых накопления IgG не наблюдается период индукции).
Термогелиокс также стимулирует образование IgM. Различия в кинетике накопления IgM в “рабочей” и контрольной группе не столь значительны, как в случае IgG. Термогелиокс заметно стимулирует накопление IgM на начальном этапе развития процесса. Например, среднее значение IgM(3)/IgM(0) для всей совокупности данных для пациентов, прошедших ингаляцию термогелиоксом, равно 4.1, а для контрольной группы – 3.2.
Полученные результаты по динамике синтеза иммуноглобулинов IgG и IgM однозначно демонстрируют, что применение термогелиокса при лечении поражения коронавирусной инфекцией приводит к активации иммунной системы и стимулирует образование специфических антител.
Иммунный ответ организма имеет сложный характер, при этом включаются различные биохимические системы организма [12, 13]. В частности, С-реактивный белок (СРБ) рассматривается как один из компонентов сложной цепи биохимических процессов, одним из первых реагирующих на бактериальную и вирусную инфекцию. Синтез СРБ индуцируется цитокинами и разрушением легочных тканей [14, 15]. Нами исследована сравнительная динамика накопления и уменьшения СРБ в процессе стандартного лечения и лечения с участием ингаляций термогелиоксом. Обнаружено принципиальное отличие в динамике ответа (рис. 4).
Рис. 4.
Динамика изменения содержания СРБ в крови пациентов контрольной (кривые с максимумом) и “рабочей” (экспоненциальное падение) групп (результаты эксперимента нормированы на показатель СРБ0 при поступлении пациента (t = 0)).
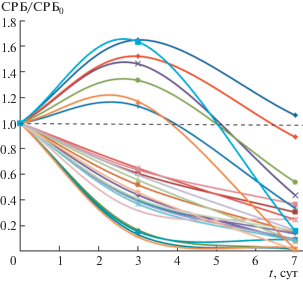
Видно, что при “нормальном” течении болезни в контрольной группе в большинстве случаев происходит относительно медленное накопление СРБ, достигающее максимального значения на 2–4-е сутки лечения (рис. 4, кривые выше пунктирной линии). Последующий процесс лечения в динамике характеризуется уменьшением СРБ до нуля. Ингаляция термогелиоксом в “рабочей” группе стимулирует быстрое накопление СРБ с переходом системы с самого начального периода к экспоненциальному уменьшению уровня СРБ (рис. 4, кривые ниже пунктирной линии). Среднестатистически применение термогелиокса уменьшает время пребывания пациента в больнице на 2–2.5 дня.
Стимулирование иммунного ответа термогелиоксом можно определить термином “термовакцинация”. Нами экспериментально показано, что на 2–3-и сутки использования термогелиокса в большинстве случаев организм освобождается от вирусных частиц по результатам ПЦР анализа. Мы предполагаем, что ускоренная выработка антител происходит, по-видимому, на белки-продукты термодеструкции вирусных частиц в легких пациентов. Таким образом, в обсуждаемом нами случае имеет место “классическая” вакцинация ослабленным или разрушенным антигеном. Принципиально положительное отличие заключается в том, что процесс идет in vivo с участием естественных вирусных белков, и “термовакцинация” может иметь широкий спектр специфичности.
Механизм наблюдаемого нами эффекта стимуляции иммунного ответа термогелиоксом требует дальнейшего исследования. Развитая и исследованная нами кинетическая модель [3–5] объясняет наблюдаемые эффекты увеличением концентрации антигена при термодеструкции вируса.
Впервые обнаруженные и описанные нами эффекты “термовакцинации” при лечении коронавирусного поражения – стимуляция иммунного ответа термогелиоксом – могут иметь общий характер и быть применены при лечении поражения вирусами другой природы.
Список литературы
Zhou P., Yang X.L., Wang X.G., et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin // Nature. 2020. V. 579. № 7798. P. 270–273. https://doi.org/10.1038/s41586-020-2012-7
Martinez M.A. Clinical trials of repurposed antivirals for SARS-CoV-2 // Antimicrob. Agents Chemother. 2020. V. 64, № 9. e01101-20. https://doi.org/10.1128/AAC.01101-20
Варфоломеев С.Д., Панин А.А., Быков В.И., и др. Кинетическая модель развития острой вирусной инфекции в организме человека. Критические условия, механизмы управления, термогелиокс // Известия РАН, Серия химическая. 2020. Т. 69. № 6. С. 1179–1184. https://doi.org/10.1007/s11172-020-2886-4
Варфоломеев С.Д., Панин А.А., Быков В.И., и др. Термовакцинация, термогелиокс как стимулятор иммунного ответа. Кинетическая модель развития процесса. // Известия РАН, Серия химическая. 2020. Т. 69. № 9. С. 1811–1815. https://doi.org/10.1007/s11172-020-2966-5
Varfolomeev S.D., Panin A.A., Bykov V.I., et al. Chemical kinetics of the development of coronaviral infection in the human body: Critical conditions, toxicity mechanisms, “thermoheliox”, and “thermovaccination” // Chemico-Biological Interactions. 2020. V. 329. P. 109209. https://doi.org/10.1016/j.cbi.2020.109209
Варфоломеев С.Д., Панин А.А., Рябоконь А.М., и др. Протеом конденсата выдыхаемого воздуха при воздействии высокотемпературного термогелиокса // Известия РАН, Серия химическая. 2020. Т. 69. № 9. С. 1816–1818. https://doi.org/10.1007/s11172-020-2967-4
Варфоломеев С.Д., Панин А.А., Рябоконь А.М., и др. Протеом термического гелиокса. Высокотемпературный гелиокс не вызывает разрушение клеток дыхательной системы человека // Терапевтический архив. 2020. Т. 92. № 6. С. 69–72.
Zhu H., Zhang H., Xu Y., et al. PCR past, present and future // BioTechniques. 2020, https://doi.org/10.2144/btn-2020-0057
Heid C.A., Stevens J., Livak K.J., et. al. Real time quantitative PCR // Genome Res. 1996. Vol. 6, № 10. P. 986–994. https://doi.org/10.1101/gr.6.10.986
Wilson D.D. McGraw-Hill Manual of Laboratory and Diagnostic Tests. New-York: McGraw-Hill Medical; 2007.
Li Y., Xia L. Coronavirus Disease 2019 (COVID-19): Role of chest CT in diagnosis and management // AJR. Am. J. Roentgenol. 2020. V. 214. № 6. P. 1280–1286. https://doi.org/10.2214/AJR.20.22954
Long Q., Liu B., Deng H. et al. Antibody responses to SARS-CoV-2 in patients with COVID-19 // Nat. Med. 2020. V. 26. P. 845–848. https://doi.org/10.1038/s41591-020-0897-1
Catanzaro M., Fagiani F., Racchi M., et al. Immune response in COVID-19: addressing a pharmacological challenge by targeting pathways triggered by SARS-CoV-2 // Signal Transduct. Target. Ther. 2020. V. 5. P. 84. https://doi.org/10.1038/s41392-020-0191-1
McGonagle D., Sharif K., O’Regan A., et al. The role of cytokines including Interleukin-6 in COVID-19 induced pneumonia and macrophage activation syndrome-like disease // Autoimmun. Rev. 2020. V. 19. № 6. P. 102537. https://doi.org/10.1016/j.autrev.2020.102537
Potempa L.A., Rajab I.M., Hart P.C., et al. Insights into the use of C-reactive protein as a diagnostic index of disease severity in COVID-19 infections // Am. J. Trop. Med. Hyg. 2020. V. 103. № 2. P. 561–563. https://doi.org/10.4269/ajtmh.20-0473
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни



