Доклады Российской академии наук. Науки о жизни, 2021, T. 497, № 1, стр. 194-198
ВЛИЯНИЕ ХИРУРГИЧЕСКОЙ ТРАВМАТИЗАЦИИ В ПОЛОСТИ НОСА НА ЭКСПРЕССИЮ БЕЛКА P53 В ГИППОКАМПЕ КРЫС
И. В. Кастыро 1, *, академик РАН И. В. Решетов 2, Г. В. Хамидулин 1, С. С. Шилин 1, В. И. Торшин 1, М. Г. Костяева 1, В. И. Попадюк 1, Т. Ю. Юнусов 3, П. Е. Шмаевский 1, К. П. Шаламов 1, А. Купрякова 1, Е. С. Дорогинская 1, А. Д. Седельникова 1
1 ФГАОУ ВО Российский университет дружбы народов
Москва, Россия
2 ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет)
Москва, Россия
3 Городская клиническая больница № 40 ДЗМ
Москва, Россия
* E-mail: ikastyro@gmail.com
Поступила в редакцию 28.11.2020
После доработки 13.12.2020
Принята к публикации 15.12.2020
Аннотация
Цель исследования состояла в определении роли стрессорного влияния моделирования септопластики на экспрессию белка p53 в гиппокампе у крыс в условиях сенсорной обонятельной депривации. Моделирование септопластики было проведено на 30 половозрелых крысах самцах. Проводилась количественная оценка апоптоза нейронов в пирамидном слое гиппокампа в субполях СА1, СА2, СА3, зубчатой извилине (DG) на 2-й, 4-й и 6-й день после операции. Гистологические срезы окрашивали иммуногистохимическим методом антителами к белку p53. Увеличение количества p53-позитивный нейронов было отмечено во всех субполях, максимальный рост численности апоптотичных нейронов был отмечен на 4-е сутки после операции. Стрессовое влияние моделирования септопластики у крыс, сопровождающегося сенсорной депривацией периферического отдела обонятельного анализатора, провоцирует экспрессию p53 и запуск механизмов апоптоза в различных субполях гиппокампа.
ВВЕДЕНИЕ
Различные физиологические стимулы и патологические нарушения индуцируют образование р53-позитивных нейронов, включая депривацию нейротрофического фактора, гиперактивацию глутаматных рецепторов, гипоксию и ишемию, а также окислительный и питательный стресс, возникающий в результате воздействия окружающей среды, амилоидного β-пептида и оксида азота [1]. р53 активируется внешними и внутренними сигналами стресса, которые и способствуют накоплению в ядрах р53 в активной форме. Ингибиторная активность р53 предотвращает пролиферацию клеток с поврежденной ДНК или с канцерогенным потенциалом. Кроме того, р53 участвует в таких клеточных процессах, как дифференцировка, репарация ДНК и ангиогенез, которые также являются жизненно важными для подавления опухоли [2]. Точные факторы, влияющие на экспрессию р53 с целью запуска апоптоза, изучены лишь частично и являются предметом дальнейшего интенсивного изучения [2].
Обоняние играет важнейшую роль в восприятии внешнего мира крысами. Через обонятельную луковицу нервные импульсы от обонятельных рецепторов идут также частично в гиппокамп, который отвечает за поведенческие акты, память, исследовательскую активность. Ингибирующее действие гиппокампа на паравентрикулярные ядра, которые выделяются в качестве основного интегратора сигналов стресса между таламусом и другими центрами головного мозга [3], сохраняется при помощи относительно ограниченной популяции нейронов в вентральном основании гиппокампа [4]. Поражения в этой области приводят к увеличению высвобождения кортикостерона после стресса [4], что согласуется с контекстно-специфической модуляцией реакций на стресс гиппокампом.
В доступной нам литературе данных о влиянии хирургического повреждения слизистой оболочки полости носа на морфологические изменения нейронов в гиппокампе найдено не было.
Цель исследования: определить роль стрессорного влияния моделирования септопластики на экспрессию белка p53 в гиппокампе у крыс в условиях сенсорной обонятельной депривации.
МАТЕРИАЛЫ И МЕТОДЫ
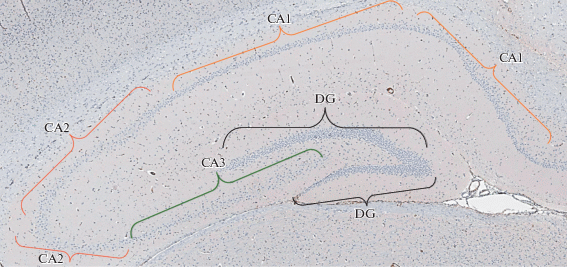
Экспериментальное исследование было проведено на 30 половозрелых крысах-самцах линии Wistar возрастом 12–18 мес. 10 крыс составили контрольную группу. Перед операцией в хвостовую вену вводили раствор золетила (10 мг/кг). При помощи зигзагообразной скарификации слизистой оболочки перегородки носа острым зондом в каудо-краниальном направлении проводили моделирование септопластики. В экспериментальной группе крыс забивали на 2-е, 6-е и 14-е сутки после операции по 10 особей. Фиксацию головного мозга проводили до трепанации черепа путем введения через сердце физиологического раствора, а затем 10% раствора формалина в течение 5–10 мин. После трепанации черепа головной мозг фиксировали 10% раствором формалина, после чего заключали в парафиновые блоки. Получали 4 среза головного мозга во фронтальной плоскости толщиной 4 мкм с каждой крысы и окрашивали препараты методами иммуногистохимии к белку р53. Все срезы докрашивали гематоксилином Майера. Изучали субполя гиппокампа СА1, СА2, СА3 и зубчатую извилину (DG) (рис. 1).
Рис. 1.
Расположение субполей гиппокампа крысы. Иммуногистохимическая реакция анти-p53. Докрашивание гематоксилином Майера. Ув. ×100.
В пирамидном слое субполей на каждом срезе подсчитывали абсолютное количество нейронов, у которых была положительная ядерная реакция с антителами, а также нейрональные ниши. Выделяли нейроны на начальной стадии экспрессии белка p53 (положительная реакция на белок p53 в цитоплазме нейрона, четкое ядро без признаков кариорексиса) и на стадии апоптоза (окрашивание ядра нейрона антителами на белок p53, признаки кариорексиса, узкая полоска гипохромной цитоплазмы). Вычислялись средние значения и стандартные ошибки средней для срезов каждого животного и для группы в соответствующем субполе. Для оценки достоверности различий между группами использовали критерий Манна–Уитни при уровне значимости p < 0.05.
Исследования на животных проводили согласно требованиям “Правил проведения работ с использованием экспериментальных животных” (1984 г.) и “Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях” (1986 г.).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Моделирование септопластики привело к увеличению численности р53-позитивных нейронов во всех субполях гиппокампа у крыс, по сравнению с данными группы контроля (рис. 1). Так, в субполях СА1 и СА2 подобное увеличение наблюдалось на 2-й и 4-й день, а на 6-й день после операции –только в СА1 (рис. 2а, 2б). В субполе СА3 и DG количество р53+ нейронов на ранних стадиях экспрессии было больше, чем в норме на всех сроках, а нейронов с выраженными признаками апоптоза в CA3 – на 2-й и 6-й день, в DG –на 4-й и 6-й день после операции (рис. 2б, 2в).
Рис. 2.
Изменение количества p53-позитивных нейронов на различных стадиях апоптоза в различные сроки после моделирования септопластики у крыс в зонах гиппокампа СА1 (a), CA2 (б), CA3 (в) и DG (г). † –достоверное различие между сроками наблюдения (p < 0.01); * –достоверное различие между данными эксперимента и нормой (p<0.01); ‡ –достоверное различие между данными эксперимента и нормой (p < 0.05).
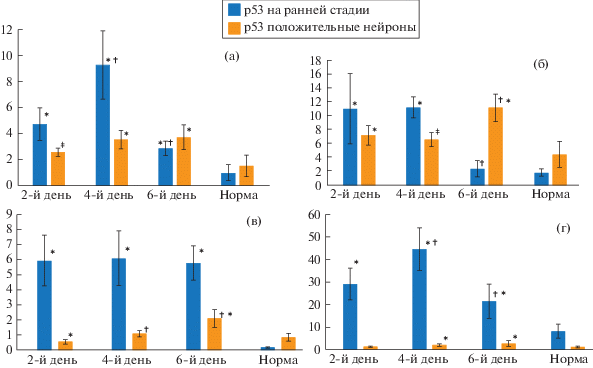
Колебания количества р53+ нейронов в динамике в каждом слое были следующими. Пик р53-позитивных нейронов на ранних стадиях был отмечен на 4-й день в субполях СА1 и DG (p < 0.01). Уменьшение этих нейронов к 6-му дню наблюдалось в субполе СА2. В СА3 было зафиксировано их стабильно высокое количество на всех сроках наблюдения (p < 0.01). В субполях СА1 (рис. 2a) и DG на 4-й и 6-й дни (p < 0.01) отмечалось стойкое увеличение нейронов на поздних стадиях апоптоза. К 6-му дню рост количества этих нейронов был отмечен в субполях СА2 и СА3 (p < 0.01). Необходимо отметить, что на 6-й день количество нейронов на поздних стадиях апоптоза было выше, чем нейронов на ранних стадиях экспрессии p53, в субполях СА1 (p < 0.05) и СА2 (p < 0.01) (рис. 2a, 2b, рис. 3).
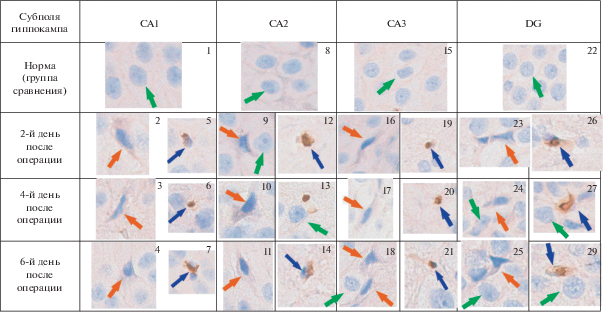
Рис. 3.
Экспрессия белка p53 в нейронах гиппокампа крысы после моделирования септопластики: нормальные нейроны (зеленые стрелки), нейроны с начальными проявлениями экспрессии белка p53 (оранжевые стрелки), нейроны на поздних стадиях апоптоза (синие стрелки). Окрашивание антителами к белку p53, докрашивание гематоксилином Майера. Ув. ×600.
Количество нейрональных ниш в зоне СА1 после операции было достоверно выше на 4-й (0.5 ± 0.2) и 6-й (0.6 ± 0.3) дни после операции, по сравнению с группой контроля (0.20 ± 0.07) (p < 0.01) и по сравнению со 2-м днем (0.20 ± 0.09) операции (p < 0.01). В зоне СА2 была отмечена такая же тенденция, однако наблюдался рост их количества и на 6-й день (5.6 ± 0.0) после моделирования септопластики (p < 0.05). В зоне СА3 увеличение нейрональных ниш наблюдалось лишь на 6-й день (p < 0.01), но оно было значительное –1.50 ± 0.88, по сравнению с нормой (0.20 ± 0.09) и более ранними постоперационными сроками. В DG была зафиксирована аналогичная картина, что и в зоне СА2: по сравнению с нормой (0.2 ± 0.1), число нейрональных ниш было достоверно выше на четвертый (0.5 ± 0.1) (p < 0.05) и шестой (1.0 ± 0.2) дни (p < 0.01). Также была отмечена динамика роста нейрональных ниш: их количество возросло на 4-е сутки (p < 0.05) и на 6-е сутки (p < 0.01), в сравнении с предыдущими сроками анализа.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Повышенная экспрессия р53 индуцирует гибель нейрональных клеток даже в отсутствие травмы, ишемии или эксайтотоксичности [5]. На примере эмбрионов мышей было показано, что p53 может защищать нейроны от апоптоза при определенных условиях во время нейрогенеза [6], однако в нейронах взрослых особей р53, как правило, ассоциируют с остановкой клеточного цикла, апоптозом и репарацией ДНК [7]. р53 может также присутствовать в аксональных терминалях, вызывая синаптическую дегенерацию [8].
Экспрессия p53 может быть важной для апоптоза нейронов после ишемии или эксайтотоксичности. Это было доказано в исследованиях, показывающих, что количество p53 в нейронах увеличивается в ответ на эти воздействия [9]. Повышенная экспрессия гена р53 также наблюдалась после экспериментальной черепно-мозговой травмы [10]. Уже через 6 ч после травмы мРНК р53 индуцируется преимущественно в нейронах, уязвимых к черепно-мозговой травме, таких как контуженная кора, латеральные и медиальные геникулярные ядра таламуса, а также нейроны в СА3 и DG гиппокампа [11].
В настоящем исследовании показано, что количество p53-позитивных нейронов (рис. 3) и нейрональных ниш в гиппокампе увеличивается на фоне скарификации слизистой оболочки перегородки носа у крыс. Отчетливо видно, что в CA1 и СА2 на 6-й день увеличивается количество нейронов на поздних стадиях апоптоза. Подобные явления в гиппокампе можно объяснить постхирургическим отеком в первые дни, сужением носовых ходов и последующей гипоксией [12]. Многие исследования убедительно доказывают, что р53 участвует в апоптозе нейронов, который наблюдается после инсульта или черепно-мозговой травмы [9]. В предыдущих наших исследованиях было показано, что сенсорная депривация периферической части обонятельного анализатора при септопластике провоцирует выраженные морфофизиологические стрессовые реакции: изменение в балансе вегетативной нервной системы [12], тревожно-депрессивное состояние [13] и вызывает увеличение количества темных нейронов в гиппокампе [14] вследствие нарушения носового дыхания и острого состояния гипоксии у животных. Полученные экспериментальные данные служат убедительным доказательство того, что манипуляции в области перегородки носа приводят к выраженным нейрофизиологическим стрессорным реакциям [12–14]. Это важно для понимания острого постоперационного болевого синдрома, выбора адекватной стратегии его купирования у пациентов, перенесших септопластику, так как проблема профилактики острой боли в хирургической ринологии окончательно не решена [15].
ЗАКЛЮЧЕНИЕ
Стрессовое влияние моделирования септопластики у крыс, сопровождающегося сенсорной депривацией периферического отдела обонятельного анализатора, провоцирует экспрессию p53 и запуск механизмов апоптоза в различных субполях гиппокампа.
Список литературы
Wang D.B., Kinoshita C., Kinoshita Y., Morrison R.S. p53 and Mitochondrial Function in Neurons // Biochim Biophys Acta. 2014. 1842 (8):1186-97.
Haupt S., Berger M., Goldberg Z., Haupt Y. Apoptosis –the p53 network // Journal of Cell Science. 2003. V. 116. P. 4077–4085.
Swanson L.W., Kuypers H.G. The paraventricular nucleus of the hypothalamus: cytoarchitectonic subdivisions and organization of projections to the pituitary, dorsal vagal complex, and spinal cord as demonstrated by retrograde fluorescence double-labeling methods // J. Comp. Neurol. 1980. V. 194. P. 555–570.
Herman J.P., Mueller N.K. Role of the ventral subiculum in stress integration // Behav Brain Res. 2006. V. 174. P. 215–24.
Jordan J., Galindo M.F., Prehn J.H.M., Weichselbaum R.R., Beckett M., Ghadge G.D., Roos R.P., Leiden J.M., Miller R.J. p53 expression induces apoptosis in hippocampal pyramidal neuron cultures // J Neurosci. 1997. V. 17. P. 1397–1405.
Armstrong J.F., Kaufman M.H., Harrison D.J., Clarke A.R. High-frequency developmental abnormalities in p53-deficient mice // Curr Biol. 1995. V. 5. P. 931–936.
Tedeschi A., Gi Giovanni S. The non-apoptotic role of p53 in neuronal biology: enlightening the dark side of the moon // EMBO reports. 2009. V. 10. P. 676–583.
Erster S., Moll U.M. Stress-Induced p53 Runs a Direct Mitochondrial Death Program: Its Role in Physiologic and Pathophysiologic Stress Responses In Vivo // Cell Cycle. 2004. V. 3 (12). P. 1492–1495.
Miller F.D., Pozniak C.D., Walsh G.S. Neuronal life and death: an essential role for the p53 family // Cell Death and Differentiation. 2000. V. 7. P. 880–888.
Morrison R.S., Kinoshita Y. The role of p53 in neuronal cell death // Cell Death and Differentiation. 2000. V. 7. P. 868–879.
Napieralski J.A., Raghupathi R., McIntosh T.K. The tumor-suppressor gene, p53, is induced in injured brain regions following experimental traumatic brain injury // Brain Res. Mol. Brain Res. 1999. V. 71. P. 78–86.
Kastyro I.V., Inozemtsev A.N., Shmaevsky P.E., Khamidullin G.V., Torshin V.I., Kovalenko A.N., Pryanikov P.D., Guseinov I.I. The impact of trauma of the mucous membrane of the nasal septum in rats on behavioral responses and changes in the balance of the autonomic nervous system (pilot study) // J. Phys.: Conf. Ser. 2020. V. 1611 (012054).https://doi.org/10.1088/1742-6596/1611/1/012054
Kastyro I.V., Reshetov I.V., Khamidulin G.V., Shmaev-sky P.E., Karpukhina O.V., Inozemtsev A.N., Torshin V.I., Ermakova N.V., Popadyuk V.I. The Effect of Surgical Trauma in the Nasal Cavity on the Behavior in the Open Field and the Autonomic Nervous System of Rats // Doklady Biochemistry and Biophysics. 2020. V. 492. P. 121–123. https://doi.org/10.1134/S1607672920030023
Torshin V.I., Kastyro I.V., Kostyaeva M.G., Eremina I.Z., Ermakova N.V., Khamidulin G.V., Shevtsova S.N., Tsaturova I.A., Skopich A.A., Popadyuk V.I. The effect of experimental modeling of septoplasty on rat hippocampal cytoarchitectonics // Golova i sheya. Rossijskij zhurnal = = Head and neck. Russian Journal. 2019. V. 7 (4). P. 33–41 (in Russian).
Popadyuk V.I., Kastyro I.V., Ermakova N.V., Torshin V.I. Septoplasty and tonsillectomy: acute stress response as a measure of effectiveness of local anesthetics // Vestn. Otorinolaringol. 2016. V. 81(3). P. 7–11 (in Russian).
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


