Доклады Российской академии наук. Науки о жизни, 2021, T. 497, № 1, стр. 190-193
МЕХАНИЗМ УВЕЛИЧЕНИЯ РЕАБСОРБЦИИ ОСМОТИЧЕСКИ СВОБОДНОЙ ВОДЫ В ПОЧКЕ КРЫС ПРИ ОКСИТОЦИНОВОМ САЛУРЕЗЕ
Академик РАН Ю. В. Наточин 1, *, Е. И. Шахматова 1, А. Е. Боголепова 1
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: natochin1@mail.ru
Поступила в редакцию 10.12.2020
После доработки 14.12.2020
Принята к публикации 15.12.2020
Аннотация
Найдено экспериментальное решение парадокса увеличения реабсорбции осмотически свободной воды в почке крыс при одновременном возрастании диуреза и салуреза под влиянием окситоцина. Инъекция крысам окситоцина (0.25 нмоль/100 г массы тела) увеличивает диурез с 0.16 ± 0.03 до 0.26 ± 0.02 мл/ч, повышает экскрецию осмотически активных веществ с 134 ± 13.7 до 300 ± 16.3 мкОсм/ч и реабсорбцию осмотически свободной воды, которая коррелирует с выделением окситоцина почкой (р < 0.001). Механизм эффекта – окситоцин уменьшает реабсорбцию ультрафильтрата в проксимальном канальце (растет клиренс лития), увеличивается приток жидкости в дистальные участки нефрона. У крыс из вивария высокая осмоляльность мочи (1010 ± 137 мОсмоль/кг Н2О) и концентрация вазопрессина, что обусловливает возрастание реабсорбции осмотически свободной воды. Тем самым окситоцин увеличивает салурез, благодаря чему на фоне высокого уровня эндогенного вазопрессина повышается реабсорбция воды в собирательных трубках.
Нонанопептиды нейрогипофиза (окситоцин, вазопрессин) влияют на выделение натрия и воды почкой [1–3]. Окситоцин вызывает натрийурез и увеличивает диурез. Установлено, что вазопрессин способен вызывать натрийурез и увеличивать реабсорбцию осмотически свободной воды в почке млекопитающих. Эти эффекты обусловлены стимуляцией разных подтипов V-рецепторов [2, 4, 5]. В отличие от вазопрессина, у которого выявлено 3 подтипа данных рецепторов, у крысы в геноме найден только один тип окситоцинового рецептора [6]. Высказаны два предположения о молекулярном механизме действия окситоцина на реабсорбцию воды и натрия в почке. Согласно одному из них он стимулирует V2-рецепторы вазопрессина и повышает реабсорбцию воды [7], а увеличение экскреции натрия объясняется образованием новых форм окситоцина – (OT-GKR) [8]. Наша гипотеза заключается в том, что эффект окситоцина на реабсорбцию воды при действии физиологических концентраций этого гормона можно объяснить, не прибегая к предположению о стимуляции рецепторов других нонапептидов. Задача настоящего исследования – экспериментальное обоснование новой гипотезы физиологического механизма действия окситоцина, исходя из классических представлений о функции почек.
Эксперименты проведены на самках крыс линии Вистар Rattus norvegicus var. albino весом 200–250 г. Животные получали стандартный гранулированный корм (рецепт ПК-120, ООО “Аллер Петфуд”, Россия) и имели свободный доступ к воде. Утром в день эксперимента крыс не кормили. Содержание животных и проведение экспериментов выполнялось в соответствии с Российскими и международными правилами по работе с лабораторными животными. Во время опыта крыс помещали в индивидуальные клетки-пеналы с проволочным дном, через которое моча стекала по воронке в мерную пробирку. Диурез регистрировали при спонтанных мочеиспусканиях в течение 2 ч. Число животных в каждой серии указано в подписях к рисункам и таблице. Осмоляльность проб сыворотки крови и мочи определяли криоскопическим методом на микроосмометре Osmo1 (Advanced Instruments, США). Концентрацию натрия и калия в пробах мочи измеряли на пламенном фотометре Sherwood-420 (Sherwood Scientific, Великобритания), а в сыворотке крови – с помощью ионоселективного блока на автоматическом биохимическом анализаторе Erba XL-200 (Lachema, Чехия). Концентрацию лития в моче определяли в воздушно-ацетиленовом пламени на атомном абсорбциометре АА-6200 (Shimadzu, Япония), в сыворотке крови – на пламенном фотометре Sherwood-420. Для измерения концентрации окситоцина и аргинин-вазопрессина (АВП) в пробах мочи использовали наборы для иммуноферментного анализа (Enzo Life Sciences, США). Считывание оптической плотности осуществляли в 96-луночных планшетах по методике тест-системы на автоматическом ридере ELx808 (Bio-Tek Instruments, США). Маркером проксимальной реабсорбции жидкости служил клиренс лития. В виварии крысы в течение 7 дней до эксперимента получали хлорид лития по следующей схеме: в первые 3 дня воду в поилках заменяли на раствор LiCl из расчета 1.5 мг/100 г в сутки, в последующие 4 дня ежедневно инъецировали раствор LiCl по 0.5 мг/100 г в сутки. В экспериментах использовали окситоцин (Sigma-Aldrich, США), LiCl (НеваРеактив, Россия). Показатели функций почек рассчитывали по стандартным формулам на 100 г массы тела животных. Для расчета клиренса осмотически свободной воды ($T_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{C}$) использовали формулу $T_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{C}$ = COsm – V, где СOsm – очищение от осмотически активных веществ, а V – диурез. СOsm рассчитывают по данным осмоляльности сыворотки крови и мочи. Все данные представлены в виде М ± m. Сравнение между группами проводили с использованием одно- или двухфакторного дисперсионного анализа и теста Холм-Шидака для попарного сравнения средних, r – коэффициент корреляции Пирсона. Различия считали статистически значимыми при p < 0.05.
Инъекция окситоцина в дозе 0.25 нМ/100 г массы тела повышает экскрецию натрия почкой. Проведенные исследования показали, что в диапазоне доз от 0.175 до 0.325 нМ/100 г массы тела окситоцин оказывает практически одинаковый салуретический эффект, что дало основание использовать дозу 0.25 нМ/100 г массы тела для исследования действия окситоцина на выделение воды и ионов почкой. Для выяснения механизма салуретического эффекта окситоцина было изучено соотношение клиренсов осмотически активных веществ и клиренса лития, который характеризует реабсорбцию жидкости в проксимальном сегменте нефрона. Инъекция окситоцина снижает реабсорбцию жидкости в проксимальном сегменте нефрона, параллельно растут клиренс лития и выделение почкой осмотически активных веществ (рис. 1). Это происходит при стабильном уровне клубочковой фильтрации: клиренс креатинина (СCr) в контроле 0.45 ± 0.03 мл/мин, после введения окситоцина 0.46 ± 0.03 мл/мин. Экскреция окситоцина коррелирует с выделением осмотически активных веществ (рис. 2). Увеличение диуреза было обусловлено выделением ионов натрия, которое коррелирует с повышением клиренса лития (рис. 3), при одновременном возрастании реабсорбции осмотически свободной воды (рис. 4). Эксперименты проводились на крысах из вивария, в норме находящихся в состоянии антидиуреза и имеющих высокий уровень эндогенного вазопрессина в крови: осмоляльность мочи превышала 1000 мОсмоль/кг Н2О (табл. 1). Вызываемый окситоцином поток большего объема канальцевой жидкости проходит по собирательным трубкам почки, осмотическая проницаемость стенки которых повышена благодаря присутствию в крови вазопрессина.
Рис. 1.
Корреляция между выведением осмотически активных веществ и клиренсом лития почкой у крыс после инъекции окситоцина. Абсцисса – клиренс лития (СLi), ордината – экскреция осмотически активных веществ (UOsmV) после инъекции 0.25 нМ окситоцина (n = 15).

Рис. 2.
Корреляция между выведением почкой крыс осмотически активных веществ и окситоцина. Абсцисса – экскреция осмотически активных веществ (UOsmV) после инъекции 0.25 нМ окситоцина (n = 15), ордината – экскреция окситоцина (UOTV).

Рис. 3.
Корреляция между выведением натрия и клиренсом лития почкой у крыс после инъекции окситоцина. Абсцисса – экскреция натрия (UNaV) после инъекции 0.25 нМ окситоцина (n = 15), ордината – клиренс лития (СLi).

Рис. 4.
Зависимость между выведением лития и реабсорбцией осмотически свободной воды в почке у крыс после инъекции окситоцина. Абсцисса – экскреция лития (ULiV), ордината – реабсорбция осмотически свободной воды ($T_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{C}$) после инъекции 0.25 нМ окситоцина (n = 15).
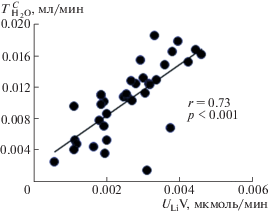
Таблица 1.
Параметры осморегулирующей функции почки и выведение нонапептидов в течение первого часа после инъекции окситоцина
| Параметры функций почек | Контроль, 0.9% NaCl (n = 8) | ОТ 0.25 нМ (n = 15) |
|---|---|---|
| V, мл/ч | 0.16 ± 0.03 | 0.26 ± 0.02# |
| UOsm, мОсм/кг Н2О | 1010 ± 137 | 1284 ± 89NS |
| UNa, мкмоль/мл | 65.0 ± 18.3 | 270.1 ± 31.2## |
| UK, мкмоль/мл | 109.0 ± 23.5 | 102.9 ± 9.9NS |
| UOsmV, мкОсм/ч | 134.0 ± 13.7 | 300.3 ± 16.3## |
| UNaV, мкмоль/ч | 7.8 ± 1.8 | 64.6 ± 8.4## |
| UKV, мкмоль/ч | 13.3 ± 2.6 | 24.3 ± 2.5# |
| $T_{{{\text{H2O}}}}^{C}$, мл/ч | 0.28 ± 0.04 | 0.75 ± 0.04## |
| UОТV, пг/ч | 175.0 ± 26.8 | 1598 ± 233## |
| UAVPV, пг/ч | 23.0 ± 4.8 | 29.3 ± 3.1NS |
Примечание: окситоцин инъецировали в дозе 0.25 нМ/100 г массы тела. Обозначения: UOsm, UNa, UK – концентрация в моче осмотически активных веществ, натрия, калия. V, UOsmV, UNaV, UKV, $T_{{{\text{H2O}}}}^{C}$, UOTV, UAVPV – диурез, выведение осмотически активных веществ, натрия, калия, реабсорбция осмотически свободной воды, выведение окситоцина, АВП.
Достоверность к контролю – #p < 0.02; ##p < 0.001; NS p > 0.05.
Возрастание салуреза и диуреза в этих условиях повышало реабсорбцию осмотически свободной воды (рис. 4). Это объясняется тем, что при значительных концентрациях вазопрессина этот гормон стимулирует V2 -рецепторы клеток собирательных трубок; на фоне снижения проксимальной реабсорбции под влиянием окситоцина и при значительной концентрации эндогенного вазопрессина увеличение потока жидкости по канальцу сопровождается усилением реабсорбции осмотически свободной воды (рис. 4, табл. 1).
Исследование механизма физиологического эффекта окситоцина на функцию почек выполнено на неанестезированных животных, в стандартных по отношению к состоянию функции почек условиях. Выявлен физиологический парадокс – антидиуретическая реакция почек (повышение реабсорбции осмотически свободной воды) при стабильной гломерулярной фильтрации (постоянный клиренс креатинина) происходит в сочетании с увеличением диуреза в ответ на инъекцию окситоцина. Физиологический механизм такого эффекта окситоцина у крыс может быть объяснен следующим образом. Окситоцин стимулирует ОТ-рецепторы в клетках проксимального сегмента нефрона, что снижает проксимальную реабсорбцию жидкости и подтверждается увеличением клиренса лития. Повышается приток жидкости в дистальный сегмент нефрона, в котором окситоцин в использованной дозе стимулирует V1a-рецепторы. Блокада этих рецепторов селективным антагонистом V1a-рецепторов устраняет натрийуретический эффект окситоцина [9]. В итоге снижается реабсорбция ионов в толстом восходящем отделе петли Генле, увеличивается экскреция осмотически активных веществ, растет салурез, диурез и одновременно реабсорбция осмотически свободной воды (табл. 1). Первые два эффекта зависят от введенного окситоцина, а последний от высокого уровня эндогенного вазопрессина, поскольку эксперимент проводился на стандартных животных из вивария, у которых значителен уровень эндогенного гормона в крови и, соответственно, в моче (табл. 1).
Таким образом, механизм действия окситоцина на почку, связанный с увеличением экскреции натрия и возрастанием реабсорбции осмотически свободной воды может быть объяснен, исходя из классических представлений о влиянии нонапептидов нейрогипофиза на селективные типы известных рецепторов. Стимуляция окситоциновых рецепторов в проксимальном канальце уменьшает реабсорбцию жидкости, что способствует салурезу, а секреция эндогенного вазопрессина повышает реабсорбцию осмотически свободной воды в собирательных трубках почки.
Список литературы
Knepper Mark A., Kwon T.H., Nielsen S. // N. Engl. J. Med. 2015. V. 372. № 14. P. 1349–1358. https://doi.org/10.1056/NEJMra1404726
Bankir L., Bichet D.G., Morgenthaler N.G. // J. Intern. Med., 2017. V. 282. № 4. P. 284–297. https://doi.org/10.1111/joim.12645
Koshimizu T., Nakamura K., Egashira N., et al. // Physiol. Rev. 2012. V. 92. № 4. P. 1813–1864. https://doi.org/10.1152/physrev.00035.2011
Manning M., Misicka A., Olma A., et al. // J. Neuroendocrinol. 2012. V. 24. № 4. P. 609–628. https://doi.org/10.1111/j.1365-2826.2012.02303.x
Natochin Yu.V., Golosova D.V. // Vitamins and Hormones. 2020. V. 113. P. 239–258. https://doi.org/10.1016/bs.vh.2019.08.013
Kutina A.V., Makashov A.A., Balbotkina E.V., et al. // Acta Naturae, 2020. V. 12. № 1. P. 73–83. https://doi.org/10.32607/actanaturae.10943
Li C., Wang W., Summer S.N., et al. // J. Am. Soc. Nephrol. 2008. V. 19. № 2. P. 225–232. Epub 2007 Dec 5.https://doi.org/10.1681/ASN.2007010029
Jankowski M., Danalache B., Plante E., et al. // PLoS ONE. 2019. V. 14. № 7.: e0219205. https://doi.org/10.1371/journal.pone.0219205
Наточин Ю.В., Шахматова Е.И., Боголепова А.Е. // Бюл. эксп. биол. и мед. 2019. Т. 168. № 11. С. 573–576. https://doi.org/10.1007/s10517-020-04768-y
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


