Доклады Российской академии наук. Науки о жизни, 2021, T. 497, № 1, стр. 139-142
ВЛИЯНИЕ ЕСТЕСТВЕННОЙ АСИММЕТРИЧНОЙ ЭМБРИОНАЛЬНОЙ ЗРИТЕЛЬНОЙ АФФЕРЕНТАЦИИ НА АКТИВАЦИЮ НЕЙРОНОВ КАУДОМЕДИАЛЬНОГО МЕЗОПАЛЛИУМА ПРИ РЕАКЦИИ ЗАТАИВАНИЯ У НЕЗРЕЛОРОЖДАЮЩИХСЯ ПТЕНЦОВ
Е. В. Корнеева 1, *, А. А. Тиунова 2, Л. И. Александров 1, Т. Б. Голубева 3
1 Федеральное государственное бюджетное научное учреждение Институт высшей нервной деятельности и нейрофизиологии Российской академии наук
Москва, Россия
2 Федеральное государственное бюджетное научное учреждение Научно-исследовательский институт нормальной физиологии им. П.К. Анохина
Москва, Россия
3 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
* E-mail: eko.ihna@mail.ru
Поступила в редакцию 29.07.2020
После доработки 09.11.2020
Принята к публикации 09.11.2020
Аннотация
Работа заключалась в исследовании влияния асимметричной пренатальной зрительной стимуляции на активацию нейронов каудомедиального мезопаллиума (CMM) у 9-суточных птенцов мухоловки-пеструшки во время аудионаправляемого затаивания. Исследовали 4 группы птенцов: 1 и 2 группы, соответственно, зрячие и незрячие птенцы, эмбриональный период и вылупление которых проходили при свете; 3 и 4 группы – зрячие и незрячие птенцы, эмбриональный период и вылупление которых проходили в темноте. Незрячим птенцам за 2 ч до начала эксперимента заклеивали глаза светонепроницаемыми колпачками. Исследовали экспрессию белка c-Fos. Показано, что только в группе вылупившихся при свете незрячих птенцов плотности активированных при затаивании нейронов в правом и левом CMM были различными. Это свидетельствует о том, что наличие или отсутствие асимметричной эмбриональной зрительной афферентации может приводить к формированию различных стратегий использования зрительного обеспечения оборонительного поведения.
Сенсорная стимуляция является важнейшим фактором, определяющим развитие нервной системы любого организма. Особое значение этот фактор приобретает в период пренатального онтогенеза [1, 2]. Птицы являются уникальной моделью для исследования влияния эмбриональной сенсорной стимуляции на онтогенетическое формирование как самой сенсорной системы, так и последующего поведения организмов. Это связано с наличием в эмбриогенезе птиц периода естественной асимметрии зрительной стимуляции. На последних сроках эмбриогенеза голова эмбрионов повернута таким образом, что правый глаз располагается непосредственно под скорлупой яйца и может получать световую афферентацию. Исследования показали, что эмбрионально об-условленная асимметрия зрительной афферентации в сочетании с полным зрительным перекрестом приводит у птиц к различному формированию морфофункциональных проекций правого и левого глаз [3, 4]. Целью данной работы было выяснение вопроса о том, влияют ли особенности пренатальной сенсорной стимуляции на формирование паттернов активации нейронов при реализации постнатального поведения. Известно, что изменения зрительной афферентации в раннем онтогенезе могут в значительной степени модулировать развитие нейрональной активности в слуховых областях [5, 6]. Ранее нами было показано, что акустически направляемое оборонительное поведение у птенцов мухоловки-пеструшки (Ficedula hypoleuca) с появлением предметного зрения на 9-е сутки становится более выраженным [7]. Картирование нейрональной активности путем детекции транскрипционного фактора c‑Fos в теленцефалических слуховых структурах показало, что исключение зрительной афферентации из обеспечения оборонительного поведения незадолго перед экспериментом вызывает снижение его индукции в структурах правого полушария [8]. Мы предположили, что такая особенность связана с пренатальной асимметричной световой стимуляцией. Задача данной работы заключалась в проверке этой гипотезы, а именно в сравнивании нейронального ответа слуховых структур 9‑суточных птенцов, получивших или не получивших асимметричную пренатальную зрительную стимуляцию при акустически направляемом оборонительном поведении. В качестве маркера нейрональной активности использовали транскрипционный ответ раннего гена c‑Fos, неоднократно использовавшийся для картирования нейрональной активности мозга в различных поведенческих ситуациях [9].
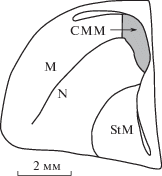
Эксперименты проводили в соответствии с международными правилами работы с лабораторными животными по протоколу, утвержденному этической комиссией ИВНД и НФ РАН. Исследования проведены на 4 группах 9-суточных птенцов мухоловки-пеструшки, по 5 птенцов в каждой группе. Птенцы 1 и 2 групп воспитывались в условиях нормальной зрительной среды. Их вылупление проходило в естественных условиях высиживания самкой, и в дальнейшем на протяжении всего времени эти птенцы находились в естественной среде обитания. Вылупление птенцов 3 и 4 групп проходило в темноте. С этой целью за 2 сут до предполагаемого срока вылупления птенцов яйца забирали из естественных гнезд и переносили в неосвещенный инкубатор. Физические и сенсорные условия инкубирования (за исключением освещенности) были максимально приближены к естественным. После вылупления птенцов забирали из инкубатора и переносили в родные гнезда, где они находились до начала эксперимента. Половине птенцов, вылупившихся при каждом из условий освещенности, за 2 ч до начала эксперимента глаза заклеивали светонепроницаемыми колпачками (группы незрячих птенцов темнового и светового вылупления). Две оставшиеся группы оставались зрячими (группы зрячих птенцов темнового и светового вылупления). Таким образом были сформированы группы птенцов: 1 – зрячие птенцы светового вылупления, 2 – незрячие птенцы светового вылупления, 3 – зрячие птенцы темнового вылупления и 4 – незрячие птенцы темнового вылупления. На 9-е сутки птенцам всех групп, находящимся в стандартных дуплянках, в течение 15 мин проигрывали видоспецифический сигнал тревоги. Через 90 мин после начала эксперимента птенцов декапитировали, их мозг замораживали в жидком азоте и хранили при температуре –70°С. Иммуногистохимическую детекцию белков c-Fos проводили на серийных фронтальных криостатных срезах толщиной 20 мкм по стандартной методике [8, 10]. Осуществляли панорамное сканирование срезов и в каудомедиальном мезопаллиуме (CMM), структуре, связанной с восприятием видоспецифической вокализации, проводили количественный анализ паттернов экспрессии. Ядра иммунопозитивных клеток считали с использованием программы анализа изображений Image Pro Plus. Порог минимальной оптической плотности, выделяющий меченые клетки, но исключающий фоновую окраску, устанавливали вручную. Проводили тотальный подсчет иммунопозитивных клеток в выделенной области (рис. 1).
Рис. 1.
Рисунок фронтального среза правого полушария 9-суточного птенца мухоловки-пеструшки на уровне каудомедиального мезопаллиума. Серым цветом выделена область, в которой производили подсчет c-Fos- позитивных клеток. M – мезопаллиум, CMM — каудомедиальный мезопаллиум, N – нидопаллиум, StM – медиальный стриатум. Масштаб – 2 мм.
Определяли плотность c-Fos позитивных нейронов в правых и левых структурах CMM как количество иммунопозитивных нейронов на единицу площади исследуемых структур на каждом из срезов. Для определения соотношения плотностей c-Fos-позитивных нейронов в правом и левом CMM был введен коэффициент симметрии как отношение плотности c-Fos-позитивных нейронов в правом CMM к таковой в левом CMM. Для проверки отличия коэффициентов симметрии от 1 (1 соответствовала полной симметрии) проводилась статистическая обработка по t-критерию для одной выборки.
Статистический анализ влияний факторов освещенности в разные периоды проводился при использовании факторного анализа ANOVA, различия между группами оценивались при помощи LSD-теста. Достоверными считались отличия при p < 0.05.
Визуальное исследование срезов мозга на уровне CMM показало выраженную иммунореактивность нейронов данной области.
Анализ плотностей c-Fos-позитивных нейронов в правом и левом СММ выявил, что этот показатель на разных срезах ощутимо различался, что давало очень большой разброс значений (табл. 1).
Таблица 1.
Плотности c-Fos-позитивных нейронов в правом и левом СММ, n/1 мм2
| зрячие птенцы светового вылупления | незрячие птенцы светового вылупления | зрячие птенцы темнового вылупления | незрячие птенцы темнового вылупления | |
|---|---|---|---|---|
| Правый CMM | 368.2 ± 211.2 | 261.5 ± 91.5 | 705.6 ± 157.4 | 401.3 ± 198.8 |
| Левый CMM | 330.9 ± 201.9 | 322.3 ± 91.7 | 831.4 ± 242.1 | 376.2 ± 186.8 |
В этой связи статистический анализ не выявил значимых различий плотностей иммунопозитивных нейронов в разных группах, что не позволило использовать показатель плотности для статистического анализа.
Исследование коэффициентов симметрии плотностей иммунопозитивных нейронов в CMM в разных экспериментальных группах выявило, что этот показатель достоверно отличается от 1 только в группе незрячих птенцов светового вылупления (t = –2.87422, p = 0.04528) (рис. 2).
Рис. 2.
Коэффициент симметрии плотностей c-Fos-позитивных нейронов в правом и левом СММ. По вертикали – отношение количества c-Fos-позитивных клеток на 1 мм2 в правом СММ к левому СММ. По горизонтали – группы птенцов. Нижняя и верхняя границы прямоугольников соответствуют первому и третьему квартилю, точка в прямоугольнике – среднему арифметическому, разбросы – минимальному и максимальному наблюдаемому выборочному значению. * – значимые различия коэффициентов симметрии между группами птенцов при p < 0.05.

Факторный анализ не обнаружил значимой разницы между влияниями как фактора освещенности в позднем эмбриогенезе, так и фактора наличия или отсутствия зрительной афферентации во время эксперимента. Однако он показал значимость эффекта взаимодействия между анализируемыми факторами (F = 8.1935, p = 0.011287).
Индивидуальные сравнения между группами выявили достоверно более низкие показатели коэффициента симметрии плотностей иммунопозитивных нейронов в CММ в группе незрячих птенцов светового вылупления по сравнению с группой зрячих птенцов светового вылупления (p = 0.015137) и группой незрячих птенцов темнового вылупления (p = 0.049872) (рис. 2).
Таким образом, наши данные показали, что содержание яиц в темноте на поздних сроках инкубационного периода, устраняющее световую стимуляцию правого глаза эмбрионов, не приводит к изменению соотношения нейронов правого и левого CMM, активирующихся при реализации оборонительного поведения у 9-суточных птенцов. Однако тестирование вклада зрительной афферентации путем ее исключения незадолго до начала эксперимента выявило существенные различия между птенцами, вылупление которых проходило в темноте и на свету. Только у птенцов, развивающихся и вылупившихся при нормальном световом режиме, мы наблюдали асимметричный вклад зрительной афферентации в активацию нейронов правого и левого CMM. Нейроанатомические исследования продемонстрировали, что в пределах зрительных ядер среднего и промежуточного мозга птиц наблюдается асимметричное распределение разных фракций нейронов, а инкубирование яиц в темноте нарушает такой паттерн распределения. [11]. Таким образом, асимметрию зрительного вклада в оборонительную интеграцию можно связать с асимметрией эмбриональной световой стимуляции, а исключение этой стимуляции меняет паттерн активирующихся при оборонительном поведении нейронов. Иными словами, наличие или отсутствие асимметричной эмбриональной зрительной афферентации у птенцов мухоловки-пеструшки может приводить к формированию различных стратегий использования сенсорного обеспечения оборонительного поведения.
Список литературы
Lickliter R. The Role of Sensory Stimulation in Perinatal Development: Insights From Comparative Research for Care of the High-Risk Infant // Journal of developmental and behavioral pediatrics. 2000. V. 21. № 6. P. 437–447.
Шишелова А.Ю., Раевский В.В. Влияние пре- и постнатальных факторов на формирование ранних поведенческих реакций // Доклады Российской академии наук. 2018. Т. 479. № 3. С. 351–353. https://doi.org/10.7868/S0869565218090268
Rogers J. A Matter of Degree: Strength of Brain Asymmetry and Behaviour // Symmetry. 2017. V. 9. № 57. https://doi.org/10.3390/sym9040057
Schmitz J., Güntürkün O., Ocklenburg S. Building an Asymmetrical Brain: The Molecular Perspective // Frontiers in Psychology. 2019. V. 10. Article 982.
MoweryT.M., Kotak V.C., Sanes D.H. The onset of visual experience gates auditory cortex critical periods // Nature Communications. 2016. V. 7. Article 10416
Huber E., Chang K., Alvarez I. Early Blindness Shapes Cortical Representations of Auditory Frequency within Auditory Cortex // The Journal of Neuroscience. 2019. V. 39. № 26. P. 5143–5152.
Корнеева Е.В., Александров Л.И., Голубева Т.Б. и др. Роль зрительной афферентации в фомировании ранних форм оборонительного поведения птенцов мухоловки- // Журнал высшей нервной деятельности. 2005. Т. 55. № 3. С. 353–359.
Корнеева Е.В., Тиунова А.А., Александров Л.И., и др. Зрительная афферентация влияет на экспрессию ранних генов c-fos и zenk в слуховых теленцефалических центрах птенцов мухоловки-пеструшки при акустически направляемой реакции // Журнал высшей нервной деятельности. 2014. Т. 64. № 3. С. 324–333.
Jaworski J., Kalita K., Knapska E. C-Fos and neuronal plasticity: the aftermath of Kaczmarek’s theory // Acta Neurobiologiae Experimentalis. 2018. V. 78. № 4. P. 287–296.
Корнеева Е.В., Тиунова А.А., Александров Л.И., и др. Активация WULST у птенцов мухоловки пеструшки при пищевом поведении, вызываемом оформленным зрительным стимулом // Журнал высшей нервной деятельности. 2016. Т. 66. № 1. С. 74–78.
Letzner S., Manns M., Güntürkün O. Light-dependent Development of the Tectorotundal Projection in Pigeons // The European journal of neuroscience. 2020. May 9. https://doi.org/10.1111/ejn.14775
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


