Доклады Российской академии наук. Науки о жизни, 2021, T. 497, № 1, стр. 165-168
ФОРМИРОВАНИЕ УНИКАЛЬНОЙ ПОПУЛЯЦИИ CD8+ Т-ЛИМФОЦИТОВ ПРИ ВВЕДЕНИИ СИНГЕННЫХ СПЛЕНОЦИТОВ МЫШАМ С ЛИМФОПЕНИЕЙ
Ю. Ю. Силаева 1, *, А. А. Калинина 2, Л. М. Хромых 2, А. В. Дейкин 1, 3, Д. Б. Казанский 2
1 Центр коллективного пользования Федерального государственного бюджетного учреждения науки “Институт биологии гена” Российской академии наук
Москва, Россия
2 Федеральное государственное бюджетное учреждение “Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина” Министерства здравоохранения Российской Федерации
Москва, Россия
3 Центр высокоточного редактирования и генетических технологий для биомедицины Федерального государственного бюджетного учреждения науки “Институт биологии гена” Российской академии наук
Москва, Россия
* E-mail: silaeva@genebiology.ru
Поступила в редакцию 10.11.2020
После доработки 25.11.2020
Принята к публикации 27.11.2020
Аннотация
В условиях лимфопении Т-лимфоциты пролиферируют и приобретают поверхностный активационный фенотип, во многом похожий на фенотип истинных Т-клеток памяти. Мы исследовали фенотипические особенности популяции CD8+ Т-клеток, формирующейся из лимфоцитов донора после адоптивного переноса сингенных спленоцитов сублетально облученным мышам. Указанная популяция экспрессирует маркеры CD44, CD122, CD5, CD49d и хемокиновый рецептор CXCR3. Таким образом, впервые продемонстрирован феномен формирования популяции Т-клеток с признаками супрессорных CD8+ Т-лимфоцитов и истинных клеток памяти.
В условиях лимфопении в организме возникают популяции суррогатных CD8+ Т-клеток памяти, по фенотипу похожих на истинные клетки памяти (“memory-like” CD8+, TML) [1–4]. Данные первоначальных экспериментов позволяли предполагать, что формирующаяся в условиях лимфопении популяция TML повторяет фенотипические особенности истинных клеток памяти и может заменить их в иммунном ответе [5, 6]. Однако накапливаются доказательства того, что TML схожи с истинными клетками памяти по профилю экспрессии поверхностных маркеров; вместе с тем имеются ключевые отличия. Так, экспрессия рецепторов хемокинов в TML отличается от таковой в истинных клетках памяти [7]. Описаны популяции TML с иммуносупрессорной активностью [8]. Более того, при лимфопении клоны Т-клеток с рецепторами высокоаффинного взаимодействия с собственными молекулами MHC (по существу, аутореактивные Т-клетки) пролиферируют и экспрессируют поверхностные маркеры клеток памяти [9, 10]. В настоящей работе исследован фенотип популяции CD8+ лимфоцитов, образующейся при адоптивном переносе сингенных спленоцитов мышам-реципиентам с лимфопенией после сублетального облучения.
Использованы мыши линий C57BL/6 (KbI-AbDb) и C57BL/6-TgN(ACTbEGFP)1Osb (KbI-AbDb) (далее B6.GFP, https://www.jax.org/ strain/003291) (разведение вивария НМИЦ онкологии им. Н.Н. Блохина). В организме мышей линии B6.GFP GFP экспрессируется конститутивно под контролем куриного промотора бета-актина и цитомегаловирусного энхансера. Не зафиксировано отличий в функционировании иммунной системы трансгенных животных по сравнению с диким типом, что позволило использовать данную линию в экспериментах. Экспериментальные протоколы одобрены этической комиссией Института биологии гена РАН. Самок мышей C57BL/6 сублетально облучали (4.5 Гр однократно) на аппарате “Агат-Р” ((Россия), источник γ-излучения Co60 с начальной мощностью 1.9 × 1014 Бк). Животных выводили из эксперимента на 10-й день после облучения, извлекали селезенки и гомогенизировали в фосфатно-солевом буфере при 4°C. Спленоциты осаждали центрифугированием (200 g, 5 мин). Эритроциты обрабатывали лизирующим буфером (BD Pharmingen, США). Мононуклеары трижды промывали фосфатно-солевым буфером и использовали для окрашивания моноклональными антителами и адоптивного переноса.
Использовали моноклональные антитела, конъюгированные с соответствующими флуоресцентными метками: PerCP-Cy5.5 – анти-CD8α (клон 53–6.7, BD Bioscience, США), APC-Cy7 – анти-CD62L (клон MEL-14, eBioscience, США), APC – анти-CD44 (клон IM7, eBioscience), PE-Cy7 – анти-CD3 (клон 145-2C11, eBioscience), PE – анти-CD122 (клон TM-β1, BD Bioscience), BV421 – анти-CD5 (клон 53-7.3, BD Biosciences), BV421 – анти-CXCR3 (клон CXCR3-173, BD Biosciences), PE – анти-CD49d (R1-2, BD Biosciences).
Адоптивный перенос осуществляли следующим образом: неиммунизированных мышей C57BL/6 облучали в дозе 4.5 Гр. Через 24 ч после облучения мышам внутривенно (в/в) вводили 1.5 × 107 спленоцитов неиммунизированных сингенных животных или фосфатно-солевой буфер (контроль). Через 10 дней спленоциты мышей-реципиентов использовали для цитофлуориметрического анализа. Спленоциты (3 × 106) инкубировали с блокирующими антителами Fc block (клон 2.4G2, BD Pharmingen, США; 10 мин 4°C), окрашивали флуоресцентно мечеными антителам (40 мин, 4°C) и анализировали на проточном цитофлуориметре FACS Canto II (BD Bioscience) в программе FACSDiva 6.0 (BD Bioscience). Для характеристики популяций периферических Т-клеток анализировали не менее 106 событий в каждом образце. Обработку данных проводили в программе Flow Jo 7.6 (TreeStar Inc., США). Результаты представлены как средняя величина ± ± стандартная ошибка (M ± SEM). Статистический анализ проводили с использованием непарного критерия Стьюдента. Различия признавали значимыми при p ≤ 0.05.
Обнаружено значительное увеличение относительного количества CD3+ лимфоцитов в селезенке мышей-реципиентов (рис. 1а). Кроме того, доля CD8+ Т-клеток также значительно возрастала у мышей-реципиентов по сравнению с неиммунизированным контролем и сублетально облученными животными (рис. 1а). Это означает, что при адоптивном переносе сингенных спленоцитов пролиферируют в основном CD8+ Т-клетки. Это согласуется с результатами исследований, показавших, что CD8+ клетки нуждаются в меньшем наборе стимулов для гомеостатической пролиферации по сравнению с CD4+ Т-лимфоцитами [11]. Практически все CD8+ Т-лимфоциты как донора, так и реципиента приобрели фенотип CD44+, как и ожидали в условиях лимфопении (рис. 1б). При этом доля потенциально аутореактивных клеток CD8+CD44+CD5+ в популяции лимфоцитов донора была достоверно выше, чем среди лимфоцитов реципиента (рис. 1б). Также значительно возросла доля CD8+CD122+ Т-клеток среди Т-лимфоцитов донора по сравнению с аналогичными популяциями реципиента, неиммунизированных и сублетально облученных мышей (рис. 1б). Отмечено достоверное увеличение доли Т-клеток, экспрессирующих CD49d в популяции клеток донора по сравнению с Т-лимфоцитами реципиента (рис. 1в). Помимо этого, относительное количество Т-лимфоцитов донора, экспрессирующих хемокиновый рецептор CXCR3, было достоверно выше, чем доля таких лимфоцитов в популяции Т-клеток реципиента (рис. 1в).
Рис. 1.
Относительное количество популяций Т-лимфоцитов в селезенке сублетально облученных мышей-реципиентов после адоптивного переноса сингенных спленоцитов. а – Относительное количество CD3+ и CD3+CD8+ Т-клеток в селезенке сублетально облученных реципиентов. Представлены данные для контрольных групп (неиммунизированные, облученные), отдельно для клеток реципента (GFP-) и донора (GFP+). Здесь и на рис. 1а–1б: данные получены в трех независимых экспериментах, 4–6 животных в каждой группе. Для статистического анализа использовали t-критерий Стъюдента (*p ≤ 0.05, **p ≤ ≤ 0.01). б – Относительное количество CD8+CD44+, CD44+CD5+ и CD8+CD122+ Т-клеток в селезенке сублетально облученных реципиентов. в – Относительное количество CD8+CD44+CD49d+ и CD8+CD44+CXCR3+ Т-клеток в селезенке сублетально облученных реципиентов.
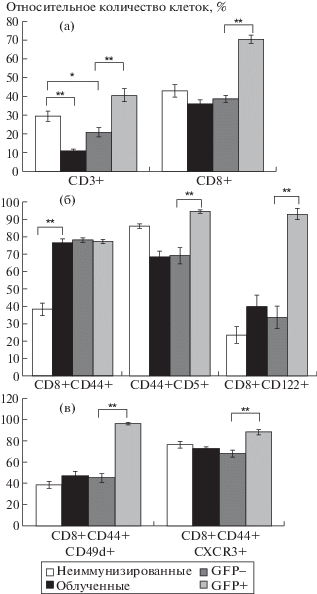
Таким образом, при адоптивном переносе сингенных спленоцитов в селезенке сублетально облученного реципиента формируется популяция донорских Т-клеток с уникальными фенотипическими характеристиками – одновременной экспрессией маркеров истинных клеток памяти и супрессоров CD8+. Мы полагаем, что поверхностный фенотип, приобретенный Т-лимфоцитами донора в условиях лимфопении, может быть связан с недостатком или избытком сигналов, получаемых Т-лимфоцитами при взаимодействии Т-клеточного рецептора с собственными МНС/пептидными комплексами. Нами показано, что конкуренция за взаимодействие с собственными комплексами MHC-пептид среди Т-лимфоцитов, несущих трансгенную β-цепь ТКР, в мышах линии 1D1b приводит к изменению поверхностного активационного фенотипа по сравнению с Т-клетками этих же животных, экспрессирующих эндогенную β-цепь ТКР [12]. В нашей экспериментальной системе наивные клетки донора могут получать преимущество в связи с высоким уровнем экспрессии молекулы CD5, особенно ввиду того, что значительная часть наивных клеток реципиента погибла в результате сублетального облучения. Кроме того, в формировании обнаруженной популяции большое значение могут иметь изменения в микроокружении Т-лимфоцитов донора, возникшие в результате адоптивного переноса спленоцитов в венозное русло реципиента. Однако вне зависимости от причин, вызвавших появление такого профиля экспрессии поверхностных маркеров, наиболее важным остается вопрос о функциональных характеристиках обнаруженной популяции: способны ли они осуществлять полноценный иммунный ответ или представляют собой популяцию супрессорных Т-клеток? В последнем варианте полученные результаты могут иметь практическое значение для практики переливания крови и пересадки костного мозга, поскольку подобные популяции могут формироваться у пациентов [13], поэтому изучение функциональных характеристик обнаруженной популяции чрезвычайно важно и станет предметом наших дальнейших исследований.
Список литературы
Cho B.K., Rao V.P., Ge Q., Eisen H.N., & Chen J. Homeostasis-stimulated proliferation drives naive T cells to differentiate directly into memory T cells // The Journal of experimental medicine. 2000. V. 192. № 4. P. 549–556.
Goldrath A.W., Bogatzki L.Y., & Bevan M.J. Naive T cells transiently acquire a memory-like phenotype during homeostasis-driven proliferation // The Journal of experimental medicine. 2000. V. 192. № 4. P. 557–564.
Murali-Krishna K., & Ahmed R. Cutting edge: naive T cells masquerading as memory cells // Journal of immunology. 2000. V. 165. № 4. P. 1733–1737.
Stephen C. Jameson, You Jeong Lee, and Kristin A. Hogquist Innate Memory T cells // Adv Immunol., 2015. V. 126. P. 173–213. https://doi.org/10.1016/bs.ai.2014.12.001
Moxham V.F., Karegli J., Phillips R.E., Brown K.L., Tapmeier T.T., Hangartner R., Sacks S.H., Wong W. Homeostatic proliferation of lymphocytes results in augmented memory-like function and accelerated allograft rejection // Journal of immunology. 2008. V. 180. № 6. P. 3910–3918.
Steve Oghumu, Cesar A. Terrazas, Sanjay Varikuti, Jennifer Kimble, Stephen Vadia, Lianbo Yu, Stephanie Seveau, and Abhay R. Satoskar. CXCR3 expression defines a novel subset of innate CD8+ T cells that enhance immunity against bacterial infection and cancer upon stimulation with IL-15 // FASEB J. 2015. V. 29. P. 1019–1028.
Cheung K.P., Yang E., & Goldrath A.W. Memory-like CD8+ T cells generated during homeostatic proliferation defer to antigen-experienced memory cells // Journal of immunology. 2009. V. 183. V. 5. P. 3364–3372. https://doi.org/10.4049/jimmunol.0900641
Wang L.X., Li Y., Yang G., Pang P., Haley D., Walker E.B., Hu H.M. CD122+ CD8+ Treg suppress vaccine-induced antitumor immune responses in lymphodepleted mice // European journal of immunology. 2010. V. 40. № 5. P. 1375–1385. https://doi.org/10.1002/eji.200839210.CD122
Le Campion A., Gagnerault M., Auffray C., Bécourt C., Poitrasson-Rivière M., Lallemand E., Lucas B. Lymphopenia-induced spontaneous T-cell proliferation as a cofactor for autoimmune disease development // Blood. 2009. V. 114. № 9. P. 1784–1793. https://doi.org/10.1182/blood-2008-12-192120
Jason T. White, Eric W. Cross, Matthew A. Burchill, Thomas Danhorn, Martin D. McCarter, Hugo R. Rosen, Brian O’Connor & Ross M. Kedl. Virtual memory T cells develop and mediate bystander protective immunity in an IL-15-dependent manner // Nat Commun. 2016. V. 7. P. 11291. https://doi.org/10.1038/ncomms11291
Hickman S.P., Turka L.A. Homeostatic T cell proliferation as a barrier to T cell tolerance // Philos Trans R Soc Lond B Biol Sci. 2005. V. 360. № 1461. P. 1713–1721. https://doi.org/10.1098/rstb.2005.1699
Silaeva Y.Y., Kalinina A.A., Vagida M.S., Khromykh L.M., Deikin A.V., Ermolkevich T.G., Sadchikova E.R., Goldman I.L, Kazansky D.B. Decrease in pool of T lymphocytes with surface phenotypes of effector and central memory cells under influence of TCR transgenic β-chain expression. // Biochemistry (Mosc). 2013. V. 78. № 5. P. 549–559. https://doi.org/10.1134/S0006297913050143
Luc Van Kaer. Innate and virtual memory T cells in man. // Eur J Immunol. 2015. V. 45. № 7. P. 1916–1920. https://doi.org/10.1002/eji.201545761
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


