Доклады Российской академии наук. Науки о жизни, 2021, T. 499, № 1, стр. 296-300
УЛЬТРАДИАННЫЕ РИТМЫ ТЕМПЕРАТУРЫ ТЕЛА СВЯЗАНЫ С ОСОБЕННОСТЯМИ ПОВЕДЕНИЯ У ЗЕЛЕНУШКИ (Chloris chloris, Fringillidae, Aves)
М. Е. Диатроптов 1, *, А. С. Опаев 1, член-корреспондент РАН А. В. Суров 1
1 ФГБУН “Институт проблем экологии и эволюции им. А.Н. Северцова РАН”
Москва, Россия
* E-mail: diatrom@inbox.ru
Поступила в редакцию 09.03.2021
После доработки 24.03.2021
Принята к публикации 24.03.2021
Аннотация
Ранее у самцов зеленушки нами выявлены ультрадианные ритмы температуры тела, которые группируются в нескольких частотных диапазонах (3–6, 8–10, 12–20, 40–60 мин). При этом выделялась группа птиц, у которых доминируют 3–7-минутные ритмы – у них низкий коэффициент отношения средней спектральной плотности гармоник в диапазоне 12–20 мин к аналогичному показателю для 3–7 мин. В настоящей работе мы проверяли гипотезу о связи ритмов температуры тела с активностью нервной системы, а именно – с поведением и темпераментом. Проведено две серии поведенческих тестов – для оценки уровня агрессивности (n = 12 самцов) и реакции на новизну (n = 17). Оказалось, что особи, у которых преобладают ритмы в диапазоне 3–7 мин, менее агрессивны и медленнее привыкают к новым условиям. Таким образом, установлена связь между особенностями поведения, темпераментом и ультрадианными ритмами температуры тела у зеленушек.
Цикличность характерна для многих процессов в живой природе. Часто она совпадает с цикличностью в проявлении абиотических факторов – например, сезонностью или чередованием темного и светлого времени суток. Но известны и ультрадианные ритмы с периодом менее 24 ч. Они изучены хуже, их функциональное значение менее понятно [1]. Проявления ультрадианной ритмики могут затрагивать, например, уровень гормонов в крови, двигательную активность, сердцебиение [2–4], а также температуру тела.
Ранее мы изучали температуру тела у зеленушки (Chloris chloris) [5]. У этого вида ночью температура на 4–5°С ниже, чем днем (рис. 1а). Днем выявлены ультрадианные ритмы с амплитудой не более 0.3–0.5°С (рис. 1б). У большинства самцов такие ритмы группируются в нескольких частотных диапазонах, их периоды составляют около 40–60, 16–20, 11–13, 6–8 и 3–5 мин. Амплитуда ритмов имеет индивидуальную изменчивость. В частности, некоторые самцы выделялись выраженными 3–7-минутными ритмами (красная линия на рис. 1б).
Рис. 1.
Динамика температуры тела зеленушек в течение суток (а) и за два дневных часа тех же суток (б). Приведены данные для двух самцов – с коротким (красная линия) и протяженным (синяя линия) желтым полем на рулевом пере.
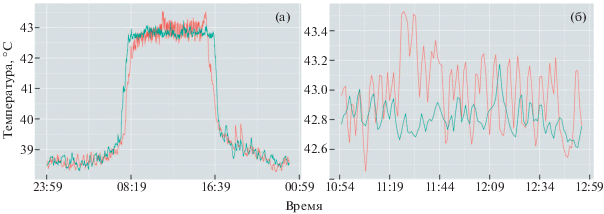
Динамика температуры тела в диапазоне около 3–20 мин как у животных, так и у человека определяется, вероятно, тонусом вегетативной нервной системы: блокада как симпатических, так и парасимпатических влияний приводит к исчезновению колебаний [6]. Одним из эффективных физиологических методов для оценки регуляторных влияний вегетативной нервной системы, в частности на сердце, является вариабельность сердечного ритма [7]. Этот метод применяется не только при исследовании деятельности сердечно-сосудистой системы, но и для оценки адаптационных возможностей всего организма, отражающегося в балансе симпатических/парасимпатических реакций. Важным показателем в методике оценки вариабельности сердечного ритма является соотношение высоко- и низкочастотных ритмических изменений временных интервалов между сердечными сокращениями. Мы предположили, что аналогичный прием анализа ритмических изменений температуры тела, но в более низкочастотном диапазоне периодов, может быть информативен для оценки баланса автономной нервной системы, лабильность которой связана с понятием силы процессов возбуждения и торможения центральной нервной системы. Следовательно, индивидуальные характеристики ритмики температуры тела могут быть связаны с темпераментом животных и/или их поведением. В данной работе мы соотнесли особенности поведения самцов зеленушки, имеющих разную выраженность ультрадианных ритмов изменения температуры тела в диапазоне 3–20 мин.
Зеленушек отловили в сентябре–октябре 2019 и 2020 г. в с. Ярустово (Рязанская обл.). Птиц содержали до весны следующего года в индивидуальных клетках в помещении. Зимой 2019–2020 гг. мы содержали 12 самцов, а зимой 2020–2021 гг. – 17 самцов. С целью стандартизации зимой 2020–2021 гг. исследование проводили на птицах в возрасте до года. Динамику температуры тела регистрировали в декабре: в 2019 г. изучены 9 самцов, а в 2020 г. – 14 самцов. Температуру тела регистрировали с помощью датчиков ДТН4-28 (“ЭМБИ РЕСЕРЧ”), которые имплантировали в брюшную полость на 20–40 дней. В качестве анестетика при операции использовали золетил (Virbac Sante Animale), который вводили внутримышечно из расчета 3–7 мг/кг. Датчик позволял регистрировать температуру тела каждую минуту и накапливать данные за весь период эксперимента. Спектральная плотность мощности ритмов определялась методом быстрого преобразования Фурье в программе Statistica 7.0. Далее вычисляли среднюю спектральную плотность в диапазонах периодов 12–20 и 3–7 мин, и находили их отношение (далее: отношение 12–20/3–7 мин). Этот показатель отражает выраженность амплитуды ритмов с периодами 12–20 мин по отношению к ритмам с периодами 3–7 мин.
Для оценки поведенческих особенностей разных самцов мы использовали два подхода: прямой и непрямой. В качестве непрямого метода использовали окраску оперения, которая у птиц может отражать особенности поведения и темперамента, например, уровень агрессивности или смелость ↔ трусливость [8, 9]. Мы использовали протяженность (в % от общей длины) желтого поля второго с краю рулевого пера. Это перо двухцветное – его дистальная часть черная, а основание желтое. Ранее было показано, что данный признак индивидуален (стабильно различается между особями) и вероятно связан с физиологическими и/или генетическими особенностями птиц [10].
Для прямой оценки поведения проведено две серии опытов. Зимой 2019–2020 гг. изучали агрессивное поведение птиц, а зимой 2020–2021 гг. – отношение к новому предмету.
Для изучения агрессивного поведения в каждую из шести клеток посадили по два самца. “Пары” подбирались таким образом, чтобы входящие в них птицы были контрастны по протяженности желтой части рулевого пера и относились к одной возрастной когорте.
По истечении 2–3 нед в каждой клетке выявился более агрессивный доминант и подчиненный. Все подчиненные зеленушки потеряли большую часть оперения затылочной области (оно было выщипано доминантом). Доминантом во всех случаях стал самец с большей протяженностью желтой части пера. Медиана отношения 12–20/3–7 мин была больше у доминантов: 2.6 (2.3–2.9, n = 4) против 2.2 (1.0–2.4, n = 5) у подчиненных (различия достоверны по критерию Манна–Уитни: W = 18.5, p = 0.049).
Отношение к новизне изучали на 17 самцах. Опыты проводили по методике [8]. В 10 ч утра птиц лишали корма. Через 3.5 ч в клетку помещали новую кормушку яркого цвета. Отмечали время, по истечении которого птица начинала клевать из нее семена, что служило показателем отношения птицы к новизне. Если самец не подходил к кормушке в течение 30 мин, опыт прекращали. С каждым из самцов эксперимент повторяли два раза, с интервалом около 10 дней. В первой серии экспериментов кормушка была оранжевого цвета, а во второй – ярко-голубого. В опытах с оранжевой кормушкой в течение 30 мин к ней подошли 12 самцов из 17. К голубой кормушке подошли все 17 птиц. Время подхода к одной и другой кормушке коррелировало: коэффициент корреляции Спирмена R = 0.65, p = 0.023, n = 12. Значит, данный опыт выявляет индивидуальные особенности поведения.
Для выявления связи между отношением 12–20/3–7 мин и временем подхода к кормушке использовали обобщенные линейные модели со смешанными эффектами (GLMM). В этом анализе использовали случайный фактор: массу тела самца, измеренную ранним утром в день первого эксперимента. Это было сделано потому, что упитанность/истощенность птиц может влиять на пищевую мотивацию и результаты опыта. Время подхода к оранжевой кормушке достоверно не зависело от отношения 12–20/3–7 мин (GLMM: DF = 7, t = –1.69, p = 0.135, n = 9). А время подхода к голубой зависело (GLMM: DF = 12, t = –1.81, p = 0.005, n = 14). При этом сам характер зависимости был схож в обоих экспериментах (рис. 2а–2б). Время подхода к оранжевой (GLMM: DF = 10, t = –0.99, p = 0.027, n = 12) и голубой (GLMM: DF = 15, t = –1.13, p = 0.004, n = 17) кормушкам достоверно зависело от протяженности желтого поля пера (рис. 2в–г).
Рис. 2.
Время подхода к оранжевой кормушке (а, в) в первой серии опытов, и к голубой кормушке (б, г) во второй серии опытов в зависимости от отношения 12–20/3–7 мин (вверху) и доли желтого цвета от общей длины 4-го рулевого пера (%) (внизу).
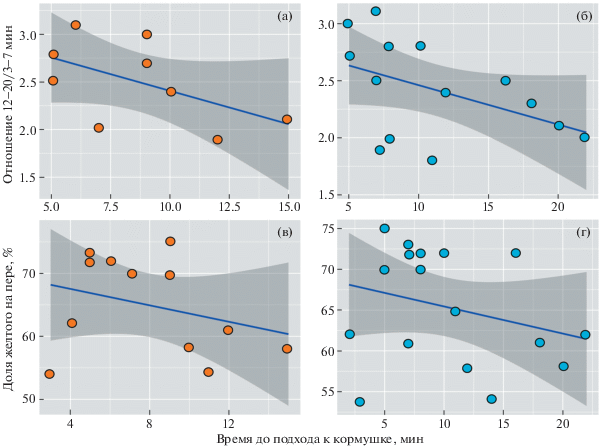
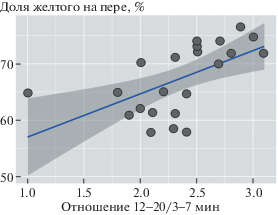
Проведенные опыты показали, что птицы с меньшей протяженностью желтого цвета на рулевом пере (1) были подчиненными при парных ссаживаниях и (2) были более боязливы (дольше подходили к незнакомой кормушке). По данным за оба года исследования, протяженность желтого на хвосте коррелировала с отношением 12–20/3–7 мин: коэффициент корреляции Спирмена R = = 0.69, p < 0.001, n = 23 (рис. 3). Значит, у подчиненных и боязливых птиц (мало желтого) ультрадиадные ритмы температуры тела с периодичностью 3–7 мин были выражены сильнее (пример: рис. 1б).
Рис. 3.
Взаимосвязь отношения 12–20/3–7 мин и доли желтого цвета от общей длины 4-го рулевого пера (%).
Интересно, что доза анестетика (золетил), необходимая для обездвиживания птиц с высоким показателем доли желтого в хвосте (70–80%), была в 1.5–2 раза больше, чем для птиц с маленькой долей желтого. Это дополнительно подтверждает различие в реактивности нервной системы у зеленушек с разной степенью развития желтого цвета на рулевых перьях.
Подобные данные есть и в литературе. У птенцов сипухи (Tyto alba) выявлена зависимость размера черных пятен оперения от продолжительности и выраженности около 4-часовых ультрадианных ритмов чередования активности/покоя [1]. Этот факт авторы связывают с различными стратегиями поведения, свойственными многим животным: проактивные и реактивные [11]. Результаты наших исследований показывают, что самцов зеленушек с маленькой площадью желтого в хвосте и выраженными 3–7-минутными колебаниями температуры можно отнести к реактивным особям, более “трусливым” и менее агрессивным.
Выявленная нами закономерность – преобладание высокочастотных колебаний в динамике ежеминутных изменений температуры тела у менее эмоционально-устойчивых особей – вероятно, определяется эндогенными причинами, связанными с особенностями функционирования вегетативной нервной системы. Однако ранее нами было показано, что на динамику изменения температуры тела влияет экзогенный фактор внешней среды [5]. В частности, установлена связь колебаний температуры тела в диапазоне 4–16 мин с Рс5 пульсациями геомагнитного поля [12]. В нашей работе менее агрессивные птицы и боязливые в отношении новых объектов, имели более выраженные короткопериодические колебания температуры тела и, вероятно, большую чувствительность к геомагнитному полю, в отличие от особей, проявляющих склонность к доминированию и более уверенному поведению.
В данной работе мы продемонстрировали возможность оценки состояния автономной нервной системы по выраженности спектральной плотности гармоник изменения температуры тела разного диапазона периодов. Этот прием может быть также применен в области исследования индивидуальных психофизиологических реакций, уровня стрессорной нагрузки и других биологический параметров, имеющих отражение в балансе симпатического/парасимпатического звена вегетативной нервной системы.
Список литературы
Scriba M.F., Henry I., Vyssotski A.L., Mueller J.C., Rattenborg N.C., Roulin A. // Journal of Biological Rhythms. 2017. V. 3. № 5. P. 456–468.
Gerkema M.P., Daan S., Wilbrink M., Hop M.W., van der Leest F. // Journal of Biological Rhythms. 1993. V. 8. Iss. 2. P. 151–171.
Kimura F., Tsai C.W. // Journal of Physiology. 1984. V. 353. Iss. 1. P. 305–315.
Tornatzky W., Cole J.C., Miczek K.A. // Physiology and Behavior. 1998. V. 63. Is. 5. P. 845–853.
Диатроптов М.Е., Панчелюга В.А., Панчелюга М.С., Суров А.В. // Доклады Российской академии Наук. Науки о жизни. 2020. Т. 494. № 1. С. 472–476.
Braulke L.J., Heldmaier G. // Cryobiology. 2010. V. 60. № 2. P. 198–203.
Баевский Р.М. // Успехи физиологических наук. 2006. Т. 37. № 3. С. 42–57.
Mateos-Gonzalez F., Senar J.C. // Animal Behaviour. 2012. V. 83. Iss. 1. P. 229–232.
Williams L.J., King A.J., Mettke-Hofmann C. // Animal Behaviour. 2012. V. 84. Iss. 1. P. 159–165.
Karu U., Saks L., Hõrak P. // Physiological and Biochemical Zoology. 2007. V. 80. № 6. P. 663–670.
Koolhaas J.M., Korte S.M., De Boer S.F., Van Der Vegt B.J. Van Reenen C.G., Hopster H., De Jong I.C., Ruis M.A.W., Blokhuis H.J. // Neuroscience and Biobehavioral Reviews. 1999. V. 23. Iss. 7. P. 925–935.
Диатроптов М.Е., Ягова Н.В., Петровский Д.В., Суров А.В. // Бюлл. эксп. биол. и мед. 2021. Т. 171. № 5. С. 639–634.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


