Доклады Российской академии наук. Науки о жизни, 2021, T. 499, № 1, стр. 375-380
ХИМИЧЕСКАЯ ИНДУКЦИЯ ГИПОКСИИ ТРОФОБЛАСТА ХЛОРИДОМ КОБАЛЬТА ПРИВОДИТ К ПОВЫШЕНИЮ ЭКСПРЕССИИ DDIT3
Е. Н. Князев 1, 2, 3, *, С. Ю. Пауль 2, 4, член-корреспондент РАН А. Г. Тоневицкий 1, 2
1 Федеральное государственное бюджетное учреждение науки Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
2 Факультет биологии и биотехнологии, Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
3 Центр трансляционных технологий
Москва, Россия
4 Троицкий инженерный центр
Москва, Россия
* E-mail: knyazevevg@gmail.com
Поступила в редакцию 05.04.2021
После доработки 19.04.2021
Принята к публикации 22.04.2021
Аннотация
Клетки хориокарциномы BeWo b30 используются для моделирования гипоксии трофобласта плаценты человека с применением хлорида кобальта (II) и производного оксихинолина (ПО) в качестве химических индукторов фактора, индуцируемого гипоксией (HIF). В данном исследовании было показано, что оба вещества активируют гипоксический путь и эпителиально-мезенхимальный переход и подавляют пути клеточной пролиферации. Однако CoCl2 вызывал активацию пути апоптоза, что выражалось в повышении активности эффекторных каспаз-3 и 7, и увеличивал экспрессию мишени ответа на несвернутые белки DDIT3. При воздействии CoCl2 активировался путь mTORC1, в то время как ПО подавляло данный путь, как это происходит при реальной гипоксии трофобласта. Таким образом, воздействие CoCl2 на клетки BeWo b30 может являться моделью более тяжелой гипоксии с активацией апоптоза, а ПО имитирует умеренную гипоксию.
При нормальном развитии плаценты на 9–10-й день после оплодотворения клетки цитотрофобласта мигрируют в спиральные артерии матки и замещают эндотелий, формируя сосуды с высоким потоком, устойчивые к действию факторов, регулирующих тонус сосудов. Нарушение инвазии трофобласта в сосуды вследствие гипоксии и других факторов приводит к нарушению кровоснабжения, эндоплазматическому стрессу и повышению апоптоза клеток трофобласта [1].
Изучение биологии плаценты при беременности у людей ограничено по этическим причинам, а плацента после нормальных родов или кесарева сечения не отражает ранних этапов развития плаценты, важных для патогенеза преэклампсии. Животные модели плаценты отличаются от человеческой как на анатомическом, так и на молекулярном уровне [2]. В связи с этим особое значение приобретают модели плацентарного барьера in vitro. Первичные клетки трофобласта человека имеют ограниченный потенциал деления и низкую воспроизводимость результатов при использовании клеток от разных доноров. Использование иммортализованных клеточных линий, имитирующих нормальный трофобласт, таких как линия хориокарциномы человека BeWo b30, позволяет достичь лучшей воспроизводимости, а применение внеклеточного матрикса и микрофлюидных устройств для имитации естественного микроокружения и кровотока еще больше приближает модели in vitro к физиологическим условиям [3].
Центральным звеном активации гипоксического пути является накопление индуцируемого гипоксией фактора 1 альфа (HIF-1α). При нормоксии HIF-1α гидроксилируется HIF-пролилгидроксилазами (PHD), что создает условия для присоединения белка фон Гиппеля–Линдау (pVHL) и запуска убиквитинилирования и протеасомной деградации HIF-1α [4]. В условиях гипоксии активность PHD подавляется, уровень HIF-1α повышается, происходит его транслокация в ядро и гетеродимеризация с конститутивно4й субъединицей HIF-1β, что вызывает транскрипцию генов-мишеней [5].
Индукция гипоксии с помощью CoCl2 достигается за счет замещения ионов Fe2+ в активном центре PHD на ионы Co2+. Также CoCl2 вызывает окисление аскорбатов, являющихся важными кофакторами PHD, связывается с HIF-1α, препятствуя взаимодействию с pVHL, и ингибирует аспарагинилгидроксилазу FIH, ингибирующую HIF. Более подробно механизмы действия CoCl2 описаны в обзоре [6]. Следует отметить, что гены, экспрессия которых изменяется при действии CoCl2, лишь частично пересекаются с таковыми при дефиците кислорода, что может объясняться действием CoCl2 на другие ферменты и сигнальные пути клетки [7] и ставит под вопрос релевантность данной модели гипоксии.
Ранее было показано, что для химического моделирования гипоксии также могут использовать производные оксихинолина (ПО), которые связываются с ионом Fe2+ в активном центре PHD, но не других известных ферментов этого семейства, что приводит к ингибированию гидроксилирования HIF-1α, его накоплению в клетке и активации гипоксийного пути [8]. Заместители в 7 положении ПО имитируют структуру домена HIF-1α, контактирующего с активным центром PHD, что обеспечивает специфичное связывание с этими ферментами и уменьшает число побочных эффектов по сравнению с использованием CoCl2 [9, 10].
Целью данного исследования являлось сравнение изменений в клетках на уровне транскриптома при воздействии CoCl2 и ПО на клетки хориокарциномы BeWo b30.
Клетки хориокарциномы BeWo b30 выращивались в 6-луночных планшетах в среде DMEM с L-глутамином и содержанием глюкозы 4.5 г/л с добавлением 10% фетальной бычьей сыворотки One Shot, 1% 100x MEM NEAA и 1% 100x Pen Strep. При достижении 80% конфлюэнтности клеточная среда заменялась на среду, содержащую 300 мкМ CoCl2 или 5 мкМ ПО 4896–3212. В контрольных условиях производилась замена на свежую культуральную среду. Спустя 24 ч производилась оценка метаболической активности клеток MTT-тестом, а также активности каспазы-3 и 7 как показатель эффекторной фазы апоптоза набором реагентов Abcam Caspase-3 Assay Kit.
Выделение тотальной РНК проводили методом гуанидинтиоцианат-фенол-хлороформной экстракции [11] с помощью набора реагентов Qiagen miRNeasy Mini Kit. Концентрация РНК определялась на приборе NanoDrop 1000 [12]. Качество РНК оценивалось на приборе Bio-Rad Experion по значению RQI [13].
Секвенирование следующего поколения производилось на приборе Illumina NextSeq 500 с подготовкой библиотек набором Illumina Stranded mRNA Library Prep Kit. Изменение экспрессии генов считалось достоверным при кратности различий более 2.0 и p-значении для t-критерий Стьюдента с поправкой Бенджамини–Хохберга на множественность сравнений менее 0.05 [14]. Были определены активированные и подавленные сигнальные пути с использованием коллекции MSigDB.
Тяжелая гипоксия, оксидативный стресс при действии реактивных форм кислорода (ROS) и эндоплазматический стресс могут вызывать активацию внутреннего сигнального пути апоптоза. Эффекторная фаза апоптоза связана с активацией каспаз-3 и 7, обусловливающих основные процессы апоптотической трансформации клеток [15]. Относительная активность каспазы-3 и 7 представлена в табл. 1 вместе с метаболической активностью по MTT-тесту. Из полученных данных можно сделать вывод, что при воздействии CoCl2 сильнее выражена активации апоптоза в клетках, что имитирует более тяжелую гипоксию трофобласта по сравнению с ПО. Отсутствие различий в результатах MTT-теста между двумя воздействиями свидетельствует, что оба вещества практически не оказывают значимого влияния на активность митохондрий клеток как реакцию на активацию гипоксического пути.
Воздействие CoCl2 на клетки BeWo b30 в течение 24 ч привело к статистически значимому изменению более чем в 2 раза экспрессии 3030 генов, а при воздействии ПО – 1030 генов, при этом экспрессия 287 генов изменялась однонаправленно при обоих условиях. При обоих типах воздействия был активирован гипоксический путь и эпителиально-мезенхимальный переход и подавлена активность путей, связанных с транскрипционными факторами семейства E2F и контрольной точкой G2M, т.е. путей клеточной пролиферации. Это совпадает с эффектами гипоксии на плаценту in vivo: активация HIF-1α в клетках трофобласта подавляет деление и стимулирует клеточную подвижность, что приводит к миграции клеток трофобласта и их инвазии в маточные сосуды [1].
На рис. 1а представлены профили экспрессии генов пути гипоксии в образцах контрольных клеток и при воздействии ПО и CoCl2, свидетельствующие об активации одинаковых мишеней HIF-1α. При анализе генов, экспрессия которых достоверно изменилась уникально для воздействия CoCl2, выявлена активация пути апоптоза и ответа на ROS. Это подтверждает данные, что кобальт может вызывать накопление ROS, вызывая повреждение ДНК и приводя к апоптозу [16].
Рис. 1.
Экспрессия генов, относящихся к сигнальному пути гипоксии (а) и апоптоза (б) в контроле и при воздействии ПО и CoCl2.

При этом среди генов, экспрессия которых изменилась только при воздействии ПО, активация данных путей не наблюдалась. На рис. 1в представлена экспрессия генов пути апоптоза, свидетельствующая, что картина в контроле и при воздействии ПО практически не отличается, в то время как кобальт вызывает значимую активацию данного пути.
Гипоксия, сопровождающаяся образованием ROS и цитоплазматическим стрессом, приводит к нарушению правильного свертывания белков и активации пути ответа на несвернутые белки. Данный путь приводит к адаптации клетки к гипоксии, однако тяжелая гипоксия, превышающая компенсаторные возможности клетки, приводит через указанный путь к накоплению фактора транскрипции CHOP, кодируемого геном DDIT3, запускающего апоптоз [17]. При воздействии ПО экспрессия DDIT3 значимо не изменялась, однако действие CoCl2 повышало экспрессию DDIT3 в 3.9 раза (p < 0.001). На рис. 2 отображена упрощенная схема пути ответа на несвернутые белки и отмечено повышение экспрессии CHOP, обнаруженное в нашем исследовании. По-видимому, воздействие CoCl2 имитирует более тяжелую форму гипоксии по сравнению с ПО. Было показано, что другое ПО, известное под названием адаптахин, препятствует активации апоптоза через ветвь ответа на несвернутые белки PERK/ATF4/CHOP [18], что согласуется с нашими наблюдениями.
Рис. 2.
Сигнальный путь ответа на несвернутые белки при имитации гипоксии CoCl2. Несвернутые белки в эндоплазматическом ретикулуме (ЭПР) связываются с белком BiP, что высвобождает белки PERK, IRE1α и ATF6. Все три ветви данного пути направлены на компенсацию эндоплазматического стресса, однако при срыве адаптации повышают экспрессию проапоптотического фактора транскрипции CHOP.

При анализе генов, экспрессия которых достоверно изменилась уникально для воздействия ПО, выявлено снижение окислительного фосфорилирования, что является нормальной реакцией клеток трофобласта при переходе от аэробного к анаэробному метаболизму при гипоксии [19].
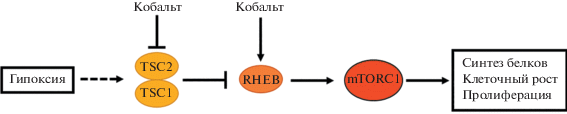
Следует особо отметить, что по результатам анализа сигнальных путей в клетках BeWo b30 при воздействии ПО происходит подавление сигнального пути mTORC1, а при воздействии CoCl2 – его активация. Известно, что гипоксия подавляет сигнальный путь mTORC1 [20]. При воздействии CoCl2 в 1.9 раза выросла экспрессия гена RHEB и в 2.5 раза упала экспрессия гена TSC2, в то время как при воздействии ПО экспрессия этих генов достоверно не изменялась, что может объяснять активацию пути mTORC1 при воздействии CoCl2 в отличие от ПО.
На рис. 3 отображена упрощенная схема одного из механизмов контроля пути mTORC1 и отмечено выявленное воздействие CoCl2 на гены TSC2 и RHEB.
Рис. 3.
Сигнальный путь mTORC1 при гипоксии. Гипоксия увеличивает активность комплекса TSC1/TSC2, инактивирующего белок RHEB, что приводит к подавлению активности mTORC1. При действии CoCl2 понижена экспрессия TSC2 и повышена экспрессия RHEB, что может объяснять активацию пути mTORC1.
Таким образом, сравнение двух химических моделей гипоксии, воздействия ПО и CoCl2, выявило активацию в трофобласте сигнального пути гипоксии и эпителиально-мезенхимального перехода и подавление клеточной пролиферации при обоих воздействиях, однако воздействие кобальта активировало гены, вовлеченные в сигнальный путь апоптоза, и более выраженно усиливало активность каспазы-3 и 7 в сравнении с контрольными условиями и воздействием ПО. CoCl2 активировал путь ответа на несвернутые белки и mTORC1, а ПО подавляло путь mTORC1. Все это указывает на то, что модель химической гипоксии с использованием ПО отражает воздействие умеренной гипоксии на клетки трофобласта, в то время как воздействие CoCl2 является повреждающим воздействием, сопровождающимся выраженным апоптозом. С клинической точки зрения различия в активация сигнальных путей при умеренной и тяжелой гипоксии могут означать необходимость разных подходов к лечению этих состояний. Апоптоз и нарушение инвазии трофобласта в сосуды матери при тяжелой гипоксии могут являться предпосылкой к развитию тяжелого осложнения беременности, преэклампсии [1]. Активация HIF-1α с помощью ПО может запускать в клетках антигипоксический ответ, подготавливая клетку к реакции на тяжелую гипоксию, что оказывает нейропротекторный эффект при инсульте и используется при лечении анемии, связанной с почечной недостаточностью [9]. Полученные результаты создают предпосылки для разработки подходов к профилактике развития гипоксических осложнений беременности.
Список литературы
Rana S., Lemoine E., Granger J.P., et al. Preeclampsia: Pathophysiology, Challenges, and Perspectives // Circ. Res. 2019. V. 124. № 7. P. 1094–1112.
Nikulin S.V., Knyazev E.N., Gerasimenko T.N., et al. Impedance Spectroscopy and Transcriptome Analysis of Choriocarcinoma BeWo b30 as a Model of Human Placenta // Mol. Biol. 2019. V. 53. № 3. P. 411–418.
Samatov T.R., Shkurnikov M.U., Tonevitskaya S.A., et al. Modelling the metastatic cascade by in vitro microfluidic platforms // Prog. Histochem. Cytochem. 2015. V. 49. № 4. P. 21–29.
Ohh M., Park C.W., Ivan M., et al. Ubiquitination of hypoxia-inducible factor requires direct binding to the β-domain of the von Hippel–Lindau protein // Nat. Cell Biol. 2000. V. 2. № 7. P. 423–427.
Maxwell P. Activation of the HIF pathway in cancer // Curr. Opin. Genet. Dev. 2001. V. 11. № 3. P. 293–299.
Muñoz-Sánchez J., Chánez-Cárdenas M.E. The use of cobalt chloride as a chemical hypoxia model // J. Appl. Toxicol. 2019. V. 39. № 4. P. 556–570.
Lendahl U., Lee K.L., Yang H., et al. Generating specificity and diversity in the transcriptional response to hypoxia // Nat. Rev. Genet. 2009. V. 10. № 12. P. 821–832.
Poloznikov A.A., Khristichenko A.Y., Smirnova N.A., et al. Structural optimization of adaptaquin, a HIF prolyl hydroxylase inhibitor // Russ. Chem. Bull. 2019. V. 68. № 1. P. 168–173.
Poloznikov A.A., Nikulin S.V., Zakhariants A.A., et al. “Branched Tail” Oxyquinoline Inhibitors of HIF Prolyl Hydroxylase: Early Evaluation of Toxicity and Metabolism Using Liver-on-a-chip // Drug Metab. Lett. 2019. V. 13. № 1. P. 45–52.
Poloznikov A.A., Zakhariants A.A., Nikulin S.V., et al. Structure-activity relationship for branched oxyquinoline HIF activators: Effect of modifications to phenylacetamide ‘tail’ // Biochimie. 2017. V. 133. P. 74–79.
Shkurnikov M.Y., Makarova Y.A., Knyazev E.N., et al. Profile of microRNA in Blood Plasma of Healthy Humans // Bull. Exp. Biol. Med. 2016. V. 160. № 5. P. 632–634.
Fomicheva K.A., Osip’yants A.I., Knyazev E.N., et al. Detection of Potential Metastatic Prostate Cancer Circulating Biomarkers by Comparison of miRNA Profiles in DU145 Cells and Culture Medium. // Bull. Exp. Biol. Med. 2017. V. 162. № 6. P. 792–796.
Shkurnikov M.Y., Knyazev E.N., Wicklein D., et al. Role of L1CAM in the Regulation of the Canonical Wnt Pathway and Class I MAGE Genes // Bull. Exp. Biol. Med. 2016. V. 160. № 6. P. 807–810.
Osip’yants A.I., Knyazev E.N., Galatenko A.V., et al. Changes in the Level of Circulating hsa-miR-297 and hsa-miR-19b-3p miRNA Are Associated with Generalization of Prostate Cancer // Bull. Exp. Biol. Med. 2017. V. 162. № 3. P. 379–382.
Sendoel A., Hengartner M.O. Apoptotic Cell Death Under Hypoxia // Physiology. 2014. V. 29. № 3. P. 168–176.
Simonsen L.O., Harbak H., Bennekou P. Cobalt metabolism and toxicology–A brief update // Sci. Total Environ. 2012. V. 432. P. 210–215.
Bartoszewska S., Collawn J.F. Unfolded protein response (UPR) integrated signaling networks determine cell fate during hypoxia // Cell. Mol. Biol. Lett. 2020. V. 25. № 1. P. 18.
Aimé P., Karuppagounder S.S., Rao A., et al. The drug adaptaquin blocks ATF4/CHOP-dependent pro-death Trib3 induction and protects in cellular and mouse models of Parkinson’s disease // Neurobiol. Dis. 2020. V. 136. P. 104725.
Illsley N.P., Caniggia I., Zamudio S. Placental metabolic reprogramming: do changes in the mix of energy-generating substrates modulate fetal growth? // Int. J. Dev. Biol. 2010. V. 54. № 2–3. P. 409–419.
Wouters B.G., Koritzinsky M. Hypoxia signalling through mTOR and the unfolded protein response in cancer // Nat. Rev. Cancer. 2008. V. 8. № 11. P. 851–864.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


