Доклады Российской академии наук. Науки о жизни, 2021, T. 499, № 1, стр. 322-326
СЕЛЕКЦИЯ ЛАБОРАТОРНЫХ МЫШЕЙ НА УСПЕШНОСТЬ КОГНИТИВНОГО ТЕСТА И НА НЕСПОСОБНОСТЬ К ЕГО РЕШЕНИЮ
О. В. Перепелкина 1, *, И. И. Полетаева 1
1 Биологический факультет, Московский государственный университет имени М.В. Ломоносова
Москва, Россия
* E-mail: ingapoletaeva@mail.ru
Поступила в редакцию 17.03.2021
После доработки 27.03.2021
Принята к публикации 27.03.2021
Аннотация
На основе линии мышей ЭКС, исходно селектированной на способность к экстраполяции, было получено 3 поколения мышей, селектированных на успешное решение теста на неисчезаемость (“плюс”-сублиния) и на отсутствие такого решения (“минус”-сублиния). Успешность решения теста, требующая не только оперирования правилом неисчезаемости по Ж. Пиаже, но и выполнения сложного действия (исполнительная функция) было достоверно выше у плюс-сублинии, что является уникальным примером успешной селекции на когнитивный признак.
В современной литературе существует большое число экспериментальных данных о роли генотипа в формировании когнитивных способностей животных [1–3]. Однако почти всегда речь при этом идет о различиях в выполнении когнитивных тестов за счет модуляции функции конкретных генов, определяющих отдельные свойства нейронных сетей (напр., [4–6] и др.). Отметим также, что в большей части таких работ термин “когнитивное” поведение подразумевает широкий спектр пластических функций, опирающихся главным образом на разные формы ассоциативного обучения [7, 8]. В настоящей работе в развитие представлений Л.В. Крушинского под когнитивными способностями животных понимается их способность улавливать закономерности, связывающие предметы и явления окружающего мира и строить на этой основе свое дальнейшее поведение [9]. Для анализа нейробиологических основ подобных когнитивных способностей и оценки взаимосвязи признаков поведения, в которых такие способности проявляются, требуется создание адекватных генетических моделей, в частности, линий животных, которые различались бы по данным когнитивным способностям. В статье представлены принципиально новые данные по первым поколениям искусственного отбора на высокие и низкие показатели решения когнитивного теста, выявляющего такого рода когнитивную способность у лабораторных мышей. Данный селекционный эксперимент был основан на разной успешности выполнения мышами теста на поиск входа в укрытие (ПВУ), построенного на стремлении животного спрятаться в темноте от яркого света. Эта задача (в англоязычной литературе – puzzle-box test) представляет собой тест на когнитивную способность per se, поскольку ее решение – это решение элементарной логической задачи, не требующее предварительного научения. В представленных экспериментах тест состоял из 4 предъявлений задачи (проб теста) нарастающей сложности. Исходный вариант теста был впервые предложен как часть батареи тестов для оценки у мышей фактора g. Фактор g, или фактор общего интеллекта, был введен в экспериментальную психологию Ч. Спирменом, который показал, что результаты ряда тестов на познавательные способности человека коррелируют между собой. В настоящее время в экспериментах на животных фактор g рассматривают как интегральный показатель когнитивных способностей, вычисляемый на основе статистической обработки данных большой батареи тестов [10]. Логическая структура теста ПВУ основана на наличии у животного способности к улавливанию правила “неисчезаемости” в трактовке Ж. Пиаже [11]. Мышь, помещенная в ярко освещенную часть экспериментальной камеры (30 × 28 × 27.5 см), стремится спрятаться в ее темной части (14 × 28 × 27.5 см), куда ведет углубленный в пол узкий лаз. В первой пробе лаз в темную часть камеры открыт, и животное может туда перейти без препятствий. Во второй пробе лаз в темную часть камеры маскируют чистой стружкой, насыпая ее вровень с полом, а в 3-й и 4-й пробах (которые наиболее трудны для решения) лаз блокируют легкой пробкой из пластика и картона, которую мышь может отодвинуть или вынуть зубами из углубленного лаза [11]. На решение 1-й и 2-й проб животному дается 180 с, на решение 3-й и 4-й проб – 240 с. После перехода в темную часть камеры мышь оставляют в ней на 15–20 с, после чего отсаживают в отдельную клетку, и через 45–60 с предъявляют следующую пробу. Регистрировали латентный период (ЛП) перехода мыши в темный отсек (а также факт решения или не-решения данного этапа теста). В случаях с лазом, закрытым пробкой, регистрировали у животного наличие или отсутствие у животного движений “манипулирования” пробкой, т.е. попыток проникнуть в темноту – захват пробки зубами, ее приподнимание. В случае отсутствия решения этого этапа теста в течение 240 с наличие или отсутствие такого манипулирования было важным для оценки поведения признаком (см. ниже).
Критериями отбора для “плюс” сублинии было успешное решение теста в его наиболее “трудном” варианте, когда лаз был закрыт пробкой (см. ниже), а для “минус” сублинии – отсутствие такого решения. В качестве исходной популяции для отбора были использованы мыши 20-го поколения селекции линии ЭКС [11]. Линия мышей ЭКС была получена в ходе проводившегося селекционного эксперимента на высокую способность к решению теста на экстраполяцию направления движения стимула, исчезнувшего из поля зрения. В первых поколениях этого эксперимента в селектируемой линии ЭКС было отмечено превышение доли правильных решений теста на экстраполяцию над случайным 50% уровнем [11], которое в последующих поколениях (с F9–10) стало обнаруживаться нерегулярно. В настоящей работе описаны результаты теста ПВУ, полученные у нескольких групп животных – у мышей ЭКС F20, составивших пары для получения потомства F1 данного селекционного эксперимента (n = 20), у мышей F1–F3 (сублинии ‘плюс” и “минус”, n = 378), а также у мышей контрольной неселектированной популяции КоЭКС (n = 34) (которая служила группой сравнения в селекции на высокие показатели решения теста на экстраполяцию [11]).
Выполнение теста ПВУ в первых двух пробах (лаз открыт и лаз замаскирован стружкой) было практически одинаковым у мышей групп “плюс” и “минус” и достаточно быстрым – на рис. 2 приведены средние ЛП решения этих проб. Различия между “плюс” и “минус” группами мышей этих поколений четко обнаруживались в пробах, когда лаз был закрыт пробкой, т.е. в 3-м и 4-м его предъявлениях (рис. 1 и 2), что может быть ответом на отбор в этих поколениях. За исключением мышей “+” в F2, показатели решения теста в 4-й пробе (т.е. доля мышей, решивших тест) были выше, а средние величины ЛП – короче, чем в 3-й пробе, что свидетельствует об использовании животными памяти о предыдущем решении.
Рис. 1.
Доля (в %, ось ординат) успешных решений теста на поиск входа в укрытие мышами F20 линии ЭКС (родители F1) (1), F1–F3 новых сублиний (“plus” и “minus“ группы – 2–4), и мышами неселектированной контрольной популяции F23 (5) в предъявлениях теста, когда лаз в темное отделение камеры был закрыт пробкой. Серые столбики – 1-е предъявление теста с пробкой, черные – 2-е. *, **, *** – значимо отличается от такой же доли в “минус“ сублинии того же поколения при р < 0.05, 0.01 и 0.001, соответственно (метод ȹ оценки различий альтернативных долей по Фишеру). #, & – отличия долей мышей, решивших эти пробы теста, от показателей “+” групп F1–F3 (с разными уровнями значимости, детали не представлены). Цифры над столбиками – число тестированных мышей каждой группы.

Рис. 2.
Средние (± ошибка средней арифм.) ЛП перехода мышей в темноту при решении последовательных проб теста (на поиск входа в укрытие) у мышей разных групп (см. рис. 1). а – лаз открыт, б – лаз замаскирован стружкой, в и г – лаз закрыт пробкой. Серые столбики – мыши сублинии “плюс”, черные – мыши сублинии “минус”. 1–5 – как на рис. 1. *, **, *** – статистически значимо отличается от соответствующей величины в “минус” сублинии того же поколения при р < 0.05, 0.01 и 0.001 соответственно (однофакторный ANOVA c post hoc тестом по Фишеру).
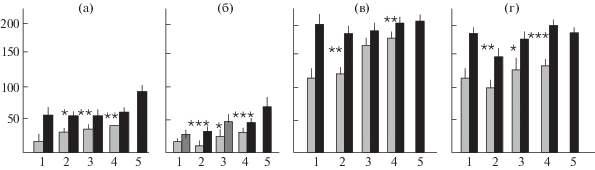
Решение теста ПВУ мышами КоЭКС в 3-й и 4-й пробах теста, когда “лаз” в темное отделение камеры закрыт пробкой, было значительно менее успешным, чем у мышей трех селекционных поколений (в F2 и F3, в том числе и для сублинии “минус”).
Наблюдения за поведением мышей в случаях, когда лаз был замаскирован пробкой, а решения теста не произошло, показали, что в большинстве случаев животные стараются зацепить зубами или толкнуть пробку, т.е. обнаруживают “манипулирование” этим объектом, что наблюдалось и у мышей F20, и у животных селектированных сублиний. Это поведение можно рассматривать как свидетельство того, что мышь пытается пройти через лаз, но не может преодолеть препятствие. Мышей, которые не “манипулировали” пробкой, было очень мало – в F3 в сублинии “плюс” было одно такое животное из 83, в сублинии “минус” – два из 73. В то же время среди контрольных мышей КоЭКС (тестированных в те же сроки, что и мышей F3), “не манипулировавших” пробкой животных было 8 из 34. Различия в успешности решения “трудных” этапов теста ПВУ, наиболее четко выраженные в последнем из тестированных поколений, в F3, могут служить свидетельством позитивной роли отбора по этим контрастным признакам. Следует напомнить, что обе сублинии происходили из линии ЭКС, которая в течение 20 поколений формировалась из потомства животных, успешно решивших когнитивный тест на экстраполяцию направления движения [11]. Логическая структура теста на экстраполяцию предполагает, что для его успешного решения животное должно понимать, что исчезнувший из поля зрения объект (поилка с молоком) продолжает существовать, и его можно искать. Таким образом, мыши обеих новых сублиний обладали в определенной степени пониманием принципа неисчезаемости, что и проявилось в том, что подавляющее большинство мышей пытались проникнуть в лаз, толкая и приподнимая пробку (т.е. “манипулируя” ею). Селекция на успешное и не успешное решение теста ПВУ в его варианте с пробкой выявила, таким образом, различия не в когнитивных способностях, как таковых, а в способности добиться конкретного решения, т.е. в проявлении так называемых “исполнительных функций” (executive function) у этих животных [12, 13]. Успешность выполнения теста, т.е. проявление “исполнительных функций” у мышей разного генотипа была показана в одной из первых работ с использованием данного теста [13]. При выполнении теста ПВУ при открытом лазе, а также при лазе, замаскированном стружкой, различия в проявлении исполнительных функций обнаруживались не в успешности решения этих этапов, а видимо, в ЛП реализации решения (с более быстрой реализацией попадания в темноту у мышей “плюс” групп) (рис. 2а, 2б). Поведение мышей двух сублиний сравнивали также в тесте на гипонеофагию, в котором животному предлагали новую пищу (сыр) в новой (но не пугающей) обстановке. Показатели этого теста, оценивающие реакцию на новое (являющейся также компонентом когнитивных способностей животных), были более четко выражены у мышей “плюс” групп (данные не представлены). Следует отметить, что в литературе по анализу когнитивного поведения лабораторных грызунов (т.е. по их способности к решению элементарных логических задач) аналогов представленного исследования нет. В настоящее время основное внимание исследователей как в области нейрогенетики в целом, так и в части роли генотипа в экспрессии когнитивных признаков, занимает анализ модуляции экспрессии большого числа генов у генетически измененных животных, и подобный список работ насчитывает многие десятки исследований. Особенно много таких данных получено в исследованиях генеза заболеваний центральной нервной системы [14–16 и др.], а экспериментальный подход с использованием батареи когнитивных тестов в этих задачах достаточно популярен [10, 17, 18 и др.]. Однако селекционных экспериментов практически не проводится и, в целом, эта область нейробиологии, несмотря на большой прогресс в выявлении важных для когнитивных функций структур мозга, сигнальных путей и групп специфических нейронов, остается пока недостаточно исследованной.
Таким образом, в данном исследовании впервые продемонстрированы достоверные различия в решении элементарной логической задачи, т.е. различия в экспрессии “исполнительных функций” у мышей, которые прошли 3 поколения селекции на “успешность” и “не-успешность” решения теста на “неисчезаемость”.
Список литературы
Graybeal C., Bachu M., Mozhui K., et al. Strains and stressors: an analysis of touchscreen learning in genetically diverse mouse strains // PLoS One. 2014. V. 9. № 2.
Saez I., Set E., Hsu M. From genes to behavior: placing cognitive models in the context of biological pathways // Front. Neurosci. 2014. V. 8. P. 336.
Sauce B., Matzel L. D. The paradox of intelligence: Heritability and malleability coexist in hidden gene-environment interplay // Psychol. Bull. 2018. V. 144. № 1. P. 26–47.
Bainbridge N.K., Koselke L.R., Jeon J., et al. Learning and memory impairments in a congenic C57BL/6 strain of mice that lacks the M2 muscarinic acetylcholine receptor subtype // Behav. Brain Res. 2008. V. 190. № 1. P. 50–58.
Too L.K., Li K.M., Suarna C., et al. Deletion of TDO2, IDO-1 and IDO-2 differentially affects mouse behavior and cognitive function // Behav. Brain Res. 2016. V. 312. P. 102–117.
Nolan S.O., Lugo J.N. Reversal learning paradigm reveals deficits in cognitive flexibility in the Fmr1 knockout male mouse // F1000Res. 2018. V. 7. P. 711.
Granseth B., Andersson F.K., Lindström S.H. The initial stage of reversal learning is impaired in mice hemizygous for the vesicular glutamate transporter (VGluT1) // Genes Brain Behav. 2015. V. 14. № 6. P. 477–485.
Manning E.E., Dombrovski A.Y., Torregrossa M.M, et al. Impaired instrumental reversal learning is associated with increased medial prefrontal cortex activity in Sapap3 knockout mouse model of compulsive behavior // Neuropsychopharmacology. 2019. V. 44. № 8. P. 1494–1504.
Перепелкина О.В., Лильп И.Г., Маркина Н.В. и др. Первый опыт селекции лабораторных мышей на высокую способность к экстраполяции. В кн.: Формирование поведения животных в норме и патологии: К 100-летию со дня рождения Л.В. Крушинского (1911–1984). М.: Языки славянских культур С. 263–296.
Galsworthy M.J., Paya-Cano J.L., Liu L., et al. Assessing reliability, heritability and general cognitive ability in a battery of cognitive tasks for laboratory mice // Behav. Genet. 2005. V. 35. № 5. P. 675–692.
Перепелкина О.В., Тарасова А.Ю., Огиенко Н.А. и др. Вес мозга и когнитивные способности лабораторной мыши // Успехи современной биологии // 2019. Т. 139. № 5. С. 434–445.
Yegla B., Foster T.C., Kumar A. Behavior model for assessing decline in executive function during aging and neurodegenerative diseases // Methods Mol. Biol. 2019. V. 2011. P. 441–449.
Ben Abdallah N.M., Fuss J., Trusel M., et al. The puzzle box as a simple and efficient behavioral test for exploring impairments of general cognition and executive functions in mouse models of schizophrenia // Exp. Neurol. 2011. V. 227. № 1. P. 42–52.
Giménez-Llort L., Schiffmann S.N, Shmidt T., et al. Working memory deficits in transgenic rats overexpressing human adenosine A2A receptors in the brain // Neurobiol. Learn. Mem. 2007. V. 87. № 1. P. 42–56.
Li Q., Chan S.Y., Wong K.K., et al. Tspyl2 Loss-of-function causes neurodevelopmental brain and behavior abnormalities in mice // Behav. Genet. 2016. V. 46. № 4. P. 529–537.
Hunsaker M.R. The importance of considering all attributes of memory in behavioral endophenotyping of mouse models of genetic disease // Behav. Neurosci. 2012. V. 126. № 3. P. 371–380.
Locurto C., Benoit A., Crowley C., et al. The structure of individual differences in batteries of rapid acquisition tasks in mice // J. Comp. Psychol. 2006. V. 120. № 4. P. 378–388.
Ene H.M., Kara N.Z., Barak N., et al. Effects of repeated asenapine in a battery of tests for anxiety-like behaviours in mice // Acta Neuropsychiatr. 2016. V. 28. № 2. P. 85–91.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


