Доклады Российской академии наук. Науки о жизни, 2021, T. 500, № 1, стр. 460-465
ОНТОГЕНЕТИЧЕСКАЯ, СВЕТОВАЯ И ЦИРКАДНАЯ РЕГУЛЯЦИЯ ЭКСПРЕССИИ ГЕНОВ РАР БЕЛКОВ ПРИ ПРОРАСТАНИИ СЕМЯН ARABIDOPSIS THALIANA
А. А. Андреева 1, Н. В. Кудрякова 1, *, член-корреспондент РАН Вл. В. Кузнецов 1, В. В. Кузнецов 1
1 Институт физиологии растений
им. К.А. Тимирязева РАН
Москва, Россия
* E-mail: nvkudryakova@mail.ru
Поступила в редакцию 23.04.2021
После доработки 22.05.2021
Принята к публикации 23.05.2021
Аннотация
Изучали профили экспрессии генов РАР, кодирующих белки, ассоциированные с пластидной мультисубъединичной РНК полимеразой, в сухих семенах, в процессе прорастания и на ранних стадиях развития проростков Arabidopsis thaliana. Детальный анализ уровней транскриптов PAP генов методом ОТ ПЦР показал, что переход семян от состояния покоя к активному росту сопровождается резким повышением содержания транскриптов всех исследованных генов в первые сутки прорастания как на свету, так и в темноте. Дальнейшие изменения в уровнях транскриптов различались у разных РАР генов и, по-видимому, определялись их функциональной специфичностью. Впервые установлено, что экспрессия индивидуальных РАР генов регулируется наряду с факторами онтогенетической и световой природы циркадными ритмами.
ВВЕДЕНИЕ
В основе биогенеза хлоропластов лежит координированная экспрессия ядерного и хлоропластного геномов, которая регулируется онтогенетической программой и факторами внешней среды. Ведущую роль при этом играют регуляторные белки и, прежде всего, регуляторы пластидной транскрипции. К их числу, наряду с хлоропластными РНК-полимеразами ядерного (NEP) и пластидного (PEP) кодирования и сигма факторами, относятся 12 белков, ассоциированных с PEP. Этим белкам, кодируемым ядерным геномом, отводится особая роль на начальных этапах фотоморфогенеза. Только после их присоединения к коровым субъединицам мультисубъединичной РЕР образуется полноценный транскрипционный комплекс и формируются функциональные хлоропласты. Инактивация любого из этих генов приводит к блокированию программы перехода от ското- к фотоморфогенезу и появлению фенотипа albino, нежизнеспособного в отсутствие внешних источников углеводов [1, 2]. PAP белки различаются по своей структуре и функциям и принимают участие в метаболизме нуклеиновых кислот и редокс-зависимых реакциях. In silico анализ транскриптомных данных позволяет предположить, что РАР гены образуют жестко контролируемый регулон [1], однако исследование их экспрессии на разных стадиях жизненного цикла Arabidopsis свидетельствовало о селективном действии света и тканеспецифичности, сочетаемой с онтогенетической изменчивостью [3].
Гены РАР экспрессируются уже на этапе, предшествующем формированию хлоропластов. Эти результаты были получены при анализе особенностей накопления транскриптов РАР при переходе от ското- к фотоморфогенезу этиолированных проростков, содержавших этиопласты [3], которые, как известно, представляют особую промежуточную фазу формирования хлоропластов. Однако для Arabidopsis более естественным является прорастание семян непосредственно на поверхности почвы, при котором программа скотоморфогенеза отсутствует, и эопласты семян трансформируются непосредственно в хлоропласты в тканях побега или в амилопласты в гипокотиле и корнях. При этом каждая из стадий прорастания сопровождается глубокими изменениями транскриптомных профилей, в том числе и компонентов аппарата транскрипции пластид и кодируемых ими пластидных генов [4].
В представленной работе проведен детальный анализ экспрессии генов РАР в сухих семенах и на разных стадиях прорастания, включая стратификацию, собственно прорастание и раннее развитие проростков A. thaliana. При этом особый упор был сделан на сравнение накопления транскриптов РАР на свету и в темноте. Такой подход позволил впервые показать, что при переходе семян от состояния покоя к активному росту изменения в интенсивности экспрессии генов РАР могли определяться не только онтогенетическими факторами и условиями освещения, но и циркадными ритмами, синхронизирующими активность компонентов аппарата транскрипции со временем суток.
МАТЕРИАЛ И МЕТОДЫ
Семена Arabidopsis thaliana экотипа Columbia сразу после извлечения из стручков высушивали в течение 15 дней в полной темноте (сухие семена), после чего их стратифицировали в течение 48 ч при 4°С (48 ч стратификации) [4]. Далее семена проращивали в климатической камере MLR-352Н-PE (Sanyo, Япония) в течение 72 ч в условиях постоянного белого света (75 μE m–2 s–1) или темноты при температуре 23°С на жидкой среде Мурасиге-Скуга, содержавшей 2% сахарозы, и фиксировали в жидком азоте через 1, 6, 12, 24, 48 и 72 ч.
Относительный уровень транскриптов оценивали методом полимеразной цепной реакции в режиме реального времени после обратной транскрипции (ОТ-ПЦР) на амплификаторе LightCycler 96 (“Roche”, Швейцария) с использованием готовой реакционной смеси, содержавшей флуоресцентный краситель SYBR Green I (Евроген, Россия), как описано ранее [5]. Последовательности праймеров практически для всех генов приведены в работе Андреевой и соавт. [5]. Последовательности праймеров еще четырех генов, использованных в данной работе, приводятся далее: CCA1, At2g46830 (F – CAGCTCCAATATAACCGATCCAT, R – CAATTCGACCCTCGTCAGACA), LHY, At1g01060 (F – ACGAAACAGGTAAGTGGCGACA, R – TGGGAACATCTTGAACCGCGTT), TOC1, At5g61380 (F – AATAGTAATCCAGCGCAATTTTCTTC, R – CTTCAATCTACTTTTCTTCGGTGCT), PP2A, At3g25800 (F – ACTGCATCTAAAGACAGAGTTCCA, R – CCACAAGCCCAGGACGAAT). Референсным геном служил ген регуляторной субъединицы А2 протеинфосфатазы PP2A. Все эксперименты проводили в трех биологических повторностях. На рисунках приведены средние значения и стандартные ошибки средних.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Уже к концу периода стратификации экспрессия большинства генов РАР возрастала в полтора-два раза по сравнению с исходными значениями в сухих семенах, а через час после начала проращивания усиливалась как в темноте, так и на свету. Наиболее высокие уровни накопления транскриптов в этих точках были зафиксированы для генов РАР5, 6 и 10. Варианты выявленных изменений приведены на рис. 1 на примере гена РАР2, который имеет наиболее типичный характер изменения уровня транскриптов, и PAP8, у которого уровень экспрессии снижался в процессе стратификации, что отличало его от всех других РАР генов. Следующие пять часов прорастания также сопровождались повышенным накоплением транскриптов всех исследованных генов при обоих световых режимах. При этом максимальные значения отмечались также для генов РАР5, 6, 8 и 10. В дальнейшем (12 и 24 ч после начала прорастания) наблюдалось замедление интенсивности экспрессии части РАР генов или даже ее снижение, особенно в темноте (РАР1, 2, 3, 5, 11). Последующая кинетика накопления транскриптов также различалась и, по-видимому, определялась функциональной специфичностью продуктов РАР генов. Для генов РАР3, 4, 6, 8, 10 и 11 максимальные уровни экспрессии были зафиксированы к 48 ч, а для РАР1, 2, 5, 7, 9 и 12 – к 72 ч. При этом после 48 ч прорастания для генов РАР2 и 5 дальнейшее накопление транскриптов сохранялось на свету, но отсутствовало в темноте. Следует подчеркнуть, что уровень накопления транскриптов всех генов, как правило, был выше на свету. Эти данные соответствуют концепции о свето-зависимой активации генов РАР, необходимой для трансформации ферментативного комплекса РЕР-В, образованного коровыми субъединицами РЕР и сигма факторами, в комплекс РЕР-А и формирования полностью функциональных хлоропластов [1].
Рис. 1.
Экспрессия генов PAP2 и PAP8 в сухих семенах, в ходе стратификации и на первых этапах роста проростков A. thaliana на свету (а) и в темноте (б).
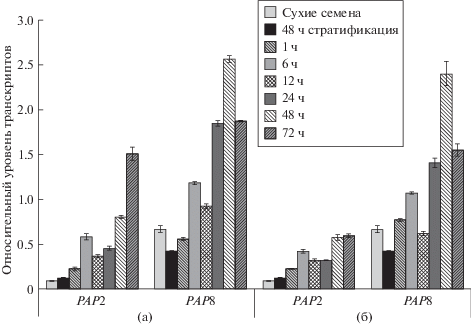
Свето-зависимая активация представляет собою лишь один из уровней регуляции экспрессии генов РАР при прорастании, наряду с которой их функционирование определятся онтогенетическими программами. В пользу этого предположения свидетельствует сходный характер накопления транскриптов индивидуальных генов на свету и в темноте. Заметим в этой связи, что, согласно результатам Lieber и и соавт. [3], освещение индуцировало лишь слабый транзиторный рост экспрессии генов РАР при переходе от ското- к фотоморфогенезу. Ему предшествовало значимое накопление транскриптов РАР уже в темноте, позволявшее перейти к быстрому синтезу белков.
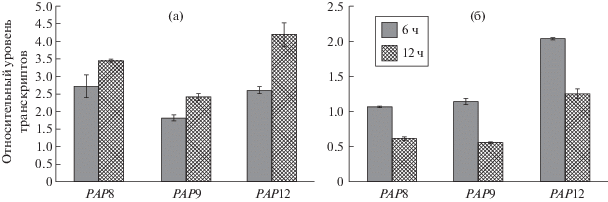
Двойной контроль онтогенетической регуляции (свето-зависимый и свето-независимый) не исчерпывает комплексности механизмов активации генов РАР. В соответствии с данными транскриптомного анализа Narsai и соавт. [4], первичные пики активности многих генов РАР наблюдались через 12 ч, а не через 6 ч после начала прорастания, как в наших экспериментах. Мы предположили, что эти различия, по крайней мере, для некоторых генов, связаны с действием циркадных часов, которые включаются уже на этапе замачивания семян (или даже в период их эмбрионального развития) и синхронизируют транскриптомные и метаболомные сети, обеспечивая оптимальный рост [6]. Действительно, при начале прорастания семян в 10 ч дня максимальный уровень транскриптов некоторых РАР генов наступает через 6 ч, однако если прорастание семян начинается в 4 ч утра, то максимальное содержание транскриптов будет достигнуто только через 12 ч (т.е. в 16 ч дня) (рис. 2). Ранее существование суточных ритмов в накоплении транскриптов РАР генов было показано нами у двухнедельных проростков Arabidopsis [7] с наиболее выраженной амплитудой для генов РАР3, 5, 6, 8, 9 и 12.
Рис. 2.
Относительный уровень транскриптов избранных генов РАР после 6 и 12 ч прорастания в зависимости от времени начала этапа прорастания: (а) начало проращивания в 4 ч; (б) начало проращивания в 10 ч.
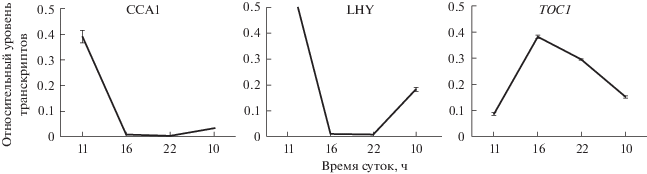
Циркадные ритмы генерируются так называемым центральным осциллятором, в основе работы которого лежат транскрипционные механизмы обратной связи. У Arabidopsis основными компонентами центрального осциллятора являются три гена CCA1 (CIRCADIAN CLOCK ASSOCIATED1), LHY (LATE ELONGATED HYPOCOTYL) и TOC1 (TIMING OF CAB EXPRESSION1), а также ряд дополнительных генов. CCA1 и LHY связываются с промотором TOC1, негативно регулируя его экспрессию, тогда как TOC1, в свою очередь, участвует в положительной регуляции CCA1 и LHY [8]. Суточные кривые накопления транскриптов центрального осциллятора при прорастании с утренним пиком активности CCA1 и максимумом экспрессии TOC1 в вечерние часы приведены на рис. 3. Центральный осциллятор ассоциирован с различными физиологическими процессами посредством регуляции экспрессии генов выхода (output genes). К их числу, например, принадлежит ген SIG5, контролирующий ритмы транскрипции пластидного гена psbD, а также некоторых других пластидных генов (всего 12% пластидных генов, в регуляции которых участвует SIG5) [9].
Рис. 3.
Кривые накопления транскриптов генов центрального осциллятора в первые сутки прорастания A. thaliana в темноте.
РАР гены, вероятно, также относятся к пулу потенциальных генов выхода центрального осциллятора, участвующих в регуляции циркадных ритмов пластидной транскрипции. В пользу этого предположения свидетельствует наличие цис-элементов в промоторах ряда РАР генов, связывающих компоненты центрального осциллятора (http://www.athamap.de/). Эта информация в совокупности с данными о регуляции осциллятором других целевых генов аппарата транскрипции (SIG1, 3, 4) [9] позволяет предположить возможность участия РАР генов в поддержании ритмичной экспрессии генов пластидного кодирования в соответствии со временем суток. Среди гипотетических кандидатов такого контроля – ген psbA, кодирующий D1 белок фотосистемы II. Известно, что, наряду с генами сигма факторов, специфическим регулятором его экспрессии является ген PAP2 [10].
Различия в уровне экспрессии РАР генов при прорастании могли объясняться не только интенсивностью транскрипции и селективной стабильностью транскриптов, но и функциональной специфичностью белков. Так, например, белок РАР5 содержал домен PEST, характерный для короткоживущих белков [11]. К тому же, РАР5, будучи белком ядерной и пластидной локализации, играет важную роль на начальном этапе биогенеза хлоропластов при переходе от скотоморфогенеза к фотоморфогенезу. Он необходим для формирования фототел при взаимодействии с фоторецептором phyB и деградации транскрипционных факторов PIF1 и PIF3 (PHYTOCHROME INTERACTING FACTORS 1 и 3), что снимает репрессию с генов фотосинтеза [12]. С белком РАР5 в ядре способен взаимодействовать PAP8, который также представляет собой один из ключевых регуляторов деэтиоляции. PAP8 участвует в опосредованной фитохромом трансдукции светового сигнала, деградации PIF1 и PIF3, стабилизации HY5 (ELONGATED HYPOCOTYL5) и накоплении транскриптов GLK 1 и 2 (GOLDEN2-LIKE 1 и 2), отвечающих за экспрессию ядерных фотосинтетических генов [13].
РАР6, в свою очередь, способен взаимодействовать с тиоредоксиновым доменом РАР10/trxZ in vivo, и повышенная экспрессия обоих генов, кодирующих эти белки в первые часы прорастания, могла быть связана с защитой транскрипционного аппарата пластид от окислительного стресса, который возникает в ходе деэтиоляции. Высокие уровни относительной экспрессии, особенно на этапе раннего развития проростков, отмечены также для гена РАР12. Известно, что в дрожжевой двугибридной системе PAP12 взаимодействует с белками PAP3, 5, 6 и 7, которые участвуют в регуляции редокс состояний, процессах фосфорилирования и фитохром-зависимом световом сигналинге [14].
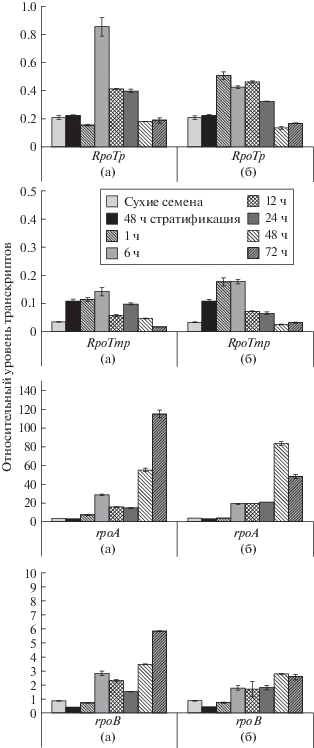
Динамика накопления транскриптов РАР в целом соответствовала значениям экспрессии генов РНК полимеразы пластидного кодирования rpoB и rpoA. Максимум их экспрессии на свету наблюдался через 72 ч, а в темноте через 48 ч после начала прорастания, но уже через 6 ч после начала прорастания содержание транскриптов этих генов существенно превышало их уровень в сухих семенах и к исходу стратификации (рис. 4). При этом содержание транскриптов NEP, RPOTp и RPOTmp достигало максимальных значений через 1 ч после начала прорастания в темноте и через 6 ч на свету, после чего снижалась. Таким образом, обе системы пластидной транскрипции, NEP и PEP, индуцировались непосредственно после начала прорастания, что соответствовало данным Demarsy et al. [15], согласно которым не только NEP, но и РЕР активны в еще не фотосинтезирующих пластидах прорастающих семян. Особо отметим, что активация экспрессии генов РАР, как составной части системы пластидной транскрипции, также происходит уже к исходу стратификации и нарастает в процессе становления траскрипционной системы пластид как на свету, так и в темноте. Это говорит о том, что, по крайней мере на уровне мРНК, РАР необходимы для нормального биогенеза пластид с самых ранних этапов прорастания.
Рис. 4.
Экспрессия генов NEP (RPOTp, RPOTmp) и PEP (rpoA, rpoB) в сухих семенах, в ходе стратификации, а также на первых этапах роста проростков A. thaliana на свету (а) и в темноте (б).
Таким образом, нам впервые удалось показать, что экспрессия генов РАР при прорастании семян регулируется факторами световой, онтогенетической и циркадной природы. При этом кинетика накопления транскриптов индивидуальных генов, очевидно, определялась их функциональной специфичностью наряду с механизмами корегуляции, интегрирующими работу компонентов транскрипционного аппарата пластид.
Список литературы
Pfannschmidt T., Blanvillain R., Merendino L., et al. // J. Exp. Bot. 2015. V. 66. P. 6957–6973.
Börner T., Aleynikova A.Y., Zubo Y.O., et al. // Biochim. et Biophys. Acta. 2015. V. 1847. P. 761–769.
Liebers M., Chevalier F., Blanvillain R., et al. // Planta. 2018. V. 248. P. 629–646. https://doi.org/10.1007/s00425-018-2924-8
Narsai R., Law R.S., Carrie C., et al., // Plant Physiology. 2011. V. 157. P. 1342–1362.
Andreeva A.A.,Vankova R., Bychkov I.A., et al. // Biomolecules. 2020. V. 10. P. 1658.
Farre E.M., Weise S.T. // Current Opinion in Plant Biology. 2012. V. 15. P. 293–300.
Danilova M.N., Kudryakova N.V., Andreeva A.A., et al. // Plant Physiology and Biochemistry. 2018. V. 129. P. 90–100.
Lu S.X., Knowles S.M., Andronis C., et al. // Plant Physiology. 2009. V. 150. P. 834–843.
Noordally Z.B., Ishii K., Atkins K.A., et al. // Science. 2013. V. 339. P. 1316–1319.
Pfalz J., Liere, K., Oelmüller R. // The Plant Cell. 2006. V. 18. P. 176–197.
Chen M., Galvao R.M., Li M.N., et al. // Cell. 2010. V. 141. P. 1230–1240.
Kusnetsov V.V., Doroshenko A.S., Kudryakova N.V., et al. // Russian Journal of Plant Physiology. 2020. V. 67. P. 971–984.
Liebers M., Gillet F-X., Abir I., et al. // EMBO Journal. 2020. V. 39. P. e104941.
Yu Q.B., Huang C., Yang Z.N. // Frontiers in plant science. 2014. V. 5. article 316.
Demarsy E., Courtois F., Azevedo J., et al. // Plant Physiol. 2006. V. 142. P. 993–1003.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


