Доклады Российской академии наук. Науки о жизни, 2021, T. 500, № 1, стр. 466-469
ВЛИЯНИЕ БИОМЕХАНИЧЕСКОЙ СОВМЕСТИМОСТИ И ТРОМБОГЕННОСТИ НОВОГО СИНТЕТИЧЕСКОГО СОСУДИСТОГО ПРОТЕЗА НА ЕГО ИНТЕГРАЦИЮ В АРТЕРИАЛЬНОЕ РУСЛО (ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ)
Ю. М. Цыганков 1, *, А. А. Сергеев 1, Ш. Т. Жоржолиани 1, А. Д. Шепелев 2, С. В. Крашенинников 2, Т. Х. Тенчурин 2, А. В. Агафонов 1, А. Ю. Городков 1, академик РАН Л. А. Бокерия 1
1 ФГБУ “Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева” Минздрава России
Москва, Россия
2 НИЦ “Курчатовский институт”
Москва, Россия
* E-mail: tsigankov_yura@mail.ru
Поступила в редакцию 18.05.2021
После доработки 22.05.2021
Принята к публикации 23.05.2021
Аннотация
Общим недостатком современных синтетических сосудистых протезов являются тромбогенность и отсутствие биомеханической совместимости с протезируемым сосудом. Для выяснения роли этих факторов в процессах интеграции протеза методом электроспиннинга были изготовлены протезы из известных материалов: поликапролактона, полиуретана и смеси фторсодержащего синтетического каучука СКФ-26 с фторопластом Ф-26. Прорастание протезов сравнивали со стандартным протезом из пористого ПТФЭ при имплантации свиньям в инфраренальный отдел аорты. Упруго-деформационные свойства протезов исследовали методом эластометрии в физиологическом диапазоне нагрузок. Тромбогенность материалов определяли по количеству адгезированных тромбоцитов. Проходимость протезов проверяли по данным аортографии. Прорастание протезов оценивали по данным гистологического исследования. Показано, что при данном наборе материалов биомеханическая совместимость оказалась более важным фактором интеграции, чем тромбогенность материала.
ВВЕДЕНИЕ
Развитие новой технологии электроформования методом электроспиннинга для изготовления протезов кровеносных сосудов (ПКС) позволяет создавать конструкции с заданными упруго-деформационными свойствами. Применение этой технологии с использованием традиционных синтетических материалов для изготовления изделий этого класса позволило разделить факторы эластичности и тромбогенности по их влиянию на процесс прорастания синтетического протеза при имплантации в артериальный сосуд.
Эластичность протеза является мерой биомеханической совместимости ПКС с отрезками нативного артериального сосуда. Биомеханически совместимый протез обеспечивает геометрический и гидродинамический континуум вдоль пути эволюции потока крови. При этом капсула, формируемая вокруг такого синтетического протеза, деформируется под действием пульсового давления, что неизбежно должно влиять на степень ее организации.
Тромбогенность материала протеза является мерой гемосовместимости и отражает комплекс процессов, происходящих на инородной поверхности при контакте с кровью реципиента. Для проверки тромбогенности оценивали степень адгезии тромбоцитов из нативной крови на поверхности материала в уcловиях ex vivo [1]. Этот метод показал свою релевантность в отношении материалов, контактирующих с потоком крови.
Целью работы было сравнение процессов вживления трубчатого синтетического матрикса, изготовленного из материалов, отличающихся по тромбогенности и упруго-деформационным свойствам, при имплантации в брюшную аорту свиней.
МЕТОДЫ
Для оценки тромбогенности цилиндрические камеры с 16 закрепленными образцами материалов перфузировали нативной кровью свиньи со сдвиговой скоростью 200 сек–1 в течение 1 мин. затем образцы промывали и окрашивали акридиновым оранжевым.
Подсчет тромбоцитов, адгезированных на поверхности материалов, проводили по микрофотографиям в ПО ToupView, полученным на люминесцентном микроскопе в ультрафиолетовой зоне спектра (длина волны 330–400 нм). Абсолютным показателем тромбогенности является коэффициент отношения площади, покрываемой тромбоцитами, к общей площади поля, выраженный в процентах. Так как степень адгезии существенно зависит от состояния животного, итоговый результат был представлен в относительных единицах, относительно показателя адгезии тромбоцитов на контрольном образце из фторопласта медицинского класса (Ф-4).
Изготовление трубчатых волоконных сосудистых протезов проводили методом электроспиннинга на однокапиллярной лабораторной установке с высоковольтным источником Spellman SL130PN30/1005 в НИЦ “Курчатовский институт”. Для формования образца использовали капилляр конструкции “колокольчик” [2] с аэродинамическим сопротивлением 10 мм вод. ст. В качестве осадительного электрода использовали заземленный стальной цилиндр длиной 10 см и диаметром торцов 10.5 мм с чистотой поверхности 7. Электрод вращался со скоростью 50 об/мин и совершал возвратно-поступательные движения для получения более равномерного покрытия электрода.
Эластометрию образцов ПКС проводили на универсальной испытательной машине INSTRON 5965 при однократном растяжении с постоянной скоростью и при циклическом растяжении (50 тыс. циклов). Исходные размеры ПКС были подобраны с учетом растяжения протеза при физиологическом пульсирующем давлении [3].
Эксперименты проведены на 12 свиньях самках породы Ландрас. Операции были проведены в условиях ИВЛ, с внутривенной анестезией. Каждому животному в инфраренальный отдел аорты был имплантирован один образец ПКС (диаметр 10 мм, длина 30 мм). Доступ к аорте осуществляли забрюшинно слева. Всего было имплантировано 3 протеза из поликапролактона (ПКЛ), 3 про-теза из полиуретана (ПУ), 4 протеза из смеси СКФ–26 + Ф–26 и 2 стандартных протеза из пористого политетрафторэтилена (ПТФЭ, производства НПК “Экофлон”, Россия). Для повышения стабильности структуры матриксов из СКФ–26 + + Ф–26 по отношению к длительным пульсирующим нагрузкам готовые матриксы подвергали радиационной обработке γ-облучением (источник Co60; поглощенная доза 0.3 МГр). Использованные синтетические материалы уже были применены в конструкциях экспериментальных ПКС [4] и в целом удовлетворяют требованиям, предъявляемым к материалам для эндопротезирования.
Контроль проходимости и пульсацию протезов проверяли на 3-й день и на 30-е сутки после имплантации с помощью аортографии. Степень прорастания протеза оценивали по данным гистологического исследования.
Все эксперименты проводили согласно этическим нормам, регламентирующим эксперименты на животных в соответствии с международными нормативно-правовыми документами [5, 6].
РЕЗУЛЬТАТЫ
По величине относительного показателя тромбогенности использованные материалы различались следующим образом: ПКЛ (0.065), ПУ (0.102), фторопласт Ф-4 (1.0) и СКФ–26 + Ф–26 (1.748). Таким образом, материал СКФ–26 + Ф–26 проявил максимальные, а материал ПКЛ – минимальные тромбогенные свойства.
Эластометрические исследования трубчатых матриксов из использованных материалов показали, что образцы из ПКЛ практически ригидны при физиологическом уровне нагрузок (податливость при пульсациях 50–150 мм рт.ст. составляла 0.07%/мм рт.ст.), образцы из ПУ обладали умеренной податливостью (0.12%/мм рт.ст.), а податливость образцов из СКФ–26 + Ф–26 была сравнима с податливостью нативной аортальной стенки (0.33%/мм рт.ст.).
Все образцы сосудистых протезов при имплантации в брюшной отдел аорты сохранили проходимость в течение всего срока имплантации (1 мес).
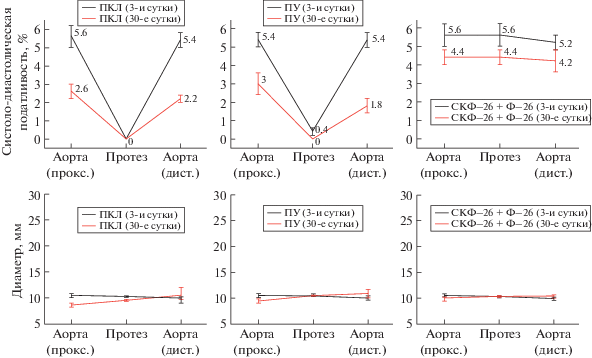
По данным аортографии пульсация образцов протезов из ПКЛ и из ПТФЭ, имплантированных в брюшную аорту, отсутствовала, пульсация у образцов протезов из ПУ была минимальна (0.4%) и сохранялась только в первые сутки после операции. Пульсация образцов протезов из СКФ–26 + + Ф–26 лишь немного ослабевала в течение срока имплантации. Систоло-диастолическая податливость аорты при давлении (120/80 мм рт.ст.) проксимальнее протеза СКФ–26 + Ф–26, на 30-е сутки изменилась с 5.4 до 4.4%, а в средней части протеза податливость снизилась с 5.6 до 4.4%. В аорте, дистальнее протеза, податливость уменьшилась с 5.2 до 4.2%. Средний диаметр протеза СКФ–26 + Ф–26, аорты проксимальнее и дистальнее протеза на 30-е сутки увеличились менее, чем на 2% от первоначальных значений (рис. 1).
Рис. 1.
Систоло-диастолическая податливость и диаметр аорты и ПКС из ПКЛ (слева), ПУ (в центре) и СКФ–26 + Ф–26 (справа) при давлении в аорте 120/80 мм рт.ст. на 3-и и 30-е сутки по данным аортографии. Данные для образца протеза из пористого ПТФЭ совпадают с данными для ПКЛ.
По данным гистологического исследования через 1 мес после имплантации капсула образов протезов из ПКЛ и из ПТФЭ состояла из фиброзной ткани с хаотично расположенными клетками фибробластического ряда и воспалительными инфильтратами. Относительно тонкая капсула образцов протезов из ПУ содержала клетки фибробластического ряда так же без четкой структурной организации.
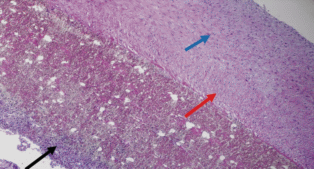
Капсула образцов протезов из СКФ–26 + Ф–26 имела слоистую структуру. Наружная капсула протеза представлена соединительной тканью. Во внутренней капсуле ближе к просвету сосуда гладкомышечные клетки ориентированы продольно, а гладкомышечные клетки, расположенные ближе к протезу, – поперечно, внутренняя поверхность капсулы протеза покрыта тонкой псевдоинтимой. Строма протеза пронизана соединительной тканью (рис. 2).
Рис. 2.
Микрофотография образца протеза СКФ–26 + + Ф–26. Окраска гематоксилином и эозином. Увеличение ×100. Во внутренней капсуле протеза определяется слоистость структуры, которая проявляется в продольном (синяя стрелка) и поперечном (красная стрелка) расположении гладкомышечных клеток относительно оси сосуда. Видны участки заселения клетками стромы протеза (черная стрелка).
По критерию тромбогенности материал СКФ–26 + Ф–26 проявил себя хуже других материалов, тогда как по критерию прорастания трубчатые образцы из этого материала проявили высокую степень интеграции с признаками структурной дифференциации тканей в составе капсулы. При этом вновь сформированная стенка сосуда имеет слоистую структуру и напоминает строение нативной аорты. Ремоделирование проточного канала аорты вблизи проксимального и дистального анастомозов при имплантации эластичных образцов из СКФ–26 + Ф–26 также было минимальным по сравнению с протезами из других материалов.
Таким образом, показано, что биомеханическая совместимость имеет более существенное влияние на интеграцию синтетического сосудистого протеза при его имплантации в артериальное сосудистое русло, чем тромбогенность материала. Вероятно, адекватная физиологическая нагрузка пульсовым давлением и функциональная деформация ткани формируемой капсулы в большей степени позволяют обеспечить адекватное качество прорастания синтетического протеза.
Список литературы
Доброва Н.Б., Носкова Т.И., Новикова С.П. и др. Сборник методических рекомендаций по оценке биосовместимых свойств искусственных материалов, контактирующих с кровью. – Москва, Комитет по новой медицинской технике Минздрава СССР 1991 С. 70.
Дружинин Э.А. Производство и свойства фильтрующих материалов Петрянова из ультратонких полимерных волокон. М.: ИздАТ, 2007. 280 с.
Zhorzholiani Sh.T., Talygin E.A., Krasheninnikov S.V., Tsigankov Y.M., Agafonov A.V., Gorodkov A.Yu. et al. Elasticity change along the aorta is a mechanism for supporting the physiological self-organization of tornado-like blood flow. // Human Physiology. 2018. V. 44. № 5. P. 532–540.
Попова И.В. Экспериментальное изучение сосудистого протеза, изготовленного методом электроспиннинга, 14.01.26, ФГБУ “ННИИПК им. акад. Е.Н. Мешалкина” Минздрава России. 29.06.2016.
European Convention for the Protection of Vertebrate Animals used for Experimental and Other Scientific Purposes EST № 123, Strasbourg, 18.03.1986.
Euroguide on the accommodation and care of animals used for experimental and other scientific purposes. 2007. FELASA: Federation of European Laboratory Animal Science Associations, 25 Shaftesbury Avenue, London W1D 7EG, UK.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


